
探讨儿童成熟B细胞非霍奇金淋巴瘤(B-NHL)患儿的临床特征、疗效、生存情况,以及预后相关危险因素。
选择2010年1月至2018年12月,四川大学华西第二医院收治的67例儿童B-NHL患儿为研究对象。其中,伯基特淋巴瘤/L3急性淋巴细胞白血病(BL/L3-ALL)、弥漫大B细胞淋巴瘤(DLBCL)及其他B-NHL(病理检查结果为骨髓B淋巴细胞高增殖活性,除外上述2种B-NHL)分别为51、11及5例,将其分别纳入BL组、DLBCL组及其他B-NHL组。采用回顾性分析方法,收集3组患儿的临床病例资料,包括确诊年龄、性别、临床特征、实验室检查结果、B-NHL临床分期、治疗与随访结果及预后等。对本组67例B-NHL患儿进行生存分析,如2年和5年总体生存(OS)率、无事件生存(EFS)率。3组患儿的生存曲线比较,采用Cox比例风险回归模型进行分析。根据既往研究结果,并结合临床经验及B-NHL患儿预后影响因素的单因素分析结果,对B-NHL患儿预后影响因素,进行多因素非条件logistic回归分析。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求。3组患儿病程比较,差异无统计学意义(P>0.05)。
①患儿年龄、性别:67例B-NHL患儿确诊时,中位年龄为7.0岁(1.8~14.6岁);其中男性患儿为48例(71.6%),女性为19例(28.4%),男、女患儿比为2.5∶1。3组患儿的年龄、性别构成比比较,差异均有统计学意义(χ2=8.054、8.677,P=0.018、0.013),并且DLBCL组患儿年龄和男性患儿所占比例,分别大于或高于BL组,差异亦均有统计学意义(Z=2.866、P=0.004,χ2=3.892、P=0.049)。②B-NHL原发部位及骨髓和CNS受累情况:化疗前,67例B-NHL患儿均完成影像学、骨髓穿刺涂片及脑脊液检查。BL组中,BL/L3-ALL原发部位位于腹腔者最多,占39.2%(20/51),DLBCL组患儿中,DLBCL原发部位位于外周淋巴结为主,占45.5%(5/11),其他B-NHL组患儿中,原发部位位于腹腔者最多,占60.0%(3/5)。此外,11例患儿存在骨髓和CNS受累(均为BL组患儿)。③实验室检查结果:39例(58.2%)患儿血清LDH水平升高,中位血清LDH水平为498 U/L(153~6 640 U/L)。BL组患儿Bcl-6阳性表达率(86.4%,38/44)和C-MYC基因重排阳性率(96.3%,26/27),均显著高于DLBCL组的54.5%(6/11)和0,并且差异均有统计学意义(χ2=6.960、26.527,P=0.031、<0.001)。④临床分期:3组患儿的临床分期构成比比较,差异有统计学意义(χ2=13.949、P=0.012)。BL组患儿临床分期为Ⅲ/Ⅳ期所占比例(80.4%,41/51),均显著高于DLBCL组的36.4%(4/11),并且差异有统计学意义(χ2=6.740、P=0.009)。⑤随访结果:对67例患儿随访截至时间为2019年3月1日,中位随访时间为49个月(2~104个月),完全缓解(CR)为49例,部分缓解(PR)为7例,进展/复发为9例(5例死亡、3例失访、1例经治疗后无病存活),其他原因所致患儿死亡为2例(1例因严重感染放弃治疗而死亡,1例化疗疗程结束后死亡)。⑥生存情况:67例B-NHL患儿的2年OS率、EFS率分别为88.8%、85.7%,5年OS率、EFS率分别为88.8%、83.2%。3组患儿5年OS率和5年EFS率组间分别比较,差异均无统计学意义(P>0.05)。67例患儿的中位复发时间为9个月(2~37个月),2年、5年累积复发率(CIR)分别为11.3%、13.9%。存在骨髓/CNS受累患儿的5年OS率(71.6%)和5年EFS率(59.7%),均显著低于无骨髓/CNS受累者的92.2%和87.6%,并且差异均有统计学意义(χ2=5.001、6.319,P=0.025、0.012)。⑦单因素分析:复发/进展和非复发/进展患儿的单因素分析结果显示,复发/进展患儿骨髓/CNS受累者所占比例和肿瘤裂解综合征发生率分别为50.0%(4/8)和25.0%(2/8),显著高于非复发/进展患儿的11.9%(7/59)和1.7%(1/59),二者比较,差异有统计学意义(χ2=4.946、P=0.026;P=0.036);复发/进展患儿2个疗程内达CR率(12.5%,1/8)显著低于非复发/进展患儿(69.5%,41/59),二者比较,差异亦有统计学意义(χ2=9.782、P=0.002)。⑧多因素分析:结合已有研究结果及临床经验,以及单因素分析结果,对B-NHL患儿预后影响因素的多因素非条件logistic回归分析结果显示,骨髓/CNS受累(OR=6.536,95%CI:1.085~39.380,P=0.040)和2个疗程内未达CR(OR=14.682,95%CI:1.582~136.240,P=0.018)是B-NHL患儿疾病复发/进展的独立危险因素。
儿童B-NHL以病理类型为BL最为常见,原发部位位于回盲部最为常见;其次为DLBCL,其原发部位位于外周淋巴结最为常见。骨髓/CNS受累和2个疗程未达CR是B-NHL患者发生复发/进展的危险因素。尽管B-NHL患儿2年EFS及5年EFS均>80%,但是,临床分期为Ⅳ期及进展/复发的B-NHL患儿的预后仍然尚待提高。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅。光盘如有质量问题,请向编辑部调换。
非霍奇金淋巴瘤(non-Hodgkin lymphomas,NHL)是儿童常见恶性肿瘤,发生率位居儿童恶性肿瘤第4位,在<5岁儿童中发病率约为5.9/100万,5~14岁儿童中为10/100万[1]。其中,成熟B细胞非霍奇金淋巴瘤(mature B-cell non-Hodgkin lymphoma,B-NHL)最为多见,占儿童NHL的50% ~ 60%[2]。B-NHL主要包括3种病理类型:以伯基特淋巴瘤/L3急性淋巴细胞白血病(Burkitt lymphoma/leukemia/L3-acute lymphoblastic leukemia, BL/L3-ALL)最为常见(约占儿童B-NHL的80%),其次为弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL),占儿童B-NHL的10%~20%;而原发于纵隔的B细胞淋巴瘤(primary mediastinal B-cell lymphoma, PMBCL),仅占儿童B-NHL的2%[1,2,3]。这3种病理类型儿童B-NHL起源于不同前体细胞,并且具有独特的分子遗传学改变,因此在临床表现和预后方面具有一定异质性[2]。目前,国际上对儿童B-NHL患儿采用短疗程、高强度、多药联合和中枢神经系统(central nervous system,CNS)预防治疗策略,B-NHL患儿长期生存率可达80%。尽管儿童B-NHL复发率较低,但是一旦复发预后极差,复发/难治性B-NHL患儿总体生存(overall survival,OS)率仅为20%~30%[3]。因此,进一步提高复发/难治性B-NHL患儿的长期生存率是亟待解决的临床难题。本研究对四川大学华西第二医院收治的67例B-NHL患儿的临床病理特点及预后情况进行回顾性分析,探讨导致儿童B-NHL复发及死亡的相关危险因素,旨在为儿童B-NHL的诊治提供参考。现将研究结果报道如下。
选择2010年1月至2018年12月,四川大学华西第二医院收治的67例儿童B-NHL患儿为研究对象。按照BL、DLBCL及其他B-NHL(病理检查结果为骨髓B淋巴细胞高增殖活性,除外上述2种B-NHL)病理类型,将其分别纳入BL组(n=51),DLBCL组(n=11)和其他B-NHL组(n=5)。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求。
本研究纳入标准:①经活组织病理学检查结果证实为BL、DLBCL、非特指成熟B细胞NHL(介于DLBCL和BL之间)患儿,或介于DLBCL与经典型霍奇金淋巴瘤(classical Hodgkin lymphoma)之间的患儿。②骨髓穿刺或渗出液诊断标准与免疫分型:骨髓或渗出液涂片可见幼稚淋巴细胞,则可诊断为B-NHL。通常B-NHL免疫分型为仅表达CD19、CD79a、CD20、SmIgM(或κ或λ),而不表达前驱淋巴细胞抗原(TdT和CD34)和髓系抗原。③患儿年龄<18岁。④无先天性或后天性获得性免疫缺陷病患儿。排除标准:①入院确诊后即放弃治疗者;②既往有化疗史(除外单纯使用激素<7 d)者;③患有非B-NHL所致的伴有脏器功能不全的其他基础疾病患儿;④未完成诱导化疗即放弃治疗者。
本研究观察指标包括患儿性别,初诊年龄,初诊时外周血白细胞计数,血红蛋白(hemoglobin,Hb)含量,血小板计数,肝、肾功能,血清乳酸脱氢酶(lactate dehydrogenase,LDH)水平及骨髓穿刺涂片或渗出液免疫组化等指标。
对所有患儿治疗前均进行明确临床分期,进行临床分期的常规检查项目包括全身体格检查,骨髓穿刺涂片,脑脊液细胞病理学检查,胸部、腹部、盆腔影像学检查(以增强CT检查为主,条件允许者可行PET/CT),必要时行头颅MRI或增强CT。所有患儿临床分期均采用St.Jude分期系统进行分期[4]。
对67例B-NHL患儿根据其个体情况,采用以下2种治疗方案。①对14例患儿采用法国儿科肿瘤学协会制定的LMB-89方案[5]进行治疗。根据肿块切除情况、临床分期和治疗早期反应等,将其分为不同危险度临床分组,并采用不同强度化疗方案治疗。对于临床危险度高者,则采用较高剂量甲氨蝶呤(methotrexate,MTX)(8 g/m2)治疗,并给予高剂量阿糖胞苷(cytarabine,Ara-C)和依托泊苷(VP-16)进行巩固治疗。②对其余53例患儿,则采用中国儿童肿瘤协作组《B细胞非霍奇金淋巴瘤-2010化疗(CCCG-BNHL-2010)方案》[6],以及在此方案基础上,中国抗癌协会儿科专业委员会联合中华医学会儿科学分会血液学组制定的《儿童和青少年成熟B细胞非霍奇金淋巴瘤方案(CCCG-BNHL-2015方案)》[7]进行治疗。根据B-NHL患儿临床分期、血清LDH水平、肿块切除和治疗早期反应,将其分为不同危险度临床分组,主要化疗药物为环磷酰胺、异环磷酰胺、多柔比星及不同剂量MTX、Ara-C和VP-16。
2个治疗组中,联合利妥昔单抗治疗具体用法为每个化疗疗程前1 d或化疗第1天(d 0或d 1)给予利妥昔单抗375 mg/m2,共计使用2~4个疗程。对其中7例在化疗结束后,进行自体造血干细胞移植(autologous hematopoietic stem cell transplantation,AHSCT)。
本研究对于儿童B-NHL的疗效判断标准,在参考文献[6]的基础上,再根据临床诊疗经验,制定本研究的疗效判定标准:完全缓解(complete response,CR),部分缓解(partial response,PR)和进展/复发。
本研究采取的随访方式包括:查阅患儿病例资料及门、急诊病历记录,对患儿家属进行电话随访。① OS期定义:确诊之日起至任何原因所致患儿死亡,或至失访之日,或随访终点时间;②无事件生存(event-free survival,EFS)期:从确诊之日起至发生事件(B-NHL进展/复发,患儿任何原因死亡、失访和继发第2肿瘤)的时间;③失访:是指完成第2个疗程诱导化疗后放弃治疗,或结束化疗后1年内无任何形式患儿随访记录,以末次随访时间和疾病状态进行统计。④生存期:计算至患儿末次随访日。⑤累积复发率(cumulative incidence of relapse, CIR):依据从CR至B-NHL复发的时间进行计算。
本研究采用SPSS 19.0统计学软件对数据进行统计学处理、分析。采用Ssize软件确定满足本研究统计检验的最小样本量。对于年龄等呈非正态分布的计量资料,采用M(P25~P75)表示,3组间整体比较,采用Kruskal-WallisH秩和检验,3组间两两比较,采用Wilcoxon秩和检验。对于性别、临床分期与病理类型构成比,以及不同血清LDH水平所占比例等计数资料,采用百分比(%)表示,组间比较,采用χ2检验、连续校正性χ2检验或者Fisher确切概率法。所有B-NHL患儿的生存分析(2年OS率、EFS率,5年OS率、EFS率),采用Kaplan-Meier法,3组患儿的生存曲线比较,采用Cox比例风险回归模型进行分析。根据既往研究结果,并结合临床经验及对影响B-NHL患儿预后临床因素的单因素分析结果,对B-NHL患儿预后的影响因素,进行多因素非条件logistic回归分析。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
本研究纳入的67例患儿确诊B-NHL时的中位年龄为7.0岁(1.8~14.6岁);男性患儿为48例(71.6%),女性为19例(28.4%),男、女患儿比为2.5∶1。3组患儿的年龄、性别构成比比较,差异均有统计学意义(P<0.05)。进一步两两比较结果显示,DLBCL组患儿年龄和男性患儿所占比例,均超过BL组,差异有统计学意义(P<0.05)。3组B-NHL患儿一般临床资料比较,见表1。
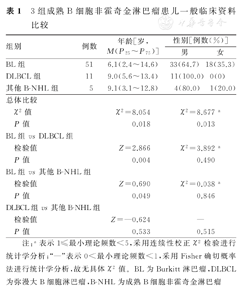
3组成熟B细胞非霍奇金淋巴瘤患儿一般临床资料比较
3组成熟B细胞非霍奇金淋巴瘤患儿一般临床资料比较
| 组别 | 例数 | 年龄[岁,M(P25~P75)] | 性别[例数(%)] | ||
|---|---|---|---|---|---|
| 男 | 女 | ||||
| BL组 | 51 | 6.1(2.4~14.6) | 33(64.7) | 18(35.3) | |
| DLBCL组 | 11 | 9.0(5.6~13.4) | 11(100.0) | 0(0) | |
| 其他B-NHL组 | 5 | 9.1(3.1~12.8) | 4(80.0) | 1(20.0) | |
| 总体比较 | |||||
| χ2值 | χ2=8.054 | χ2=8.677 a | |||
| P值 | 0.018 | 0.013 | |||
| BL组vs DLBCL组 | |||||
| 检验值 | Z=2.866 | χ2=3.892 a | |||
| P值 | 0.004 | 0.490 | |||
| BL组vs其他B-NHL组 | |||||
| 检验值 | Z=0.690 | χ2=0.038 a | |||
| P值 | 0.049 | 0.846 | |||
| DLBCL组vs其他B-NHL组 | |||||
| 检验值 | Z=—0.624 | — | |||
| P值 | 0.533 | 0.515 | |||
注:a表示1≤最小理论频数<5,采用连续性校正χ2检验进行统计学分析;"—"表示0<最小理论频数<1,采用Fisher确切概率法进行统计学分析,故无具体χ2值。BL为Burkitt淋巴瘤,DLBCL为弥漫大B细胞淋巴瘤,B-NHL为成熟B细胞非霍奇金淋巴瘤
对67例B-NHL患儿在化疗前,均完成影像学、骨髓穿刺涂片及脑脊液细胞病理学检查。BL组51例患儿中,原发部位位于腹腔者最多,占39.2%(20/51),包括回盲部包块起病者9例(9/20,45.0%);其次,外周淋巴结为12例(12/51,23.5%),鼻咽部为8例(8/51,15.7%),颌面部为6例(6/51,11.8%),口咽部为2例(2/51,3.9%),纵隔、椎管内及骨髓各为1例(1/51,2.0%)。DLBCL组患儿原发部位位于外周淋巴结为主(5/11),其次回盲部为3例(3/11)。其他B-NHL组患儿中,原发于腹腔者为3例(3/5),外周淋巴结和口咽部各为1例(1/5)。
对67例B-NHL患儿于化疗前进行头颅影像学、骨髓穿刺涂片及脑脊液检查的结果显示,56例患儿无骨髓和CNS受累,11例(16.4%)存在骨髓和CNS受累,均为BL组患儿。骨髓和CNS受累患儿中,骨髓浸润者为6例(6/51,11.8%),CNS受累为5例(5/51,9.8%),其中颅内占位病变为2例,脑脊液细胞病理学检查结果显示可见肿瘤细胞者为3例。
67例B-NHL患儿的血清LDH水平中位数为498 U/L(153~6 640 U/L),其中39例(58.2%)血清LDH水平升高。血清LDH水平< 2 N (N为血清LDH正常参考值的上限值)者为45例(45/67,67.2%),(2~4) N者为10例(10/67,14.9%),>4 N者为12例(12/67,17.9%)。3组患儿血清LDH水平比较,见表2。
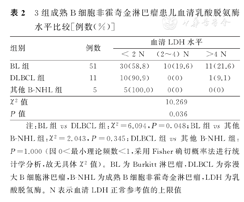
3组成熟B细胞非霍奇金淋巴瘤患儿血清乳酸脱氨酶水平比较[例数(%)]
3组成熟B细胞非霍奇金淋巴瘤患儿血清乳酸脱氨酶水平比较[例数(%)]
| 组别 | 例数 | 血清LDH水平 | ||
|---|---|---|---|---|
| < 2 N | (2~4) N | >4 N | ||
| BL组 | 51 | 30(58.8) | 10(19.6) | 11(21.6) |
| DLBCL组 | 11 | 10(90.9) | 0(0) | 1(9.1) |
| 其他B-NHL组 | 5 | 5(100.0) | 0(0) | 0(0) |
| χ2值 | 10.269 | |||
| P值 | 0.036 | |||
注:BL组vs DLBCL组:χ2=6.094,P=0.048;BL组vs其他B-NHL组:χ2=2.043,P=0.345;DLBCL组vs其他B-NHL组:P=1.000 (因0<最小理论频数<1,采用Fisher确切概率法进行统计学分析,故无具体χ2值)。BL为Burkitt淋巴瘤,DLBCL为弥漫大B细胞淋巴瘤,B-NHL为成熟B细胞非霍奇金淋巴瘤,LDH为乳酸脱氢酶。N表示血清LDH正常参考值的上限值
67例B-NHL患儿中,除1例B-AL患儿经骨髓穿刺涂片及流式细胞学检查被确诊为B-NHL外,其余66例患儿,均经组织病理学检查后进一步行免疫组化检查而被确诊为B-NHL。BL组51例患儿中,Bcl-2及Bcl-6阳性表达率分别为15.9%(7/45)、86.4%(38/44);对其中28例患儿采取荧光原位杂交技术(fluorescencein situ hybridization,FISH)进行染色体检测结果示,C-MYC基因重排阳性率为96.3%(26/27)。DLBCL组11例患儿中,Bcl-2及Bcl-6阳性表达率分别为37.5%(3/8)、54.5%(6/11),对其中3例患儿采取FISH进行染色体检测结果示,C-MYC基因重排均呈阴性。5例其他B-NHL组患儿中,Bcl-2及Bcl-6阳性表达率分别为60.0%(3/5)、100.0%(5/5),对其中1例患儿采取FISH进行染色体检测结果显示,C-MYC基因重排呈阳性。BL组患儿Bcl-6阳性表达率和C-MYC基因重排阳性率,均显著高于DLBCL组,并且差异均有统计学意义(χ2=6.960、26.527,P=0.031、<0.001)。
67例B-NHL患儿中,临床分期Ⅰ、Ⅱ、Ⅲ及Ⅳ期者,分别为3例(3/67,4.5%),17例(17/67,25.4%),36例(36/67,53.7%)及11例(11/67,16.4%)。3组患儿不同临床分期构成比比较,差异有统计学意义(P<0.05)。BL组患儿临床分期为Ⅲ/Ⅳ期所占比例(80.4%,41/51),均显著高于DLBCL组(36.4%,4/11),二者比较,差异有统计学意义(χ2=6.740,P=0.009)。3组患儿临床分期比较,见表3。
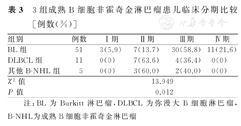
3组成熟B细胞非霍奇金淋巴瘤患儿临床分期比较[例数(%)]
3组成熟B细胞非霍奇金淋巴瘤患儿临床分期比较[例数(%)]
| 组别 | 例数 | Ⅰ期 | Ⅱ期 | Ⅲ期 | Ⅳ期 |
|---|---|---|---|---|---|
| BL组 | 51 | 3(5.9) | 7(13.7) | 30(58.8) | 11(21.6) |
| DLBCL组 | 11 | 0(0) | 7(63.6) | 4(36.4) | 0(0) |
| 其他B-NHL组 | 5 | 0(0) | 3(60.0) | 2(40.0) | 0(0) |
| χ2值 | 13.949 | ||||
| P值 | 0.012 | ||||
注:BL为Burkitt淋巴瘤,DLBCL为弥漫大B细胞淋巴瘤,B-NHL为成熟B细胞非霍奇金淋巴瘤
对67例B-NHL患儿进行化疗后,对其中7例进一步采取AHSCT措施,对35例联合利妥昔单抗治疗,治疗过程中发生严重并发症者为8例,其中脓毒症为3例(病原菌分别为屎肠球菌、大肠埃希菌和解鸟氨酸克雷伯菌),肿瘤溶解综合征为3例,化疗过程中发生肠穿孔为1例,合并间质性肺疾病导致严重呼吸困难而放弃治疗出院为1例。因上述严重并发症所致患儿死亡为1例,治疗相关死亡率为1.5%(1/67)。
对67例患儿随访至2019年3月1日,中位随访时间为49个月(2~104个月)。67例患儿中,达到CR者为49例,PR者为7例,进展/复发者为9例(5例死亡、3例失访、1例经治疗后无病存活),其他原因所致患儿死亡为2例(1例因严重感染放弃治疗而死亡,1例化疗疗程结束后死亡)。
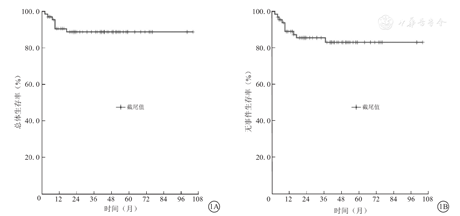
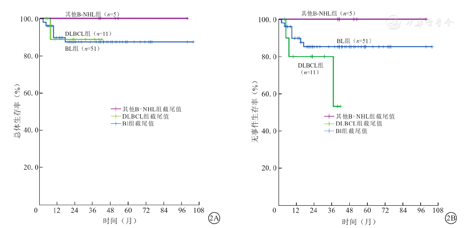
67例B-NHL患儿的中位复发时间为9个月(2~37个月);2年OS率及EFS率分别为88.8%、85.7 %,5年OS率及EFS率分别为88.8%、83.2 %(图1);2年及5年CIR分别为11.3%、13.9%。3组患儿5年OS率及EFS率分别组间比较,差异均无统计学意义(P>0.05)。3组B-NHL患儿5年OS率和EFS率比较,见表4、图2。
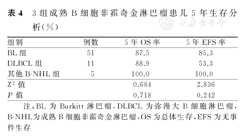
3组成熟B细胞非霍奇金淋巴瘤患儿5年生存分析(%)
3组成熟B细胞非霍奇金淋巴瘤患儿5年生存分析(%)
| 组别 | 例数 | 5年OS率 | 5年EFS率 |
|---|---|---|---|
| BL组 | 51 | 87.5 | 85.3 |
| DLBCL组 | 11 | 88.9 | 53.3 |
| 其他B-NHL组 | 5 | 100.0 | 100.0 |
| χ2值 | 0.684 | 2.836 | |
| P值 | 0.718 | 0.242 |
注:BL为Burkitt淋巴瘤,DLBCL为弥漫大B细胞淋巴瘤,B-NHL为成熟B细胞非霍奇金淋巴瘤,OS为总体生存,EFS为无事件生存


注:BL为Burkitt淋巴瘤,DLBCL为弥漫大B细胞淋巴瘤,B-NHL为成熟B细胞非霍奇金淋巴瘤
本组67例B-NHL患儿不同临床因素的5年OS率和5年EFS率比较结果显示,存在骨髓/CNS受累患儿的5年OS率和EFS率分别为71.6%和59.7%,均显著低于无骨髓/CNS受累者的92.2%和87.67%,并且差异均有统计学意义(P<0.05)。本组B-NHL患儿不同临床因素的5年OS率及5年EFS率比较,见表5。
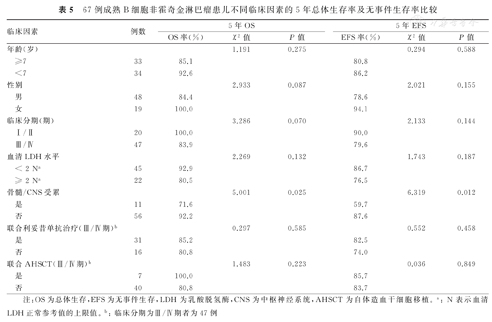
67例成熟B细胞非霍奇金淋巴瘤患儿不同临床因素的5年总体生存率及无事件生存率比较
67例成熟B细胞非霍奇金淋巴瘤患儿不同临床因素的5年总体生存率及无事件生存率比较
| 临床因素 | 例数 | 5年OS | 5年EFS | |||||
|---|---|---|---|---|---|---|---|---|
| OS率(%) | χ2值 | P值 | EFS率(%) | χ2值 | P值 | |||
| 年龄(岁) | 1.191 | 0.275 | 0.294 | 0.588 | ||||
| ≥7 | 33 | 85.1 | 80.8 | |||||
| <7 | 34 | 92.6 | 86.2 | |||||
| 性别 | 2.933 | 0.087 | 2.021 | 0.155 | ||||
| 男 | 48 | 84.4 | 78.6 | |||||
| 女 | 19 | 100.0 | 94.1 | |||||
| 临床分期(期) | 3.286 | 0.070 | 2.133 | 0.144 | ||||
| Ⅰ/Ⅱ | 20 | 100.0 | 90.0 | |||||
| Ⅲ/Ⅳ | 47 | 83.9 | 79.6 | |||||
| 血清LDH水平 | 2.269 | 0.132 | 1.743 | 0.187 | ||||
| < 2 Na | 45 | 92.9 | 86.7 | |||||
| ≥ 2 Na | 22 | 80.5 | 76.5 | |||||
| 骨髓/CNS受累 | 5.001 | 0.025 | 6.319 | 0.012 | ||||
| 是 | 11 | 71.6 | 59.7 | |||||
| 否 | 56 | 92.2 | 87.6 | |||||
| 联合利妥昔单抗治疗(Ⅲ/Ⅳ期)b | 0.297 | 0.585 | 0.552 | 0.458 | ||||
| 是 | 31 | 85.2 | 82.5 | |||||
| 否 | 16 | 80.8 | 74.0 | |||||
| 联合AHSCT(Ⅲ/Ⅳ期)b | 1.483 | 0.223 | 0.036 | 0.849 | ||||
| 是 | 7 | 100.0 | 85.7 | |||||
| 否 | 40 | 80.8 | 83.7 | |||||
注:OS为总体生存,EFS为无事件生存,LDH为乳酸脱氢酶,CNS为中枢神经系统,AHSCT为自体造血干细胞移植。a: N表示血清LDH正常参考值的上限值。b:临床分期为Ⅲ/Ⅳ期者为47例
截至随访终点,对复发/进展和非复发/进展患儿的单因素分析结果显示,复发/进展患儿骨髓/CNS受累者所占比例和肿瘤裂解综合征发生率,均显著高于非复发/进展患儿,二者比较,差异均有统计学意义(P<0.05);复发/进展患儿2个疗程内达CR率,显著低于非复发/进展患儿,并且差异亦有统计学意义(P<0.05)。影响B-NHL患儿预后临床因素的单因素分析结果,见表6。
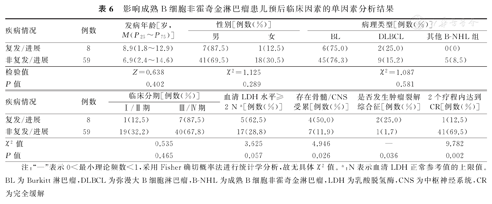
影响成熟B细胞非霍奇金淋巴瘤患儿预后临床因素的单因素分析结果
影响成熟B细胞非霍奇金淋巴瘤患儿预后临床因素的单因素分析结果
| 疾病情况 | 例数 | 发病年龄[岁,M(P25~P75)] | 性别[例数(%)] | 病理类型[例数(%)] | |||
|---|---|---|---|---|---|---|---|
| 男 | 女 | BL | DLBCL | 其他B-NHL组 | |||
| 复发/进展 | 8 | 8.9(1.8~12.9) | 7(87.5) | 1(12.5) | 6(75.0) | 2(25.0) | 0(0) |
| 非复发/进展 | 59 | 6.9(2.4~14.6) | 41(69.5) | 18(30.5) | 45(76.3) | 9(15.2) | 5(8.5) |
| 检验值 | Z=0.638 | χ2=1.125 | χ2=1.087 | ||||
| P值 | 0.402 | 0.289 | 0.581 | ||||
| 疾病情况 | 例数 | 临床分期[例数(%)] | 血清LDH水平≥2 N a[例数(%)] | 存在骨髓/CNS受累[例数(%)] | 是否发生肿瘤裂解综合征[例数(%)] | 2个疗程内达到CR[例数(%)] | |
|---|---|---|---|---|---|---|---|
| Ⅰ/Ⅱ期 | Ⅲ/Ⅳ期 | ||||||
| 复发/进展 | 8 | 1(12.5) | 7(87.5) | 5(62.5) | 4(50.0) | 2(25.0) | 1(12.5) |
| 非复发/进展 | 59 | 19(32.2) | 40(67.8) | 17(28.8) | 7(11.9) | 1(1.7) | 41(69.5) |
| χ2值 | 0.535 | 3.625 | 4.946 | — | 9.782 | ||
| P值 | 0.465 | 0.057 | 0.026 | 0.036 | 0.002 | ||
注:"—"表示0<最小理论频数<1,采用Fisher确切概率法进行统计学分析,故无具体χ2值。a:N表示血清LDH正常参考值的上限值。BL为Burkitt淋巴瘤,DLBCL为弥漫大B细胞淋巴瘤,B-NHL为成熟B细胞非霍奇金淋巴瘤,LDH为乳酸脱氢酶,CNS为中枢神经系统,CR为完全缓解
结合已有研究结果及临床经验,以及单因素分析结果,将影响B-NHL患儿预后的8项临床因素,进行多因素非条件logistic回归分析,其变量含义及赋值情况,见表7。对这8项因素进行多因素非条件logistic回归分析的结果显示,骨髓/CNS受累(OR=6.536,95%CI:1.085~39.380,P=0.040),治疗2个疗程内未达CR(OR=14.682,95%CI:1.582~136.240,P=0.018),是导致B-NHL患儿疾病复发/进展的独立危险因素。影响B-NHL患儿预后的8项临床因素的多因素非条件logistic回归分析,见表8。

影响成熟B细胞非霍奇金淋巴瘤患儿预后的8项临床因素的多因素非条件logistic回归分析变量含义及其赋值情况
影响成熟B细胞非霍奇金淋巴瘤患儿预后的8项临床因素的多因素非条件logistic回归分析变量含义及其赋值情况
| 自变量/因变量 | 变量名 | 赋值 |
|---|---|---|
| 疾病是否复发/进展 | y | y=0表示疾病无复发/进展,y=1表示疾病有复发/进展 |
| 年龄 | x1 | x1=0表示年龄<9岁;x1=1表示年龄≥9岁 |
| 性别 | x2 | x2=0表示女性;x2=1表示男性 |
| 病理类型是否为BL | x3 | x3=0表示病理类型为非BL;x3=1表示病理类型为BL |
| 临床分期 | x4 | x4=0表示临床分期为Ⅰ/Ⅱ期;x4=1表示临床分期为Ⅲ/Ⅳ期 |
| 血清LDH水平 | x5 | x5=0表示血清LDH水平<4 N;x5=1表示血清LDH水平≥4 Na |
| 骨髓/CNS是否受累 | x6 | x6=0表示骨髓/CNS未受累;x6=1表示骨髓/CNS受累 |
| 是否发生肿瘤裂解综合征 | x7 | x7=0表示未发生肿瘤裂解综合征;x7=1表示发生肿瘤裂解综合征 |
| 2个疗程内是否达到CR | x8 | x8=0表示2个疗程内未达到CR;x8=1表示2个疗程内达到CR |
注:BL为Burkitt淋巴瘤,LDH为乳酸脱氢酶,CNS为中枢神经系统,CR为完全缓解。a:N表示血清LDH正常参考值的上限值
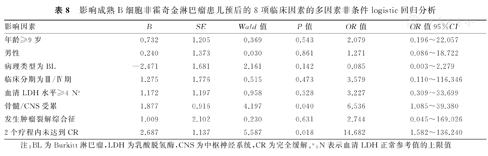
影响成熟B细胞非霍奇金淋巴瘤患儿预后的8项临床因素的多因素非条件logistic回归分析
影响成熟B细胞非霍奇金淋巴瘤患儿预后的8项临床因素的多因素非条件logistic回归分析
| 影响因素 | B | SE | Wald值 | P值 | OR值 | OR值95%CI |
|---|---|---|---|---|---|---|
| 年龄≥9岁 | 0.732 | 1.205 | 0.369 | 0.543 | 2.079 | 0.196~22.057 |
| 男性 | 0.240 | 1.373 | 0.030 | 0.861 | 1.271 | 0.086~18.722 |
| 病理类型为BL | —2.471 | 1.681 | 2.161 | 0.142 | 0.085 | 0.003~2.279 |
| 临床分期为Ⅲ/Ⅳ期 | 1.275 | 1.776 | 0.515 | 0.473 | 3.579 | 0.110~116.346 |
| 血清LDH水平≥4 Na | 1.172 | 1.197 | 0.958 | 0.328 | 3.227 | 0.309~33.699 |
| 骨髓/CNS受累 | 1.877 | 0.916 | 4.197 | 0.040 | 6.536 | 1.085~39.380 |
| 发生肿瘤裂解综合征 | 1.009 | 2.102 | 0.230 | 0.631 | 2.744 | 0.045~169.026 |
| 2个疗程内未达到CR | 2.687 | 1.137 | 5.587 | 0.018 | 14.682 | 1.582~136.240 |
注:BL为Burkitt淋巴瘤,LDH为乳酸脱氢酶,CNS为中枢神经系统,CR为完全缓解。a:N表示血清LDH正常参考值的上限值
NHL是一组起源于淋巴结和其他淋巴组织的恶性肿瘤,约占儿童肿瘤性疾病的7%[8]。成年人NHL常表现为惰性,儿童NHL中,B-NHL是一组异质性疾病,占儿童NHL的50%~60%,呈高度侵袭性[1]。既往对NHL患儿的标准化疗方案为环磷酰胺+多柔比星+长春新碱+泼尼松(CHOP)或CHOP样方案,晚期NHL患儿的长期生存率仅为30%~40%[9,10]。目前,随着治疗方案不断改进,目前国际上广泛开始采用短疗程、高强度、多药联合和CNS预防的治疗策略,使该病患儿长期生存率显著提高,可达85%~90%[11,12]。
本研究纳入的67例B-NHL患儿的中位发病年龄为7.0岁(1.8~14.6岁),并且以男性患儿多见,男、女患儿比为2.5∶1,这与叶启东等[13]和Samochatova等[14]文献报道相似。儿童B-NHL患儿常见的病理类型为BL、DLBCL和PMBCL 3种。其中,病理类型为BL者最为常见,约占80%,中位发病年龄为7.8岁,5~14岁儿童发病率为3.5/100万,>14岁儿童发病率随年龄增长有所降低,15~19岁儿童发病率降至2/100万[15,16]。其次为DLBCL,占10%~20%,亦常见于男性患儿,发病率在儿童时期呈逐渐增高趋势,15~19岁约为5.5/100万[2,16]。病理类型为PMBCL者仅占2%,中位发病年龄为15.7岁,女性患儿发病率高于男性患儿[3,17]。这与本研究结果相似。本研究结果显示,病理类型为BL和DLBCL患儿分别为76.1%(51/67)和16.4%(11/67)。此外,BL组和DLBCL组患儿的中位发病年龄均低于国外文献[2,15,16]报道,推测可能与我国>14岁的B-NHL患儿就诊于成年人血液/肿瘤科有关。
儿童B-NHL共同临床特点为增殖周期短、肿瘤负荷大并且具有高度侵袭性[18]。但是,由于不同病理类型的儿童B-NHL分别起源于不同的前体细胞,导致其在生物学和临床特征上具有一定异质性。首先,BL、DLBCL和其他B-NHL三者好发部位不同:BL最常见的原发部位为腹部,尤其是回盲部,其次为韦氏环[19,20];DLBCL原发部位则常见于外周淋巴结[2];而其他B-NHL则表现为纵隔巨大占位。本组67例患儿中,BL最常见的原发部位为腹部,尤其是回盲部,患儿常因肠套叠就诊于小儿外科。其次,BL、DLBCL和其他B-NHL三者的受累部位亦不相同:病理类型为BL者早期易转移至骨髓或CNS,初诊时约20%患儿即存在骨髓/CNS受累[1];而病理类型为DLBCL者骨髓/CNS受累发生率低于病理类型为BL者。此外,由于病理类型为其他B-NHL患儿多原发于纵隔,因此易发生肺部转移,约40%患儿存在胸腔积液或心包积液[21]。本组67例患儿中,有骨髓和(或)CNS受累者均为BL组患儿。再者,BL、DLBCL和其他B-NHL三者的临床分期亦有所不同。BL患儿临床进展快,易早期发生骨髓/CNS受累,因此,就诊时肿瘤负荷重,血清LDH水平显著升高,临床分期多为Ⅲ/Ⅳ期;其他B-NHL患儿血清LDH水平高于DLBCL患儿,临床分期以Ⅲ期为主;而DLBCL患儿则常表现为局灶性病变,因此,血清LDH水平低于BL和其他B-NHL患儿,并且临床分期以Ⅱ/Ⅲ期为主[2]。本研究中,BL组患儿临床分期为Ⅲ/Ⅳ期所占比例(80.4%, 41/51)显著高于DLBCL组(36.4%,4/11),并且差异有统计学意义(P=0.009),此外,BL组患儿临床分期为Ⅲ/Ⅳ期所占比例显著高于文献报道的60%~70%[2,22],究其原因,可能与我院位于西部地区,而西部地区经济较落后、部分患儿家属文化程度较低,而未及时就诊有关。
BL、DLBCL和其他B-NHL分别起源于不同的前体细胞,并且具有独特的分子遗传学改变,从而导致肿瘤的发生。其中,BL和DLBCL均来自生发中心B细胞,都表达共同B细胞抗原(如CD20和CD79a),但是BL患儿通常共表达CD10和Bcl-6,Bcl-2一般呈阴性[23];而在DLBCL患儿中,约37%表达Bcl-2[24]。此外,细胞遗传学研究结果显示,几乎所有BL患儿均存在C-MYC基因的重排,而DLBCL患者中,C-MYC基因重排阳性表达率仅为34%[25,26]。这与本研究结果相似。本研究中,BL组患儿Bcl-6阳性表达率为86.4%,C-MYC基因重排阳性表达率为100.0%,均显著高于DLBCL组的54.5%和0,并且差异均有统计学意义(P=0.031、<0.001);但是,当肿瘤细胞具有DLBCL的形态学特征和BL的遗传学及免疫表型时,临床诊断则较困难。近年,随着高通量测序的应用,逐渐发现BL、DLBCL和PMBCL亦呈现出不同的特定基因标签,不仅有助于临床诊断及鉴别诊断,而且对进一步优化分层诊断和治疗、开发新型靶向治疗手段具有重要临床意义。
本组患儿67例B-NHL患儿中,2年EFS率为85.7%,5年EFS率为83.2%,与国外文献报道仍有一定差距[27,28,29,30]。尽管儿童B-NHL复发率较低,但是一旦复发预后极差,复发/难治性B-NHL患儿的OS率仅为20%~30%[31,32,33,34]。目前比较公认可能与B-NHL预后相关的因素包括血清LDH水平>2 N、骨髓/CNS受累、对治疗反应差及预后较差的细胞遗传学改变(如+7q,-13q)[35,36,37]。本研究对不同临床因素与B-NHL患儿5年OS率和5年EFS比较结果显示,存在骨髓/CNS受累者5年OS率和5年EFS率,均显著低于无骨髓/CNS受累者,并且差异均有统计学意义(P<0.05)。进一步对复发/进展和非复发/进展患儿的不同临床因素进行比较,结果显示复发/进展患儿骨髓/CNS受累者所占比例显著高于非进展/复发患儿,二者比较,差异有统计学意义(P<0.05);从治疗反应来看,复发/进展组患儿治疗初期易发生肿瘤裂解综合征,并且2个疗程内达CR率,显著低于非进展/复发患儿(均为P<0.05)。进一步进行多因素非条件logistic回归分析结果显示,骨髓/CNS受累(OR=6.536,95%CI:1.085~39.380,P=0.040)和2个疗程内未达CR(OR=14.682,95%CI:1.582~136.240,P=0.018)是儿童B-NHL患儿复发/进展的独立危险因素。
此外,靶向药物利妥昔单抗能特异结合B细胞上的CD20抗原,介导抗体/补体依赖性的细胞毒作用并清除B淋巴细胞来源的肿瘤细胞。超过98%儿童B-NHL患儿表达CD20抗原,目前,美国儿童肿瘤协作组(Children′s Oncology Group)研究结果显示,采用FAB/LMB96方案联合利妥昔单抗治疗儿童B-NHL安全有效,临床分期为Ⅲ/Ⅳ期者3年EFS率达95%,骨髓/CNS受累者3年EFS率可达90%[38] 。
儿童B-NHL具有高度侵袭性,目前针对儿童B-NHL有不同的治疗方案,但是治疗策略均为短疗程、高强度、多药联合和CNS预防。本组67例B-NHL患儿2年及5年EFS率均>80%,但是与国外仍有一定差距[27,28]。此外,骨髓/CNS受累和2个疗程内未达CR是B-NHL患儿疾病复发/进展的独立危险因素。因本研究纳入样本量较少,联合应用利妥昔单抗对患儿5年EFS率的影响仍尚未证实。因此,目前对于儿童B-NHL,应继续规范化治疗,根据不同病理类型进行分层治疗,并根据临床分期调整治疗强度,提高临床分期为晚期及高风险B-NHL患儿的生存率仍是今后工作的重点。
所有作者均声明不存在利益冲突






























