
探讨肿瘤切除术前全腹CT检查,对妇科恶性肿瘤盆、腹腔淋巴结转移的诊断价值。
选择2018年3月1日至12月31日,于四川大学华西第二医院接受诊治的275例妇科恶性肿瘤患者为研究对象。术前,对其均进行全腹CT+增强CT检查。对CT检查结果显示淋巴结最短直径≥10 mm、淋巴结中心性坏死、淋巴结融合或成簇聚集3项中符合任意一项者,判断为有淋巴结转移。以术后切除淋巴结的组织病理学检查结果,作为诊断淋巴结转移的"金标准"。分析CT诊断妇科恶性肿瘤患者盆、腹腔淋巴结转移的敏感度、特异度、阳性预测值、阴性预测值及准确度等指标。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》。所有患者签署知情同意书。
①275例患者中,宫颈癌患者为169例(61.5%),子宫内膜癌为67例(24.4%),卵巢癌为29例(10.5%)。②术前CT诊断妇科恶性肿瘤患者盆、腹腔淋巴结转移的敏感度为31.0%,特异度为96.6%,阳性预测值为61.9%,阴性预测值为88.6%,准确度为86.5%。③术中对患者盆、腹腔探查结果显示,86例见淋巴结肿大、变硬,其中仅21例患者的切除淋巴结,经术后组织病理学检查,被确诊为淋巴结转移;另外21例患者经术后组织病理学检查,被确诊有淋巴结转移,但术中探查时,未发现淋巴结肿大、融合等异常。
妇科恶性肿瘤患者术前全腹CT检查,对于诊断盆、腹腔淋巴结转移的敏感度较低,特异度较高,对术前评估淋巴结转移具有一定参考价值。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅。光盘如有质量问题,请向编辑部调换。
子宫颈癌、子宫内膜癌、卵巢癌是妇科常见3大恶性肿瘤。美国癌症学会官方期刊CA: A Cancer Journal for Clinicians发布的《2018年全球癌症统计数据》显示,在全球女性的新发病例及导致的患者死亡率中,宫颈癌均位居第4位,卵巢癌和子宫内膜癌的新发病例,亦位于前10位[1]。在妇科恶性肿瘤中,盆、腹腔淋巴结转移,是影响患者预后的重要因素之一,也对术后治疗方案制定有重要指导作用[2,3,4]。盆、腹腔淋巴结清扫术,是妇科恶性肿瘤手术非常重要的环节,但淋巴结切除术与很多并发症密切相关,如术中淋巴结周围组织损伤、出血及手术时间增加、术后淋巴囊肿及深静脉血栓形成、下肢淋巴水肿等。术前评估妇科恶性肿瘤患者淋巴结转移情况,将有助于对患者手术方案的制定,降低淋巴结切除术后相关并发症发生率。术前CT检查具有无创、经济等特点,是评估恶性肿瘤患者有无淋巴结转移的重要方法之一。本研究对术前CT诊断妇科恶性肿瘤患者淋巴结转移情况,与术后切除淋巴结的组织病理学诊断结果进行比较,旨在评估术前全腹CT检查对妇科恶性肿瘤盆、腹腔淋巴结转移的诊断价值。现将研究结果报道如下。
选择2018年3月1日至12月31日,于四川大学华西第二医院经组织病理学检查确诊,并且采取规范手术治疗的275例妇科恶性肿瘤患者为研究对象。患者年龄为19~74岁,人体质量指数为16.6~30.0 kg/m2。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》。所有患者均知情同意,并签署临床研究知情同意书。
本研究纳入标准:①术前分别经宫颈活组织检查(宫颈癌)、诊断性刮宫(子宫内膜癌),以及盆、腹腔肿瘤活检术或腹水穿刺细胞学检查(卵巢癌),诊断为妇科恶性肿瘤,并且手术切除组织的术后组织病理学检查结果,确诊为妇科恶性肿瘤者;②术前接受全腹常规CT及增强CT检查者;③组织病理学检查、影像学及临床资料均齐全者。排除标准:①合并其他系统恶性肿瘤者;②新辅助化疗后行手术治疗的妇科恶性肿瘤患者。③人体质量指数>30 kg/m2者。
所有患者均于术前30 d内行全腹CT检查。采用NeuViz 128 CT(沈阳东软医疗有限公司),患者取仰卧位,自主呼吸,自膈肌至外阴进行全腹扫描,扫描层厚为5 mm,间距为5 mm,平扫之后,进行增强扫描。
所有CT影像资料由2位副高及以上职称的影像学医师分别独立阅片,测量盆腔淋巴结及腹主动脉旁淋巴结最短直径,若2位医师诊断结果一致,或商讨一致后,共同签发报告。盆、腹腔淋巴结转移的CT诊断标准:①清楚可见盆腔淋巴结或者腹主动脉旁淋巴结,并且其最短直径≥10 mm; ②可见淋巴结中心性坏死;③可见淋巴结发生融合或成簇聚集。符合上述3项中任意一项,则可被诊断为有淋巴结转移。
规范手术治疗(肿瘤切除术+盆腔淋巴结清扫术)中,对本组患者淋巴结进行全面探查,记录其位置、大小、有无融合等情况。其盆腔淋巴结清扫术范围,包括双侧髂总、髂外、髂内、股深及闭孔淋巴结,部分患者还同时行腹主动脉旁淋巴结清扫术或腹主动脉旁淋巴结取样术。术后对清除的所有淋巴结进行病理学诊断。
以淋巴结转移的组织病理学检查结果作为"金标准",与CT结果进行比较,评价CT诊断的准确性。CT辅助诊断淋巴结转移结果包括4种。①真阳性:CT结果呈阳性,术后组织病理学检查结果显示≥1个淋巴结发生转移;②假阳性:CT结果呈阳性,术后病理学检查未发现淋巴结转移;③真阴性:CT结果呈阴性,术后病理学检查未发现淋巴结转移;④假阴性:CT结果呈阴性,术后病理学检查发现≥1个淋巴结发生转移。CT检查诊断妇科恶性肿瘤患者淋巴结转移准确性的评价指标包括敏感度、特异度、阳性预测值、阴性预测值及准确度。
本研究数据资料采用SPSS 25.0统计学软件包进行统计学处理。对CT诊断妇科恶性肿瘤患者盆、腹腔淋巴结转移的敏感度、特异度、阳性预测值、阴性预测值及准确度等计数资料,采用百分比(%)表示。
本组275例妇科恶性肿瘤患者年龄为(49.4±9.6)岁。其中,宫颈癌患者为169例(61.5%),其国际妇产科联盟(Federation International of Gynecology and Obstetrics,FIGO)临床分期为ⅠA2~ⅡA期;子宫内膜癌为67例(24.4%),卵巢癌为29例(10.5%),输卵管癌为7例(2.5%),子宫癌肉瘤为2例(0.7%),子宫内膜癌与卵巢癌双原发癌为1例(0.4%)。
术前全腹CT检查对于诊断275例妇科恶性肿瘤患者盆、腹腔淋巴结转移的敏感度为31.0%,特异度为96.6%,阳性预测值为61.9%,阴性预测值为88.6%,准确度为86.5%。275例妇科恶性肿瘤患者CT与组织病理学检查对于诊断淋巴结转移的结果,见表1。
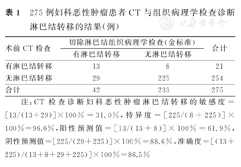
275例妇科恶性肿瘤患者CT与组织病理学检查诊断淋巴结转移的结果(例)
275例妇科恶性肿瘤患者CT与组织病理学检查诊断淋巴结转移的结果(例)
| 术前CT检查 | 切除淋巴结组织病理学检查(金标准) | 合计 | |
|---|---|---|---|
| 有淋巴结转移 | 无淋巴结转移 | ||
| 有淋巴结转移 | 13 | 8 | 21 |
| 无淋巴结转移 | 29 | 225 | 254 |
| 合计 | 42 | 233 | 275 |
注:CT检查诊断妇科恶性肿瘤淋巴结转移的敏感度=[13/(13+29)]×100%=31.0%,特异度=[225/(8+225)]×100%=96.6%,阳性预测值=[13/(13+8)]×100%=61.9%,阴性预测值=[225/(29+225)]×100%=88.6%,准确度=[(13+225)/(13+8+29+225)]×100%=86.5%
术中对本组275例患者淋巴结处理结果显示,清扫淋巴结最少者为7枚,最多者为74枚,共计7 963枚,平均清扫淋巴结为30.1枚/例患者。其中,86例(31.3%,86/275)患者术中探查发现盆腔淋巴结肿大、变硬,直径为0.8~4.0 cm,其中仅21例经术后组织病理学检查被确诊为淋巴结转移。术后切除淋巴结的组织病理学检查结果显示,42例患者(15.3%,42/275)的175枚淋巴结发生转移,包括宫颈癌患者25例,子宫内膜癌患者4例,卵巢癌患者9例,输卵管癌患者3例及子宫癌肉瘤患者1例。
淋巴系统是全身免疫系统的重要组成部分,对于妇科恶性肿瘤患者,盆、腹腔淋巴结有无转移,对其预后影响重大,并且影响术后治疗方案的制定。但是,实施淋巴结清扫术不仅增加手术相关风险,还可增加术后近、远期并发症,严重影响患者生活质量。因此,术前采取无创方法,对妇科恶性肿瘤患者有无盆、腹腔淋巴结转移进行评估,尤为重要。
20世纪80年代以来,CT检查成为评估盆、腹腔淋巴结有无转移的主要方法[5]。文献报道,国内外对实体肿瘤淋巴结转移的评估标准,主要采取淋巴结最短直径测量法,对直径<10 mm淋巴结,视为正常淋巴结,对最短直径≥10 mm者,则诊断为淋巴结转移呈阳性[6,7]。
对于宫颈癌,淋巴结转移具有渐进性、阶梯式转移的规律,遵循距离病灶由近及远转移模式,很少跳跃性转移[8]。淋巴结切除术对于宫颈癌的治疗意义,目前认识较为一致。根据2019年美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)关于宫颈癌淋巴结清扫建议,对于临床分期≥ⅠB1者,应行腹主动脉旁淋巴结切除术,并且常规应至肠系膜下动脉水平,根据临床或者影像学表现,必要时行更高位淋巴结切除术[9]。因此,若术前腹部CT检查显示某一部位淋巴结肿大或者融合,则有助于主刀医师在手术过程中进行更仔细探查,必要时行肿大淋巴结切除术进行组织病理学检查,有助于对肿瘤进行全面分期及制定术后治疗方案;若术前CT检查结合术中探查均未发现肿大的淋巴结,可不考虑进行更高位的淋巴结切除术。
对于子宫内膜癌,淋巴结转移为其主要转移途径。既往研究认为,对子宫内膜癌患者均需要进行系统的淋巴结清扫术,但是几项多中心、随机对照研究结果显示,虽然盆腔淋巴结清扫术,对于明确肿瘤临床分期及制定术后治疗方案有重大参考价值,但对于早期子宫内膜癌患者,进行常规淋巴结清扫术与未行淋巴结清扫术患者的5年无病生存率、总生存率及复发率比较,差异均无统计学意义(P>0.05)[10,11]。《2019 NCCN子宫肿瘤临床实践指南》指出,对子宫内膜癌患者是否采取淋巴结清扫术,应结合相关危险因素进行综合考虑,部分患者并不适合行淋巴结清扫术,但对于盆、腹腔内肿大的淋巴结,应进行切除,以判断是否存在淋巴结转移[12]。术中,可根据术前腹部CT检查结果结合术中探查情况,切除可疑淋巴结进行活检。
对于早期卵巢癌,建议采取系统的盆腔及腹主动脉旁淋巴结清扫术,明确临床分期,避免对低危型患者过度化疗[13,14]。对于晚期卵巢癌患者的治疗原则为,尽可能切除肿瘤转移病灶。《2019 NCCN子宫肿瘤临床实践指南》提出,对于FIGO临床分期≥ⅢC期者,可以仅行肿大淋巴结切除术[14]。因此术前全腹CT可对肿大淋巴结定位,有助于术中对其探查。
国外文献报道,术前CT诊断妇科肿瘤发生淋巴结转移的敏感度为25%~70%,特异度为78%~97%[15,16,17,18]。本研究结果显示,术前全腹CT检查对于诊断妇科恶性肿瘤患者盆、腹腔淋巴结转移的敏感度为31.0%,特异度为96.6%。CT检查的空间及时间分辨率较高,对肿大淋巴结定位、定性均具有一定价值。但是,本研究结果显示,术前CT诊断妇科恶性肿瘤淋巴结转移的敏感度相对较低,分析原因可能如下:①CT判断淋巴结有无转移,主要通过对淋巴结直径测量,但对于淋巴结内部结构分辨率低,因此对炎症、结核等导致的淋巴结肿大,不能辨别。②CT设备质量、性能,患者进行CT检查时肠蠕动状态等,均可影响成像。③影像学医师的诊断水平,也影响结果判读。
综上所述,术前CT诊断妇科恶性肿瘤患者淋巴结转移的敏感度较低,特异度较高,对肿大淋巴结定位、定性可以提供一定参考价值。该辅助诊断结果,有助于肿瘤的临床分期、手术及术后治疗方案的制定。
所有作者均声明不存在利益冲突






























