
探讨正常孕妇妊娠期血清同型半胱氨酸(Hcy)浓度与MTHFR基因C677T位点多态性及红细胞叶酸(RBCF)水平的相关性。
选择2018年1月至2019年4月,在眉山市妇幼保健院进行常规产前检查的483例早孕期正常孕妇为研究对象。根据其MTHFR基因C677T位点的CC、CT与TT基因型,将其分为CC组、CT组与TT组。采用荧光定量PCR法,检测受试者MTHFR基因C677T位点多态性;采用循环酶法、电化学发光法,分别检测受试者早、中、晚孕期血清Hcy浓度与RBCF水平。对3组受试者早、中、晚孕期的血清Hcy浓度与RBCF水平进行比较,采用单因素方差分析,而二者的相关性分析,采用直线回归分析。3组受试者年龄、孕龄、孕次、产次等一般临床资料比较,差异均无统计学意义(P>0.05)。本研究遵循的程序符合《世界医学协会赫尔辛基宣言》要求,与所有受试者签署临床研究知情同意书。
①这483例受试者的MTHFR基因C677T位点的CC、CT、TT基因型,分别为159例、237例、87例,分别纳入CC组、CT组与TT组;其基因型表达频率分别为32.9%、49.1%与18.0%;C、T等位基因频率分别为57.5%与42.5%。②483例受试者早、中、晚孕期血清Hcy浓度分别为(5.2±2.4)、(3.8±2.0)、(4.8±2.5) μmol/L,RBCF水平分别为(965±190)、(1 157±189)、(1 179±225) ng/mL,早、中、晚孕期血清Hcy浓度、RBCF水平分别比较,差异均有统计学意义(F=44.542、163.830,P<0.001)。CC组、CT组、TT组受试者早孕期血清Hcy浓度及早、中、晚孕期RBCF水平分别比较,差异均有统计学意义(F=8.925、9.181、19.757、21.877,P<0.001)。③直线回归分析结果显示,483例受试者早、中、晚孕期血清Hcy浓度与其RBCF水平呈线性负相关关系,建立的直线回归方程为y=-0.003x+7.986(R2=0.082,F=129.669,P<0.001),其中,x为RBCF水平(ng/mL),y为血清Hcy浓度(μmol/L)。
正常孕妇妊娠期血清Hcy浓度与MTHFR基因C677T位点多态性及RBCF水平相关。对育龄女性进行MTHFR基因C677T位点多态性筛查、血清Hcy浓度和RBCF水平监测,对围孕期保健具有重要指导意义。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅。光盘如有质量问题,请向编辑部调换。
红细胞叶酸(red blood cell folate,RBCF)检测主要用于巨幼细胞性贫血的诊断。同型半胱氨酸(homocysteine,Hcy)是一种具有细胞毒性的含硫氨基酸,是甲硫氨酸代谢的中间产物。围孕期Hcy浓度升高,可导致胎儿神经管畸形、先天性心脏病、唐氏综合征、唇腭裂等出生缺陷,流产、早产、胎儿宫内生长受限、低出生体重等不良妊娠结局,以及妊娠期高血压疾病、妊娠期糖尿病等疾病[1]。亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)是叶酸代谢过程中的关键酶,可催化5,10-亚甲基四氢叶酸生成5-甲基四氢叶酸,是Hcy转化为甲硫氨酸的必要条件[2]。MTHFR基因C677T位点多态性,是叶酸代谢的重要基因多态性位点,该位点的不同基因型可决定MTHFR活性,从而影响体内叶酸代谢和血清Hcy浓度[3]。胎盘血管疾病患者血清Hcy浓度升高,RBCF水平降低,叶酸代谢相关基因MTHFR基因C677T位点纯合突变率增高[4]。这提示,MTHFR基因中第677位核苷酸发生C-T突变,可能是导致胎盘血管疾病的危险因素。高Hcy血症伴血栓高危因素,可导致神经管缺陷发病风险增加2~6倍[5]。本研究对正常孕妇不同妊娠期血清Hcy浓度与MTHFR基因C677T位点多态性及RBCF水平的相关性进行分析,旨在探讨血清Hcy浓度影响因素,为临床监测和管理孕妇血清Hcy浓度提供参考。现将研究结果报道如下。
选择2018年1月至2019年4月,在眉山市妇幼保健院进行常规产前检查的483例早孕期正常孕妇为研究对象。根据受试者MTHFR基因C677T位点的CC、CT与TT基因型,将其分为CC组(n=159)、CT组(n=237)与TT组(n=87)。3组受试者年龄、孕龄、孕次、产次等一般临床资料比较,差异均无统计学意义(P>0.05)。本研究遵循的程序符合《世界医学协会赫尔辛基宣言》要求,与所有受试者签署临床研究知情同意书。
本研究纳入标准:无不良孕产史和妊娠合并症者;同意采集口腔黏膜细胞进行基因检测,于早、中、晚孕期抽取肘静脉血进行血清Hcy浓度和RBCF水平检测者;临床病例资料完整者。排除标准:有胃、肠道切除术史者;合并严重消化系统疾病及肝、肾功能不全者;罹患冠心病、糖尿病、甲状腺疾病、恶性肿瘤、血液系统或免疫系统疾病者;不配合参加本研究者。
于早孕期(0~13+6孕周)、中孕期(14~27+6孕周)及晚孕期(≥28孕周),采集每例受试者的空腹肘静脉血3 mL,置于含二氧化硅(SiO2)促凝剂的采血管(江苏康健医疗用品有限公司)内备用。于室温下,采用TD-5G型离心机(四川蜀科仪器有限公司),对血样离心4 min(4 000 r/min,离心半径为16.5 cm)后,留取上层血清,置于-20 ℃冰箱保存。采用循环酶法,使用AU680型贝克曼全自动生化仪[贝克曼库尔特商贸(中国)有限公司],以及血清Hcy检测试剂盒(批号:17-1222、18-0206、18-0517、18-0927、18-1113、18-0731、18-1218、18-1218,北京九强生物技术股份有限公司),检测受试者血清Hcy浓度。于早孕期(0~13+6孕周)、中孕期(14~27+6孕周)及晚孕期(≥28孕周),采集每例受试者的空腹肘静脉血2 mL,置于含乙二胺四乙酸二钾抗凝剂的采血管(江苏康健医疗用品有限公司)内,并保存于-20 ℃冰箱。取100 μL血样,充分混匀后,与3 mL RBCF检测试剂盒(批号:24051701、24051703、33299601、39019001、33299604,德国罗氏诊断有限公司)轻轻混匀,避免产生气泡,于20~25 ℃条件下放置(90±15) min,并于2 h内采用cobas e411电化学发光全自动免疫分析仪(德国罗氏诊断有限公司),检测受试者RBCF水平。所有检测步骤均严格按照上述2种试剂盒的说明书进行操作。
采集每例受试者口腔黏膜脱落细胞,使用硅胶吸附方法,提取其基因组DNA,使用ABI 7900型荧光定量PCR仪(美国Applied Biosystems公司)及MTHFR基因多态性检测试剂盒(批号:862905632、863087710、863254497,美国Applied Biosystem公司),检测该基因组DNA的MTHFR基因C677T位点多态性。Taqman-MGB探针为GAAAAGCTGCGTGATGATGAAATCG[G/A]CTCCCGCAGACACCTTCTCCTTCAA。PCR反应体系总体积为10.0 μL,包含上述基因组DNA含量为20 ng/L的DNA模板1.0 μL,20×Taqman-MGB探针0.5 μL,2×Taqman Universal MasterMix 5.0 μL,去离子水3.5 μL。PCR反应条件为95 ℃预变性10 min;92 ℃变性15 s,60 ℃退火1 min,共计20个循环;89 ℃变性15 s,60 ℃退火90 s,共计30个循环。PCR反应结束后,在ABI 7900型荧光定量PCR仪上,读取每个样品孔终点荧光,利用Sequence Detection Software软件确定MTHFR基因分型结果。
采用SPSS 19.0统计学软件,对本研究数据进行统计学分析。采用Ssize软件,确定满足本研究统计检验的最小样本量。对于呈正态分布的计量资料,如受试者早、中、晚孕期血清Hcy浓度与RBCF水平等,采用 ±s表示,3组比较,采用单因素方差分析。受试者早、中、晚孕期血清Hcy浓度与其RBCF水平的相关性分析,采用直线回归分析。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
±s表示,3组比较,采用单因素方差分析。受试者早、中、晚孕期血清Hcy浓度与其RBCF水平的相关性分析,采用直线回归分析。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
本研究483例孕妇的MTHFR基因C677T位点多态性分布,经Hardy-Weinberg遗传平衡检验结果显示,符合Hardy-Weinberg遗传平衡定律(χ2=0.007,P=0.936)。这483例孕妇的MTHFR基因C677T的CC、CT、TT基因型,分别为159例、237例、87例,分别纳入CC组、CT组与TT组;CC、CT、TT基因型频率分别为32.9%、49.1%与18.0%;C、T等位基因频率分别为57.5%与42.5%。
本研究483例受试者中,早、中、晚孕期血清Hcy浓度分别为(5.2±2.4)、(3.8±2.0)、(4.8±2.5) μmol/L,RBCF水平分别为(965±190)、(1 157±189)、(1 179±225) ng/mL,早、中、晚孕期血清Hcy浓度、RBCF水平分别比较,差异均有统计学意义(F=44.542、163.830,P<0.001)。
3组受试者早孕期血清Hcy浓度及早、中、晚孕期RBCF水平分别比较,差异均有统计学意义(P<0.05);3组受试者中、晚孕期血清Hcy浓度分别比较,差异均无统计学意义(P>0.05)。CC组受试者早、中、晚孕期血清Hcy浓度、RBCF水平分别比较,差异均有统计学意义(P<0.05);CT组、TT组的这2个指标早、中、晚孕期分别比较,差异亦均有统计学意义(P<0.05)。3组受试者早、中、晚孕期血清Hcy浓度与RBCF水平比较,见表1。
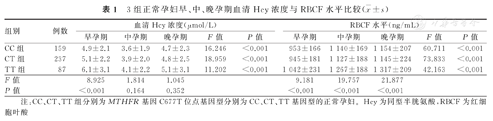
3组正常孕妇早、中、晚孕期血清Hcy浓度与RBCF水平比较( ±s)
±s)
3组正常孕妇早、中、晚孕期血清Hcy浓度与RBCF水平比较( ±s)
±s)
| 组别 | 例数 | 血清Hcy浓度(μmol/L) | RBCF水平(ng/mL) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 早孕期 | 中孕期 | 晚孕期 | F值 | P值 | 早孕期 | 中孕期 | 晚孕期 | F值 | P值 | ||
| CC组 | 159 | 4.9±2.1 | 3.6±1.9 | 4.7±2.3 | 16.246 | <0.001 | 953±166 | 1 140±169 | 1 154±207 | 60.711 | <0.001 |
| CT组 | 237 | 5.1±2.2 | 3.9±2.0 | 4.8±2.5 | 18.959 | <0.001 | 945±181 | 1 127±188 | 1 145±224 | 73.833 | <0.001 |
| TT组 | 87 | 6.1±3.1 | 4.1±2.2 | 5.1±3.1 | 11.202 | <0.001 | 1 042±231 | 1 267±188 | 1 317±209 | 42.163 | <0.001 |
| F值 | 8.925 | 1.814 | 1.045 | 9.181 | 19.757 | 21.877 | |||||
| P值 | <0.001 | 0.164 | 0.352 | <0.001 | <0.001 | <0.001 | |||||
注:CC、CT、TT组分别为MTHFR基因C677T位点基因型分别为CC、CT、TT基因型的正常孕妇。Hcy为同型半胱氨酸,RBCF为红细胞叶酸
采用直线回归分析方法,对483例受试者早、中、晚孕期血清Hcy浓度与RBCF水平进行相关性分析的结果显示,二者呈线性负相关关系,建立的直线回归方程为y =-0.003x +7.986(R2=0.082,F=129.669,P<0.001),其中x为RBCF水平(ng/mL),y为血清Hcy浓度(μmol/L)。本研究483例受试者早、中、晚孕期血清Hcy浓度与RBCF水平直线回归关系散点图,见图1。
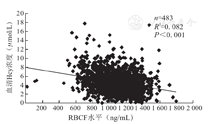

注:Hcy为同型半胱氨酸,RBCF为红细胞叶酸
Hcy是甲硫氨酸代谢的中间产物,又被称为"邪恶氨基酸"。体内蓄积Hcy,可降低机体甲基化水平,损伤血管内皮细胞,是导致心血管、神经系统疾病的危险因素[6,7,8]。孕妇血清Hcy浓度与母婴健康密切相关[9],可为孕前保健和优生优育提供参考,并可作为孕妇RBCF水平评价指标,以及妊娠相关疾病与胎儿出生缺陷预测指标[10,11,12]。血清Hcy浓度受年龄、性别、遗传、饮食、药物、疾病状态等多种因素影响。妊娠期是特殊生理阶段,孕妇Hcy浓度对血管损伤的敏感性明显增加。本研究结果显示,483例受试者早、中、晚孕期血清Hcy浓度分别为(5.2±2.4)、(3.8±2.0)、(4.8±2.5) μmol/L,3者比较,差异有统计学意义(P<0.05);CC组受试者早、中、晚孕期血清Hcy浓度比较,差异均有统计学意义(P<0.05);CT组、TT组早、中、晚孕期血清Hcy浓度分别比较,差异亦均有统计学意义(P<0.05)。孕妇血清Hcy浓度,早孕期至中孕期呈逐渐下降趋势,而中孕期至晚孕期则呈逐渐升高趋势。Murphy等[13]认为,早孕期至中孕期血清Hcy浓度降低,可能与循环血容量增加、血液稀释及雌激素水平升高有关;另外,胎儿对必需氨基酸的需求增加,使Hcy过度甲基化,也可导致血清Hcy浓度降低[14]。骆婵珍等[15]体外实验研究结果显示,Hcy可增强子宫肌层自发性收缩,因此推测,孕妇晚孕期血清Hcy浓度逐渐升高,可能与促进分娩时子宫收缩有关。
MTHFR基因编码的MTHFR是叶酸代谢过程中的关键酶。一项对墨西哥风湿性关节炎患者的研究结果显示,MTHFR基因C677T位点TT基因型受试者血清Hcy浓度,较CC基因型者高11%~26%[2]。本研究483例正常孕妇中,MTHFR基因C677T位点TT基因型频率为18.0%,T等位基因频率为42.5%,均低于山东淄博市的43.6%与65.6%[16]、河北廊坊市的37.8%与60.9%[17]、辽宁沈阳市的31.3%与56.6%[18],高于广西南宁市的7.7%与21.9%[19]、广东佛山市的5.6%与21.5%[20];CC、CT、TT组受试者血清早孕期血清Hcy浓度及早、中、晚孕期RBCF水平分别比较,差异均有统计学意义(P<0.05),TT组受试者早孕期血清Hcy浓度高于CC组。
叶酸作为MTHFR底物,在机体Hcy代谢中具有重要意义,高水平叶酸具有对抗转甲基循环障碍作用。人体血清或RBCF水平,可作为叶酸营养状态评价指标。RBCF水平代表体内循环状态的叶酸水平,但是易受到膳食等因素影响。RBCF水平与红细胞更新过程有关,可反映人体内叶酸长期变化状态和叶酸储备情况,故本研究检测的是RBCF水平,分析其与血清Hcy浓度的相关性。对本研究受试者早、中、晚孕期血清Hcy浓度与RBCF水平的直线回归分析结果显示,二者呈线性负相关关系y=-0.003x+7.986(R2=0.082,F=129.669,P<0.001),其中x为RBCF水平(ng/mL),y为血清Hcy浓度(μmol/L)。这表明,在其他因素不变情况下,RBCF水平可解释正常孕妇血清Hcy浓度个体差异的8.2%。
综上所述,正常孕妇不同妊娠期血清Hcy浓度与MTHFR基因C677T位点多态性、RBCF水平相关。对育龄女性进行MTHFR基因C677T位点多态性筛查、血清Hcy浓度和RBCF水平监测,并合理补充叶酸,避免不良妊娠结局的发生,具有重要临床意义。
所有作者均声明不存在利益冲突






























