
探讨门诊就诊女性尿路感染(UTI)患者尿液病原菌谱分布及药物敏感性,为该类患者抗菌药物的选择和治疗提供依据。
选择1998年1月至2018年12月,于中山大学附属第一医院门诊就诊并确诊为UTI的643例女性患者为研究对象,年龄为14~95岁。根据是否绝经,将其分为绝经组(n=362)与非绝经组(n=281)。本研究遵循的程序经中山大学附属第一医院伦理委员会批准(审批文号:伦审〔2021〕372号)。
①自纳入研究的643例UTI患者的尿液标本中,分离获得643株病原菌中,革兰阴性(G-)杆菌为567株(88.2%),革兰阳性(G+)球菌为76株(11.8%);G-杆菌主要为大肠埃希菌(70.3%,452/643),其次为肺炎克雷伯菌(6.2%,40/643);G+球菌主要为粪肠球菌(2.6%,17/643)、无乳链球菌(1.9%,12/643)和屎肠球菌(1.7%,11/643)。②药物敏感性试验:大肠埃希菌和肺炎克雷伯菌对头孢哌酮舒巴坦、阿米卡星、哌拉西林/他唑巴坦、亚胺培南等药物维持较高敏感度;大肠埃希菌对呋喃妥因同样具有较高的敏感度,而对环丙沙星、头孢曲松及磺胺甲 唑/甲氧苄啶高度耐药。肺炎克雷伯菌对头孢曲松、呋喃妥因高度耐药。③42.0%(190/452)大肠埃希菌与40.0%(16/40)肺炎克雷伯菌,为产超广谱β内酰胺酶(ESBLs)菌株。④2组患者的主要病原菌均为大肠埃希菌(68.0%,72.1%),肺炎克雷伯菌(6.4%,6.1%)。2组患者的主要病原菌分布所占比例比较,差异无统计学意义(P>0.05)。⑤绝经组UTI患者大肠埃希菌对环丙沙星耐药率为69.7%(166/238),明显高于非绝经组的54.0%(95/176),并且差异具有统计学意义(P<0.05)。⑥绝经组UTI患者肺炎克雷伯菌对头孢曲松、头孢吡肟的耐药率分别为66.7%(14/21)和45.0%(9/20),明显高于非绝经组的33.3%(6/18)和5.6%(1/18),并且差异亦有统计学意义(P<0.05)。
唑/甲氧苄啶高度耐药。肺炎克雷伯菌对头孢曲松、呋喃妥因高度耐药。③42.0%(190/452)大肠埃希菌与40.0%(16/40)肺炎克雷伯菌,为产超广谱β内酰胺酶(ESBLs)菌株。④2组患者的主要病原菌均为大肠埃希菌(68.0%,72.1%),肺炎克雷伯菌(6.4%,6.1%)。2组患者的主要病原菌分布所占比例比较,差异无统计学意义(P>0.05)。⑤绝经组UTI患者大肠埃希菌对环丙沙星耐药率为69.7%(166/238),明显高于非绝经组的54.0%(95/176),并且差异具有统计学意义(P<0.05)。⑥绝经组UTI患者肺炎克雷伯菌对头孢曲松、头孢吡肟的耐药率分别为66.7%(14/21)和45.0%(9/20),明显高于非绝经组的33.3%(6/18)和5.6%(1/18),并且差异亦有统计学意义(P<0.05)。
门诊就诊UTI女性患者最常见的病原菌为大肠埃希菌。绝经期UTI患者对氟喹诺酮类药物的耐药率高。大肠埃希菌对呋喃妥因持续高度敏感,可推荐作为门诊UTI女性患者治疗的经验性治疗用药。

未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计,除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。本刊为电子期刊,以网刊形式出版。
尿路感染(urinary tract infection,UTI)是主要的社区获得性感染性疾病之一,世界范围内UTI的年发病人次超过1.5×108例次[1]。女性因其尿路解剖特点是发生社区获得性尿路感染(community acquired urinary tract infection,CAUTI)的主要人群,约50%女性一生中至少经历1次UTI,并且20%~30% UTI患者可发展为复发性尿路感染(recurrent urinary tract infection,RUTI)[2]。性行为活跃的年轻女性及绝经后女性,更易发生UTI[3,4],严重影响其生活质量,重症UTI可导致脓毒症、脓肿、慢性肾盂肾炎及慢性肾衰竭等[5]。由于近年抗菌药物的广泛及不规范使用,UTI耐药菌株出现给临床用药带来极大挑战。明确UTI患者的病原菌分布及耐药现状,对指导临床用药具有重要作用。本研究通过回顾性分析1998—2018年于中山大学附属第一医院门诊就诊UTI女性患者尿液病原菌分布及耐药情况,旨在为门诊CAUTI患者临床药物治疗提供参考依据。现将研究结果报道如下。
选择1998年1月至2018年12月,于中山大学附属第一医院门诊就诊,并确诊为UTI的643例女性患者为研究对象,年龄为14~95岁。根据是否绝经,将其分为绝经组(n=362)与非绝经组(n=281),年龄分别为(65.4±10.0)岁、(35.3±8.6)岁。本研究遵循程序经中山大学附属第一医院伦理委员会批准(审批文号:伦审〔2021〕372号)。
本研究纳入标准:①中段清洁尿液病原菌培养呈阳性且为1种细菌,细菌菌落计数≥105 cfu/mL的UTI者。②同1例患者重复培养出相同菌株,按照1次培养病原菌呈阳性纳入分析。排除标准:尿液培养呈阳性病原微生物为真菌、淋球菌及其他性病相关病原菌者。
清洁中段尿液标本细菌培养,若单个菌种且细菌菌落计数≥105 cfu/mL,则判断为尿培养病原菌培养呈阳性[8]。
采用VITEK2全自动细菌鉴定系统(法国梅里埃公司)进行病原菌鉴定。采用药物敏感性分析系统(法国梅里埃公司)或纸片扩散法(药敏纸片购自英国OXOID公司),进行病原菌药物敏感性试验,折点判读参考美国临床和实验室标准协会(clinical laboratory standard institute,CLSI)标准[9]。
采用双纸片协同试验法或标准肉汤稀释法测定最低抑菌浓度(minimum inhibitory concentration,MIC)法,进行产超广谱β-内酰胺酶(extended-spectrum β-lactamase,ESBLs)细菌判定。将经37 ℃环境培养18~24 h的待测菌,制成约为1.5×108 cfu/mL菌液,无菌棉签涂于M-H药敏试验琼脂平板(60°旋转3次),将含头孢噻肟/克拉维酸、头孢他啶/克拉维酸、头孢他啶、头孢噻肟载玻片各1片,相距≥24 mm贴在M-H琼脂平板上,24 h测量抑菌圈直径。若头孢他啶、头孢他啶/克拉维酸载玻片抑菌圈直径≥5 mm,或头孢噻肟、头孢噻肟/克拉维酸载玻片抑菌圈直径≥5 mm,则判定为产ESBLs细菌;或在2组待测菌中加入任何一种上述抗菌药物后MIC,与再加入克拉维酸后MIC比较,MIC降低≤3个倍比稀释浓度,则判定为产ESBLs细菌[9]。
对铜绿假单胞菌、大肠埃希菌和金黄色葡萄球菌药物敏感性试验质量控制的标准品,如铜绿假单胞菌(ATCC27853)、大肠埃希菌(ATCC25922)和金黄色葡萄球菌(ATCC25923),均由国家卫生健康委员会临床检验中心提供。
本研究所得数据采用SPSS 25.0统计学软件进行统计学分析。计数资料以百分比(%)表示,各组间比较采用χ2检验或Fisher确切概率法。所有统计均采用双侧检验,以P<0.05表示差异有统计学意义。
对符合本研究纳入、排除标准的643例UTI患者尿液标本培养、分离病原菌株中,革兰阴性(Gram negative,G-)杆菌为567株(88.2%),革兰阳性(Gram positive,G+)球菌为76株(11.8%)。567株G-杆菌中,大肠埃希菌最常见(70.3%,452/643),其次为肺炎克雷伯菌(6.2%,40/643)、奇异变形杆菌(4.4%,28/643)和铜绿假单胞菌(2.3%,15/643)。76株G+球菌中,主要为粪肠球菌(2.6%,17/643)、无乳链球菌(1.9%,12/643)和屎肠球菌(1.7%,11/643)。643例UTI患者尿液培养、分离643株病原菌分布,见表1。
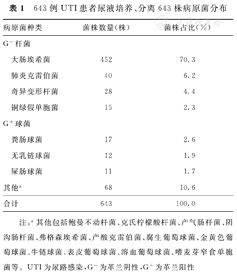
643例UTI患者尿液培养、分离643株病原菌分布
643例UTI患者尿液培养、分离643株病原菌分布
| 病原菌种类 | 菌株数量(株) | 菌株占比(%) | |
|---|---|---|---|
| G-杆菌 | |||
| 大肠埃希菌 | 452 | 70.3 | |
| 肺炎克雷伯菌 | 40 | 6.2 | |
| 奇异变形杆菌 | 28 | 4.4 | |
| 铜绿假单胞菌 | 15 | 2.3 | |
| G+球菌 | |||
| 粪肠球菌 | 17 | 2.6 | |
| 无乳链球菌 | 12 | 1.9 | |
| 屎肠球菌 | 11 | 1.7 | |
| 其他a | 68 | 10.6 | |
| 合计 | 643 | 100.0 | |
注:a其他包括鲍曼不动杆菌、克氏柠檬酸杆菌、产气肠杆菌、阴沟肠杆菌、弗格森埃希菌、产酸克雷伯菌、腐生葡萄球菌、金黄色葡萄球菌、牛链球菌、表皮葡萄球菌、溶血葡萄球菌、嗜麦芽窄食单胞菌等。UTI为尿路感染,G-为革兰阴性,G+为革兰阳性
452株大肠埃希菌对头孢哌酮/舒巴坦(18.1%)、阿米卡星(3.5%)、呋喃妥因(13.7%)、哌拉西林/他唑巴坦(2.7%)、亚胺培南(0.2%)的耐药率较低,而对环丙沙星、头孢曲松、磺胺甲 唑/甲氧苄啶的耐药率较高(均>45%),见表2。452株大肠埃希菌中,产ESBLs细菌为190株(42.0%,190/452)。
唑/甲氧苄啶的耐药率较高(均>45%),见表2。452株大肠埃希菌中,产ESBLs细菌为190株(42.0%,190/452)。
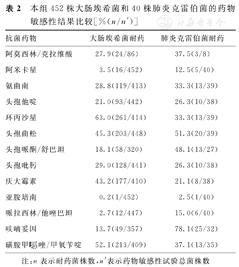
本组452株大肠埃希菌和40株肺炎克雷伯菌的药物敏感性结果比较[%(n/n′)]
本组452株大肠埃希菌和40株肺炎克雷伯菌的药物敏感性结果比较[%(n/n′)]
| 抗菌药物 | 大肠埃希菌耐药 | 肺炎克雷伯菌耐药 |
|---|---|---|
| 阿莫西林/克拉维酸 | 27.9(24/86) | 37.5(3/8) |
| 阿米卡星 | 3.5(16/452) | 12.5(5/40) |
| 氨曲南 | 28.8(119/413) | 33.3(13/39) |
| 头孢他啶 | 21.0(93/442) | 26.3(10/38) |
| 环丙沙星 | 63.0(261/414) | 33.3(13/39) |
| 头孢曲松 | 45.3(203/448) | 51.3(20/39) |
| 头孢哌酮/舒巴坦 | 18.1(58/320) | 48.1(13/27) |
| 头孢吡肟 | 29.0(128/441) | 26.3(10/38) |
| 庆大霉素 | 43.2(177/410) | 21.1(8/38) |
| 亚胺培南 | 0.2(1/452) | 2.5(1/40) |
| 哌拉西林/他唑巴坦 | 2.7(12/447) | 15.0(6/40) |
| 呋喃妥因 | 13.7(49/357) | 78.1(25/32) |
磺胺甲 唑/甲氧苄啶 唑/甲氧苄啶 | 52.1(213/409) | 37.1(13/35) |
注:n表示耐药菌株数,n′表示药物敏感性试验总菌株数
40株肺炎克雷伯菌对阿米卡星(12.5%)、哌拉西林/他唑巴坦(15.0%)、亚胺培南(2.5%)等抗菌药物的耐药率较低;而对头孢曲松、呋喃妥因的耐药率均>50%(表2)。40株肺炎克雷伯菌中产ESBLs细菌为16株(40.0%,16/40)。
绝经组和非绝经组UTI患者尿液的主要病原菌,均为大肠埃希菌(72.1%,68.0%),肺炎克雷伯菌(6.1%,6.4%)。2组患者尿液培养、分离的主要病原菌占比比较,差异无统计学意义(P>0.05)。2组UTI患者尿液培养、分离的主要病原菌占比比较,见表3。
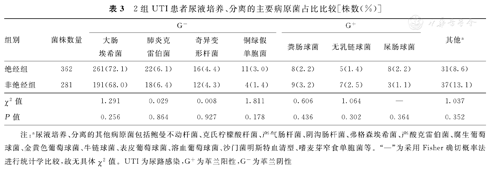
2组UTI患者尿液培养、分离的主要病原菌占比比较[株数(%)]
2组UTI患者尿液培养、分离的主要病原菌占比比较[株数(%)]
| 组别 | 菌株数量 | G- | G+ | 其他a | |||||
|---|---|---|---|---|---|---|---|---|---|
| 大肠埃希菌 | 肺炎克雷伯菌 | 奇异变形杆菌 | 铜绿假单胞菌 | 粪肠球菌 | 无乳链球菌 | 屎肠球菌 | |||
| 绝经组 | 362 | 261(72.1) | 22(6.1) | 16(4.4) | 11(3.0) | 8(2.2) | 5(1.4) | 8(2.2) | 31(8.6) |
| 非绝经组 | 281 | 191(68.0) | 18(6.4) | 12(4.3) | 4(1.4) | 9(3.2) | 7(2.5) | 3(1.1) | 37(13.1) |
| χ2值 | 1.291 | 0.029 | 0.008 | 1.811 | 0.606 | 1.064 | — | 1.037 | |
| P值 | 0.256 | 0.864 | 0.927 | 0.178 | 0.436 | 0.302 | 0.364 | 0.352 | |
注:a尿液培养、分离的其他病原菌包括鲍曼不动杆菌、克氏柠檬酸杆菌、产气肠杆菌、阴沟肠杆菌、弗格森埃希菌、产酸克雷伯菌、腐生葡萄球菌、金黄色葡萄球菌、牛链球菌、表皮葡萄球菌、溶血葡萄球菌、沙门菌明斯特血清型、嗜麦芽窄食单胞菌等。"—"为采用Fisher确切概率法进行统计学比较,故无具体χ2值。UTI为尿路感染,G+为革兰阳性,G-为革兰阴性
绝经组UTI患者尿液培养、分离的主要病原菌中,产ESBLs+细菌占比为32.6%(118/362),非绝经组为32.4% (91/281),2组比较,差异无统计学意义(χ2=0.003,P=0.955)。绝经组患者尿液培养、分离的大肠埃希菌及肺炎克雷伯菌中产ESBLs细菌占比分别为40.6%(106/261)、45.5%(10/22),非绝经组分别为44.0%(84/191),33.3%(6/18),组间分别比较,差异亦无统计学意义(χ2=0.513、0.606,P=0.474、0.436)。
绝经组UTI患者尿液培养、分离的大肠埃希菌对环丙沙星耐药率为69.7%(166/238),明显高于非绝经组的54.0%(95/176),并且差异具有统计学意义(P<0.05)。2组UTI患者尿液培养、分离的大肠埃希菌对其他抗菌药物的耐药率比较,差异均无统计学意义(P>0.05)。2组UTI患者尿液培养、分离的大肠埃希菌对不同抗菌药物耐药率比较,见表4。
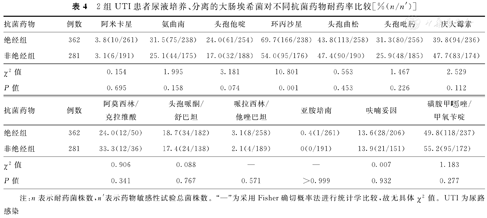
2组UTI患者尿液培养、分离的大肠埃希菌对不同抗菌药物耐药率比较[%(n/n′)]
2组UTI患者尿液培养、分离的大肠埃希菌对不同抗菌药物耐药率比较[%(n/n′)]
| 抗菌药物 | 例数 | 阿米卡星 | 氨曲南 | 头孢他啶 | 环丙沙星 | 头孢曲松 | 头孢吡肟 | 庆大霉素 |
|---|---|---|---|---|---|---|---|---|
| 绝经组 | 362 | 3.8(10/261) | 31.5(75/238) | 24.0(61/254) | 69.7(166/238) | 43.8(113/258) | 31.3(80/256) | 39.8(94/236) |
| 非绝经组 | 281 | 3.1(6/191) | 25.1(44/175) | 17.0(32/188) | 54.0(95/176) | 47.4(90/190) | 25.9(48/185) | 47.7(83/174) |
| χ2值 | 0.154 | 1.995 | 3.181 | 10.801 | 0.563 | 1.467 | 2.529 | |
| P值 | 0.695 | 0.158 | 0.074 | 0.001 | 0.453 | 0.226 | 0.112 |
| 抗菌药物 | 例数 | 阿莫西林/克拉维酸 | 头孢哌酮/舒巴坦 | 哌拉西林/他唑巴坦 | 亚胺培南 | 呋喃妥因 | 磺胺甲 唑/甲氧苄啶 唑/甲氧苄啶 |
|---|---|---|---|---|---|---|---|
| 绝经组 | 362 | 24.0(12/50) | 18.7(34/182) | 3.1(8/258) | 0.4(1/261) | 13.6(28/206) | 49.8(118/237) |
| 非绝经组 | 281 | 33.3(12/36) | 17.4(24/138) | 2.1(4/189) | 0(0/191) | 13.9(21/151) | 55.2(95/172) |
| χ2值 | 0.906 | 0.088 | — | — | 0.007 | 1.183 | |
| P值 | 0.341 | 0.767 | 0.571 | >0.999 | 0.932 | 0.277 |
注:n表示耐药菌株数,n′表示药物敏感性试验总菌株数。"—"为采用Fisher确切概率法进行统计学比较,故无具体χ2值。UTI为尿路感染
绝经组UTI患者尿液培养、分离的肺炎克雷伯菌对头孢曲松、头孢吡肟的耐药率分别为66.7%(14/21)和45.0%(9/20),明显高于非绝经组的33.3%(6/18)和5.6%(1/18),2组比较,差异有统计学意义(P<0.05)。但是,2组UTI患者尿液培养、分离的克雷伯菌,对其他抗菌药物的耐药率比较,差异无统计学意义(P>0.05)。2组UTI患者尿液培养、分离的肺炎克雷伯菌耐药率比较,见表5。
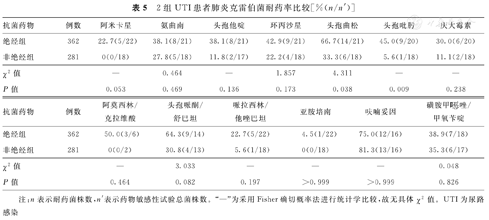
2组UTI患者肺炎克雷伯菌耐药率比较[%(n/n′)]
2组UTI患者肺炎克雷伯菌耐药率比较[%(n/n′)]
| 抗菌药物 | 例数 | 阿米卡星 | 氨曲南 | 头孢他啶 | 环丙沙星 | 头孢曲松 | 头孢吡肟 | 庆大霉素 |
|---|---|---|---|---|---|---|---|---|
| 绝经组 | 362 | 22.7(5/22) | 38.1(8/21) | 38.1(8/21) | 42.9(9/21) | 66.7(14/21) | 45.0(9/20) | 30.0(6/20) |
| 非绝经组 | 281 | 0(0/18) | 27.8(5/18) | 11.8(2/17) | 22.2(4/18) | 33.3(6/18) | 5.6(1/18) | 11.1(2/18) |
| χ2值 | — | 0.464 | — | 1.857 | 4.311 | — | — | |
| P值 | 0.053 | 0.469 | 0.136 | 0.173 | 0.038 | 0.009 | 0.238 |
| 抗菌药物 | 例数 | 阿莫西林/克拉维酸 | 头孢哌酮/舒巴坦 | 哌拉西林/他唑巴坦 | 亚胺培南 | 呋喃妥因 | 磺胺甲 唑/甲氧苄啶 唑/甲氧苄啶 |
|---|---|---|---|---|---|---|---|
| 绝经组 | 362 | 50.0(3/6) | 64.3(9/14) | 22.7(5/22) | 4.5(1/22) | 75.0(12/16) | 38.9(7/18) |
| 非绝经组 | 281 | 0(0/2) | 30.8(4/13) | 5.6(1/18) | 0(0/18) | 81.3(13/16) | 35.3(6/17) |
| χ2值 | — | 3.033 | — | — | — | 0.048 | |
| P值 | 0.464 | 0.082 | 0.197 | >0.999 | >0.999 | 0.826 |
注:n表示耐药菌株数,n′表示药物敏感性试验总菌株数。"—"为采用Fisher确切概率法进行统计学比较,故无具体χ2值。UTI为尿路感染
对于门诊UTI女性患者尿液培养、分离病原菌谱及药物敏感性试验结果提示,主要病原菌为大肠埃希菌和肺炎克雷伯菌。大肠埃希菌,对阿米卡星、呋喃妥因、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、亚胺培南等有较高敏感度,而对环丙沙星、磺胺甲 唑/甲氧苄啶耐药率较高(52.1%~63.0%);肺炎克雷伯菌对亚胺培南、阿米卡星、哌拉西林/他唑巴坦敏感度较高,对头孢曲松、头孢哌酮/舒巴坦和呋喃妥因耐药率较高。产ESBLs菌株在大肠埃希菌和肺炎克雷伯菌中的占比,分别为42.0%(190/452)与40.0%(16/40),这与文献报道结果相似[10,11]。
唑/甲氧苄啶耐药率较高(52.1%~63.0%);肺炎克雷伯菌对亚胺培南、阿米卡星、哌拉西林/他唑巴坦敏感度较高,对头孢曲松、头孢哌酮/舒巴坦和呋喃妥因耐药率较高。产ESBLs菌株在大肠埃希菌和肺炎克雷伯菌中的占比,分别为42.0%(190/452)与40.0%(16/40),这与文献报道结果相似[10,11]。
李霞等[12]研究结果提示,与非绝经期女性相比,绝经期女性体内雌激素水平下降,阴道和泌尿道中乳酸杆菌属、鞘氨醇单胞菌属菌群数量显著降低,而肠杆菌科菌群丰度增加,这使绝经期女性泌尿道对大肠埃希菌抑制功能降低,更易导致UTI。雌激素水平对门诊就诊UTI绝经患者尿液病原菌谱影响,文献报道较少[13],本研究对绝经与非绝经UTI患者尿液培养、分离主要致病菌,均为大肠埃希菌,2组患者UTI致病菌谱及产ESBLs菌株占比比较,差异无统计学意义(P>0.05),提示虽然绝经后女性体内雌激素水平和泌尿道菌群变化,但对UTI致病菌谱无明显影响,由于本研究为回顾性分析研究,样本量较小,仍有待进一步验证。
本研究对绝经与非绝经UTI患者尿液标本检出的大肠埃希菌和肺炎克雷伯菌药物敏感性试验结果提示,绝经UTI患者中分离获得的大肠埃希菌对环丙沙星耐药率,显著高于未绝经UTI患者(P<0.05),分离获得的肺炎克雷伯菌对三、四代头孢菌素(头孢曲松、头孢吡肟)耐药率,亦显著高于未绝经UTI患者(P<0.05),推测这与绝经UTI患者年龄大、相关免疫力低下[14],更容易发生UTI有关。绝经UTI患者年龄较大,合并基础疾病多,在各种药物治疗过程中,细菌在膀胱上皮细胞内形成细胞内菌落,抵制抗菌药物治疗,发生RUTI,从而更容易产生耐药之故[15]。
UTI病原菌对常用的抗菌药物耐药性逐渐增高,耐药菌呈现由院内感染逐渐向门诊就诊UTI及CAUTI患者扩散趋势[16]。本研究结果显示,门诊UTI女性患者中,大肠埃希菌对环丙沙星耐药率达63.0%(261/414),在绝经后女性中高达69.7%(166/238),与其他地区比较处于较高水平[17]。本研究中分离获得的肺炎克雷伯菌对环丙沙星的耐药率也高达33.3%(13/39)。鉴于上述研究结果,对于门诊UTI女性患者,环丙沙星并不适合作为门诊经验性治疗的一线用药;但氟喹诺酮类药物口服利用度好,且在尿液中药物浓度较高,抗菌谱广,仍可在药物敏感试验结果指导下作为UTI治疗的推荐药物。
美国传染病协会(Infectious Diseases Society of America, IDSA)推荐在磺胺甲 唑/甲氧苄啶耐药率小于20%的地区,磺胺甲
唑/甲氧苄啶耐药率小于20%的地区,磺胺甲 唑/甲氧苄啶可作为急性非复杂性UTI治疗的一线用药[18]。但近年我国多个地区的细菌耐药性监测显示,大肠埃希菌对磺胺甲
唑/甲氧苄啶可作为急性非复杂性UTI治疗的一线用药[18]。但近年我国多个地区的细菌耐药性监测显示,大肠埃希菌对磺胺甲 唑/甲氧苄啶耐药率超过50%[19],肺炎克雷伯菌对磺胺甲
唑/甲氧苄啶耐药率超过50%[19],肺炎克雷伯菌对磺胺甲 唑/甲氧苄啶耐药率也高达42.7%~49.5%[20]。
唑/甲氧苄啶耐药率也高达42.7%~49.5%[20]。
本研究中,大肠埃希菌对呋喃妥因的敏感度高达86.3%,且在绝经和非绝经患者中皆维持极高敏感度,考虑女性UTI主要病原菌为大肠埃希菌,且呋喃妥因抗菌活性较好,价格低廉,口服制剂方便,建议可作为治疗非复杂性UTI的一线经验用药(足月孕妇、肾功能减退及对呋喃妥因存在变态反应患者禁用)[21]。大肠埃希菌对哌拉西林/他唑巴坦、亚胺培南、阿米卡星的敏感性高达95%以上,但由于仅能通过静脉用药,故适用于复杂性、重症UTI与RUTI治疗。
本研究存在一定局限性,由于研究时间跨度较大,研究数据均来自门诊就诊UTI及CAUTI患者,缺少对患者相关的基础疾病、合并症、人口学数据与治疗及随访数据对细菌耐药性产生影响。
所有作者均声明不存在利益冲突



























