
人子宫内膜基质细胞蜕膜化(hESCD),是人类胚胎植入和维持妊娠的关键环节。hESCD主要是指排卵后,子宫内膜在孕酮与孕酮受体(PGR)作用下,发生一系列生物学、形态学改变及细胞外基质重建。但是,对于孕酮-PGR信号通路在hESCD过程中的具体分子作用机制,迄今尚未阐明。笔者拟就PGR结构及其亚型,hESCD过程中孕酮-PGR信号通路的生理作用、网络调控,以及PGR水平及其功能异常与hESCD异常疾病关系4个方面的最新研究进展进行阐述。

未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计,除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。本刊为电子期刊,以网刊形式出版。
育龄女性排卵后,在孕激素作用下,子宫内膜将发生一系列生物学、形态学改变及细胞外基质重建,促进滋养细胞侵入,这一过程被称为人子宫内膜基质细胞蜕膜化(human endometrial stroma cell decidualization,hESCD)[1]。hESCD涉及子宫内膜腺上皮分泌增加、螺旋动脉重铸、血管渗透性增加、局部免疫细胞募集及细胞外基质成分改变,为胚胎发育提供保护屏障和营养,决定妊娠结局[1]。排卵后,hESCD过程的主要作用机制为卵巢分泌孕激素增加,孕酮结合孕酮受体(progesterone receptor,PGR),通过调控信号转导分子及细胞因子、免疫细胞分泌的活性分子等,共同参与hESCD调节过程[2]。上述分子相互影响,共同调控hESCD过程,实现对hESCD精确网络调控模式。hESCD是胚胎植入和维持妊娠的关键环节[2]。文献报道,导致个体复发性流产的最主要因素是孕酮反应性,而非体内孕酮含量,孕酮反应性主要由PGR表达水平及其功能决定[3]。但是,PGR在hESCD过程中的具体分子作用机制,迄今尚未阐明[2]。笔者拟就PGR结构及其亚型,hESCD过程中孕酮-PGR信号通路的生理作用、网络调控,以及PGR水平及其功能异常与hESCD异常疾病关系4个方面的最新研究进展进行阐述。
人类PGR位于11号染色体(11q22-q23)上,PGR表达由2个启动子控制,编码2种蛋白质PGR-B、-A[4]。PGR-B由远侧启动子区控制,从第1个起始密码子开始翻译,全长为116 kD;PGR-A由近侧启动子区控制,从第2个起始密码子开始翻译,全长为94 kD[4]。PGR属于甾体激素核受体超家族成员,其结构与典型的核受体基本一致,核受体均为多域蛋白质,含5个结构域,分别为活化功能结构域(activation function domain,AF)1、3,抑制功能结构域(inhibition function domain,IF),AF1,DNA结合域(DNA-binding domain,DBD),配体结合域(ligand-binding domain,LBD)/AF2,见图1[4]。PGR-A、-B具有共同结构和功能元件,即相同的调控区、DBD和LBD[4]。由于PGR-B在氨基酸末端较PGR-A多164个氨基酸,因此其除了包含AF1、2外,还包含AF3转录激活功能区[4]。AF3可有效结合一系列辅助激活因子,协同激活基因转录;在PGR-A中,仅包含AF1、2,而无AF3功能[5]。由此可见,PGR-A、-B在hESCD过程中,发挥的功能各异。
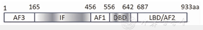

注:PGR为孕酮受体。AF为活化功能结构域,IF为抑制功能结构域,DBD为DNA结合域,LBD为配体结合域
人体调控子宫内膜PGR表达水平的机制复杂,迄今尚未阐明[6]。PGR和雌激素受体(estrogen receptor,ESR)1在人增殖期子宫内膜上皮细胞和人子宫内膜基质细胞(human endometrial stroma cell,hESC)中的表达水平均明显增高,而ESR1和PGR在人分泌中、晚期子宫内膜上皮细胞中均不表达,在hESC中的表达水平,则均下降[7]。雌激素-ESR1信号通路活化,对于PGR表达水平增高是必不可少的[8],ESR1可调控子宫内膜PGR-A、-B表达水平,还可诱导多数靶细胞PGR mRNA及其蛋白产物表达水平增高[5]。然而,PGR通过旁分泌诱导的17β羟类固醇脱氢酶(17β-hydroxysteroid dehydrogenase,17β-HSD)2,在分泌期子宫内膜上皮细胞中,可将雌二醇转化为无活性雌酮[9]。因此,添加外源性孕酮,可抑制分泌期子宫内膜上皮细胞的雌激素依赖性增高[9]。
子宫内膜PGR-B、-A表达水平,随着妊娠期激素水平改变而呈动态变化[7]。PGR-B表达水平在hESC和人增殖期子宫内膜上皮细胞中,均达到峰值,排卵后均逐渐下降[7]。PGR-A在整个月经周期和妊娠期的hESC中呈高表达,而在排卵后的子宫内膜上皮细胞中表达水平下降[10]。PGR-A的内在转录活性非常有限,并且主要作为PGR-B抑制剂而发挥作用[11]。PGR-A、-B协同调控细胞中具有不同反应性的孕酮-PGR信号通路的基因网络[12]。对特异性敲除PGR亚型的小鼠病理模型的研究表明,单独敲除PGR-A亚型的小鼠表型与敲除所有PGR一致[13]。由此可见,PGR-A是小鼠妊娠建立和维持所需的PGR亚型,而不是PGR-B或PGR其他亚型[13]。但是,PGR-B亚型对孕期小鼠的乳腺发育至关重要[14]。PGR-A、-B这2种PGR亚型对人类妊娠成功均发挥着重要作用,这2种亚型共同表达于分化的hESC中,PGR-B亚型直接调控PGR-A表达,抑制hESC增殖和促进hESC分化,在hESCD中起着主要作用[15]。
在正常生理情况下,hESCD是排卵后,子宫内膜在孕酮作用下发生一系列生物学、形态学改变及细胞外基质重建,这说明hESCD过程依赖于孕酮[2]。PGR为孕酮的唯一受体[2]。未与孕酮配体结合的PGR,被组装在包含热休克蛋白(heat shock protein,HSP)90、40、70、P23与免疫亲和素家族FK506结合蛋白(FK506 binding protein,FKBP)4、5复合物中,这些复合物也被称为PGR伴侣蛋白质(FKBP52),可维持PGR构象,调控PGR与孕酮结合,使PGR在细胞核和细胞质动态穿梭中发挥信号通路作用[5]。PGR与孕酮配体结合,可触发PGR构象变化,导致FKBP52解离二聚化,PGR进入细胞核后,可直接或间接与靶基因启动子结合[5]。因为核受体缺乏内在酶活性,其诱导或转录抑制作用,依赖于组蛋白修饰共调节因子招募[16]。使用基因敲除(敲除PGR和敲除PGR伴侣分子)的小鼠病理模型研究,不仅为hESCD过程中PGR的重要性提供明确证据,也为研究PGR-依赖FKBP52的这一生理过程,如FKBP4[17]、核受体共调节因子、类固醇受体共激活因子-2这些基因敲除小鼠病理模型,可为FKBP52重要性提供明确证据[18]。由此可见,孕酮-PGR信号通路任何环节出现异常,均可能影响小鼠妊娠结局。
PGR是一类核转录因子,与孕酮结合后,可转录激活靶基因启动子区的特异DNA反应原件,启动不同信号通路,从而介导孕酮在妊娠过程中的效应[2]。小鼠子宫上皮的PGR-IHH(India Hedgehog)信号通路,可以通过核受体亚家族2组F成员2(nuclear receptor subfamily 2 group F member 2,NR2F2)联合表皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路,促进小鼠子宫内膜基质细胞蜕膜化(endometrial stroma cell decidualization,ESCD)[19]。在小鼠子宫内膜基质细胞(endometrial stroma cell,ESC)和hESC中,均提示NR2F2可促进Wnt4表达,进而促进小鼠ESCD[2]。Wnt4受到PGR和叉头转录因子O1(Fox transcription factor O1,FOXO1)正性调节,同时也是骨形态发生蛋白(bone morphogenetic protein,BMP)2下游信号通路,NR2F2可通过调节PGR和BMP2表达,改变孕酮和EGFR信号通路后,PGR与EGFR信号汇聚于Wnt4,从而促进小鼠ESCD,构成以PGR为核心的ESCD调控网络[2]。在人子宫内膜中,PGR不仅与上述重要信号通路相互作用,促进hESCD发生,而且hESCD过程中,重要转录因子FOXO1、C/EBPβ、STAT3和HOXO10均与PGR相互作用,作为PGR转录共激活分子诱导hESCD分子标志物IGFBP1和PRL表达[1]。在体内排卵后,孕酮合并多种激素,如促黄体生成素、促肾上腺皮质激素释放激素、前列腺素E2及松弛素-2等,与细胞膜G蛋白耦联受体结合后,可促使hESC内cAMP水平增高,cAMP激活蛋白激酶A,从而释放各种转录因子,在转录水平调节基因表达,促进hESCD发生[20]。若胚胎植入成功,在持续孕酮刺激和人绒毛膜促性腺激素作用下,hESCD程度进一步加深,形成典型蜕膜细胞(decidual cells)[6]。子宫敲除PGR基因的小鼠,可表现为胚胎黏附、植入失败和ESCD[1]。由此可见,PGR是小鼠ESCD的关键核心分子,但是对孕酮-PGR信号通路在hESCD过程中的具体分子作用机制,迄今尚未完全阐明。
在子宫内膜异位症(endometriosis,EMS)患者的在位内膜与异位病灶中,hESCD均严重受损[21]。对EMS患者和非EMS受试者的子宫内膜经体外分离出的hESC进行培养发现,EMS患者在位内膜体外分离出的hESC进行培养后,对于孕酮反应性,较非EMS受试者正常子宫内膜经体外分离出的hESC进行培养后,对于孕酮反应性减弱[22];而对非EMS受试者正常子宫内膜经体外分离出的hESC经孕酮刺激6 h、2 d和14 d后,分别诱导8、62和172个基因表达;而来自EMS患者在位内膜经体外分离出的hESC通过上述相同处理后,仅可诱导0、3和4个基因表达[22],这种作用被称为孕激素抵抗作用,这可能与EMS发病机制有关。目前已知EMS患者hESCD异常和孕激素抵抗的原因,主要包括雌激素过激活、PGR或FKBP52表达缺陷,PGR转录活性下降等[17],PGR缺陷涉及PGR转录水平、转录后修饰、翻译后修饰和FKBP52稳定性等异常[3]。然而,目前对子宫内膜中,导致PGR表达缺陷的具体原因尚了解甚少[2]。
孙慧清等[23]研究发现,在育龄女性中,由子宫内膜PGR减少所致复发性自然流产占总复发性自然流产人数的40%,在复发性自然流产患者"种植窗"期,子宫内膜及蜕膜组织中PGR表达水平明显低于对照组(输卵管阻塞所致不孕患者)。Liu等[24]研究发现,FKBP4(FKBP52)表达异常,可导致hESC对添加外源性孕酮产生抵抗。Xin等[25]研究发现,胚胎反复种植失败患者的分泌中期子宫内膜中,PGR表达水平与正常育龄女性一致,然而PGR直接结合的靶分子FOSL2、转化生长因子-β、胰岛素受体底物水平,则均较正常育龄女性显著下降,这主要是由于在胚胎反复种植失败患者分泌中期子宫内膜中,B淋巴瘤Mo-MLV插入区1同源物(B lymphoma Mo-MLV insertion region 1 homolog)表达水平下降不影响PGR表达,但是可影响PGR靶分子表达的缘故。由此可见,孕酮-PGR信号通路中,不论PGR、FKBP52,还是PGR靶分子任何环节出现异常,均可影响母儿妊娠结局。
PGR在hESCD过程中发挥重要作用,与孕酮结合后,不仅可调节靶基因转录,还可启动不同信号通路,从而介导孕酮在妊娠过程中的效应[2]。PGR水平及其功能,受相关转录水平调控,以及蛋白质翻译后修饰等多种因素调节[2]。PGR蛋白质发生翻译后修饰,可影响PGR对孕酮的反应性、与DNA结合能力、蛋白结构稳定性,以及细胞中定位、二聚化及蛋白质间相互作用等[5]。PGR发生磷酸化修饰后一般被激活,其对转录作用增强,但是也可能引发其他翻译后修饰作用,如PGR发生磷酸化后,引发自身发生泛素化修饰,使PGR活性降低或者蛋白质稳定性降低,从而影响PGR的功能[26,27]。综上所述,孕酮-PGR信号通路任何环节发生异常,均可影响PGR功能,从而影响hESCD的发生。
所有作者均声明不存在利益冲突



























