
探讨稳定补充叶酸后,孕妇血清叶酸水平及其影响因素。
选择2019年8月至2020年12月,于复旦大学妇产科医院进行产前检查,并且在正常饮食情况下稳定补充叶酸(400 μg/d×60 d)后的718例孕龄为12~24孕周孕妇为研究对象。根据补充叶酸后的血清叶酸水平,将其分为4组:A组(n=23,血清叶酸水平<7 ng/mL),B组(n=170,血清叶酸水平为≥7~14 ng/mL),C组(n=217,血清叶酸水平为≥14~18 ng/mL),D组(n=308,血清叶酸水平为≥18~20 ng/mL)。采用χ2检验及秩和检验,对4组孕妇一般临床资料及血清维生素B12水平、同型半胱氨酸(Hcy)浓度进行统计学比较(单因素分析)。对孕妇稳定补充叶酸后上述4个血清叶酸水平的影响因素,采用无序多分类logistic回归法进行分析。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》。获取所有受试者的知情同意,并与其签署临床研究知情同意书。
①单因素分析结集显示:4组孕妇血清Hcy浓度、维生素B12水平,孕龄≥12~19孕周与≥19~25孕周构成比比较,差异均有统计学意义(均为P<0.001)。②相对于血清叶酸水平为<7 ng/mL:孕妇血清Hcy浓度每增加1 μmol/L,血清叶酸水平为≥7~14 ng/mL、≥14~18 ng/mL、≥18~20 ng/mL的可能性分别降低到原来的0.731倍(OR=0.731)、0.353倍(OR=0.353)、0.471倍(OR=0.471);孕妇血清维生素B12水平每增加1 pg/mL,血清叶酸水平为≥14~18 ng/mL的可能性增加到原来的1.004倍(OR=1.004)。③相对于血清叶酸水平为≥7~14 ng/mL:孕妇血清Hcy浓度每增加1 μmol/L,血清叶酸水平为<7 ng/mL、≥14~18 ng/mL、≥18~20 ng/mL的可能性分别为增加到原来的1.369倍(OR=1.369)、降低到原来的0.483倍(OR=0.483)、降低到原来的0.644倍(OR=0.644);孕妇血清维生素B12水平每增加1 pg/mL,血清叶酸水平为≥14~18 ng/mL、≥18~20 ng/mL的可能性分别增加到原来的1.003倍(OR=1.003)、1.003倍(OR=1.003);孕龄≥12~19孕周孕妇血清叶酸水平为≥18~20 ng/mL的可能性是孕龄≥19~25孕周孕妇的2.244倍(OR=2.244)。④相对于血清叶酸水平为≥14~18 ng/mL:孕妇血清Hcy浓度每增加1 μmol/L,血清叶酸水平为<7 ng/mL、≥7~14 ng/mL、≥18~20 ng/mL的可能性均分别增加到原来的2.832倍(OR=2.832)、2.069倍(OR=2.069)、孕妇1.333倍(OR=1.333);孕妇血清维生素B12水平每增加1 pg/mL,血清叶酸水平为<7 ng/mL、≥7~14 ng/mL的可能性均降低到原来的0.996倍(OR=0.996)、0.997倍(OR=0.997)。
血清Hcy浓度及维生素B12水平,以及孕龄,均对孕妇稳定补充叶酸后的血清叶酸水平有影响:血清Hcy浓度主要为负向影响,血清维生素B12水平主要为正向影响,孕龄仅对血清叶酸水平较高级别有影响。

未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计,除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。本刊为电子期刊,以网刊形式出版。
叶酸在机体一碳单位代谢中发挥着重要作用,孕妇叶酸缺乏或代谢障碍与多种出生缺陷发生有关。孕妇叶酸缺乏是导致胎儿神经管缺陷和先天性心脏病的危险因素[1]。孕妇叶酸水平低可能导致先兆子痫、自发性流产、胎死宫内,以及分娩先天性心脏病、早产、低体重及严重神经系统先天性疾病(神经管畸形)儿等[2]。文献报道,孕妇的叶酸需求量较非孕期女性明显增加,在正常饮食情况下补充叶酸(相关指南推荐口服剂量为400 μg/d×60 d),可降低胎儿神经管畸形风险[3,4,5]。围孕期补充叶酸,可使胎儿神经管缺陷发生率降低50%~70%[6,7],胎儿先天性心脏病发生率降低40%~60%[8,9]。孕期坚持补充叶酸,能防控与低叶酸水平相关的妊娠并发症[10]。叶酸缺乏导致血清同型半胱氨酸(homocysteine,Hcy)浓度升高,而高Hcy是导致出生缺陷发生的独立危险因素,过高血清Hcy浓度,可增加孕妇早产、分娩小于胎龄儿的风险[11]。1998年,美国食品和药物管理局强制规定谷物食品必须添加适量叶酸,以此保证孕妇即使在不知道孕期需补充叶酸的情况下,也不会导致胎儿神经管发育缺陷和关闭不全[12]。世界卫生组织《孕龄妇女预防新生儿神经管畸形血清叶酸和红细胞叶酸水平指导意见》[13]推荐孕妇叶酸补充建议量为400 μg/d,预防新生儿神经管畸形的孕妇血清叶酸水平应≥7 ng/mL。孕妇血清叶酸、维生素B12及Hcy水平,对评估孕期并发症有重要意义[14]。本研究分析正常饮食情况下,口服叶酸400 μg/d,时间超过60 d孕妇的血清叶酸水平及其影响因素,旨在探讨各因素对孕妇叶酸补充效果的影响程度。现将研究结果报道如下。
选择2019年8月至2020年12月,于复旦大学妇产科医院进行产前检查的718例孕妇为研究对象,其入组时年龄为(32.0±4.2)岁、孕龄为(16.2±2.4)孕周。根据补充叶酸60 d后,孕龄12~24孕周时的血清叶酸水平,将其分为4组:A组(n=23,血清叶酸水平<7 ng/mL),B组(n=170,血清叶酸水平为≥7~14 ng/mL),C组(n=217,血清叶酸水平为≥14~18 ng/mL),D组(n=308,血清叶酸水平为≥18~20 ng/mL)。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》。所有受试者均知情同意,并签署临床研究知情同意书。
本研究纳入标准:①补充叶酸60 d后,孕龄为12~24孕周,并在复旦大学妇产科医院建档,定时进行产前检查者;②完整登记家庭成员信息资料,内容主要包括:个人基本信息、个人既往病史、生育史、家庭遗传病史、孕期用药情况、孕期有毒物质和放射性物质接触情况等者;③入组时年龄为20~45岁者。排除标准:①有心、肝、脑、肾等主要脏器疾病者;②有生殖道炎症史、子宫异常或月经不规律者;③孕龄不明确者。
对本组孕妇自本院建卡开始,在正常饮食情况下,持续口服叶酸(商品名:联环叶酸片,批号为20190120~20200605,江苏联环药业股份有限公司)400 μg/d×60 d。
对纳入研究所有孕妇进行以下指标检测。①血清叶酸、维生素B12、Hcy水平测定:孕妇完成"稳定补充叶酸措施"后,禁食>8 h(避免饮食干扰)后采集其空腹肘静脉血2 mL至真空采血管,置于室温下40 min内血液凝固,在4 ℃、3 500 r/min(离心半径16 cm)离心5 min获得血清样本,于2 h内检测。血清叶酸及维生素B12水平检测,均采用化学发光微粒子免疫检测法,均使用I2000化学发光仪(雅培爱尔兰诊断公司),分别采用叶酸测定试剂盒[批号为05206UI00、07198UI00、09236UI00等,雅培贸易(上海)有限公司],维生素B12测定试剂盒[批号为12345UI00、14038UI00、15284UI00等,雅培贸易(上海)有限公司]。血清Hcy浓度测定采用酶循环法,Hcy测定试剂盒(批号为02HCY200209、02HCY191012、02HCY200624等,上海惠中生物科技有限公司)及7600全自动生化分析仪[日立诊断产品(上海)有限公司]。②血清学产前筛查:采用3联血清筛查法,筛查孕妇血清甲胎蛋白、β-人绒毛膜促性腺激素及雌二醇水平。根据孕妇甲胎蛋白和β-人绒毛膜促性腺激素浓度,并结合孕妇孕龄、体重、既往病史、年龄等,用产科筛查分析软件(上海鹏程医学科技信息有限公司)评估筛查风险值。本研究将筛查风险值>1/380的孕妇,判定为血清学产前筛查21-三体阳性;对于筛查风险值>1/334的孕妇,判定为18-三体阳性。③超声检查:孕妇于孕龄12~15孕周时,进行胎儿颈项透明层(nuchal translucency,NT)厚度超声检查。超声检查仪器采用GE Voluson E10彩色超声诊断仪(美国GE公司),将探头频率设置为2~5 MHz。超声检查操作步骤按照相关操作标准严格执行,超声评估胎儿胎龄后,对胎儿自然姿态下的头部和上胸影像放大,在胎儿颈部皮肤找到NT,选择NT最宽处测定NT厚度,重复3次取平均值为最终测定结果。本研究设定胎儿NT值≥2.5 mm,判定为胎儿NT增厚。
本研究数据采用SPSS 23.0统计学软件包进行统计学处理。对于年龄构成比、孕龄构成比,双胎/多胎、胎儿NT增厚及不良孕产史≥2次占比,以及21-三体、18-三体筛查阳性率等计数资料,采用百分比(%)表示,4组比较采用χ2检验。对于各组孕妇血清维生素B12、Hcy水平等呈非正态分布的定量资料,采用M(Q1,Q3)表示,4组比较采用秩和检验。孕妇血清叶酸水平为本研究多因素分析因变量,分为4个水平,属于有序分类变量,但不满足比例优势假设(平行线检验结果示P=0.001),因此对影响孕妇稳定补充叶酸后不同血清叶酸水平的多因素分析采用无序多分类logistic回归。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
本研究718例孕妇血清叶酸、维生素B12及Hcy水平分别为(15.9±3.9) ng/mL、(467.0±186.9) pg/mL及(6.3±2.0) μmol/L。其中,血清叶酸水平<3.0 ng/mL、≥3.0~4.0 ng/mL、≥4.0~5.5 ng/mL、≥5.5~7.0 ng/mL、≥7.0~14.0 ng/mL、≥14.0~18.0 ng/mL、≥18.0~20.0 ng/mL者占比,分别为0.14%、0.14%、0.56%、2.36%、23.68%、30.22%、42.90%。
4组孕妇年龄构成比、双胎/多胎比例、胎儿NT增厚比例、21-三体筛查阳性率、18-三体筛查阳性率及不良孕产史≥2次比例比较,差异均无统计学意义(均为P>0.05)。4组孕妇孕龄构成比、血清维生素B12水平及血清Hcy浓度比较,差异均有统计学意义(均为P<0.001)。4组孕妇一般临床资料及血清维生素B12、Hcy水平比较,见表1。
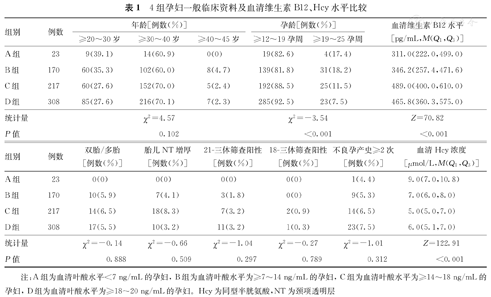
4组孕妇一般临床资料及血清维生素B12、Hcy水平比较
4组孕妇一般临床资料及血清维生素B12、Hcy水平比较
| 组别 | 例数 | 年龄[例数(%)] | 孕龄[例数(%)] | 血清维生素B12水平[pg/mL,M(Q1,Q3)] | |||
|---|---|---|---|---|---|---|---|
| ≥20~30岁 | ≥30~40岁 | ≥40~45岁 | ≥12~19孕周 | ≥19~25孕周 | |||
| A组 | 23 | 9(39.1) | 14(60.9) | 0(0) | 19(82.6) | 4(17.4) | 311.0(222.0,499.0) |
| B组 | 170 | 60(35.3) | 102(60.0) | 8(4.7) | 139(81.8) | 31(18.2) | 346.2(257.4,471.6) |
| C组 | 217 | 60(27.6) | 152(70.0) | 5(2.4) | 192(88.5) | 25(11.5) | 489.0(400.0,610.0) |
| D组 | 308 | 85(27.6) | 216(70.1) | 7(2.3) | 285(92.5) | 23(7.5) | 465.8(360.3,575.0) |
| 统计量 | χ2=4.57 | χ2=-3.54 | Z=70.82 | ||||
| P值 | 0.102 | <0.001 | <0.001 | ||||
| 组别 | 例数 | 双胎/多胎[例数(%)] | 胎儿NT增厚[例数(%)] | 21-三体筛查阳性[例数(%)] | 18-三体筛查阳性[例数(%)] | 不良孕产史≥2次[例数(%)] | 血清Hcy浓度[μmol/L,M(Q1,Q3)] |
|---|---|---|---|---|---|---|---|
| A组 | 23 | 0(0) | 0(0) | 0(0) | 0(0) | 1(4.4) | 9.0(7.0,10.8) |
| B组 | 170 | 10(5.9) | 7(4.1) | 3(1.8) | 0(0) | 9(5.3) | 7.0(6.0,8.0) |
| C组 | 217 | 14(6.5) | 18(8.3) | 7(3.2) | 2(0.9) | 14(6.5) | 5.0(5.0,7.0) |
| D组 | 308 | 17(5.5) | 10(3.2) | 11(3.2) | 1(0.3) | 23(7.5) | 6.0(5.1,7.0) |
| 统计量 | χ2=-0.14 | χ2=-0.66 | χ2=-1.04 | χ2=-0.27 | χ2=-1.01 | Z=122.91 | |
| P值 | 0.888 | 0.509 | 0.297 | 0.789 | 0.312 | <0.001 |
注:A组为血清叶酸水平<7 ng/mL的孕妇,B组为血清叶酸水平为≥7~14 ng/mL的孕妇,C组为血清叶酸水平为≥14~18 ng/mL的孕妇,D组为血清叶酸水平为≥18~20 ng/mL的孕妇。Hcy为同型半胱氨酸,NT为颈项透明层
上述单因素分析筛选出对孕妇稳定补充叶酸后血清叶酸水平的3个可疑影响因素,分别是血清维生素B12水平、血清Hcy浓度及孕龄。影响孕妇稳定补充叶酸后血清叶酸水平的无序多分类logistic回归分析结果如下。
①相对于血清叶酸水平为<7 ng/mL(表2):血清Hcy浓度对其他3个血清叶酸水平的影响均有统计学意义(P<0.05),其中血清Hcy浓度每增加1 μmol/L,血清叶酸水平为≥7~14 ng/mL、≥14~18 ng/mL、≥18~20 ng/mL的可能性分别减少到原来的0.731倍(OR=0.731)、0.353倍(OR=0.353)、0.471倍(OR=0.471);血清维生素B12水平对血清叶酸水平为≥14~18 ng/mL的影响有统计学意义(P<0.05),其中血清维生素B12水平每增加1 pg/mL,血清叶酸水平为≥14~18 ng/mL的可能性增加到原来的1.004倍(OR=1.004)。
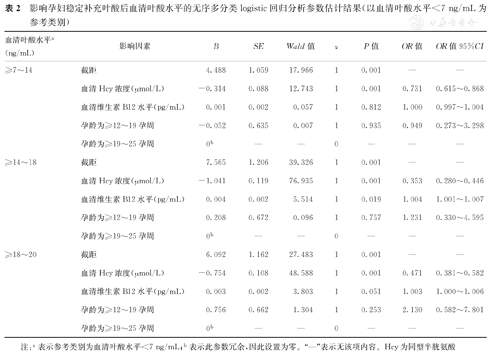
影响孕妇稳定补充叶酸后血清叶酸水平的无序多分类logistic回归分析参数估计结果(以血清叶酸水平<7 ng/mL为参考类别)
影响孕妇稳定补充叶酸后血清叶酸水平的无序多分类logistic回归分析参数估计结果(以血清叶酸水平<7 ng/mL为参考类别)
| 血清叶酸水平a(ng/mL) | 影响因素 | B | SE | Wald值 | ν | P值 | OR值 | OR值95%CI |
|---|---|---|---|---|---|---|---|---|
| ≥7~14 | 截距 | 4.488 | 1.059 | 17.966 | 1 | 0.001 | — | — |
| 血清Hcy浓度(μmol/L) | -0.314 | 0.088 | 12.743 | 1 | 0.001 | 0.731 | 0.615~0.868 | |
| 血清维生素B12水平(pg/mL) | 0.001 | 0.002 | 0.057 | 1 | 0.812 | 1.000 | 0.997~1.004 | |
| 孕龄为≥12~19孕周 | -0.052 | 0.635 | 0.007 | 1 | 0.935 | 0.949 | 0.273~3.298 | |
| 孕龄为≥19~25孕周 | 0b | — | — | 0 | — | — | — | |
| ≥14~18 | 截距 | 7.565 | 1.206 | 39.326 | 1 | 0.001 | — | — |
| 血清Hcy浓度(μmol/L) | -1.041 | 0.119 | 76.935 | 1 | 0.001 | 0.353 | 0.280~0.446 | |
| 血清维生素B12水平(pg/mL) | 0.004 | 0.002 | 5.514 | 1 | 0.019 | 1.004 | 1.001~1.007 | |
| 孕龄为≥12~19孕周 | 0.208 | 0.672 | 0.096 | 1 | 0.757 | 1.231 | 0.330~4.595 | |
| 孕龄为≥19~25孕周 | 0b | — | — | 0 | — | — | — | |
| ≥18~20 | 截距 | 6.092 | 1.162 | 27.483 | 1 | 0.001 | — | — |
| 血清Hcy浓度(μmol/L) | -0.754 | 0.108 | 48.588 | 1 | 0.001 | 0.471 | 0.381~0.582 | |
| 血清维生素B12水平(pg/mL) | 0.003 | 0.002 | 3.803 | 1 | 0.051 | 1.003 | 1.000~1.006 | |
| 孕龄为≥12~19孕周 | 0.756 | 0.662 | 1.304 | 1 | 0.253 | 2.130 | 0.582~7.801 | |
| 孕龄为≥19~25孕周 | 0b | — | — | 0 | — | — | — |
注:a表示参考类别为血清叶酸水平<7 ng/mL;b表示此参数冗余,因此设置为零。"—"表示无该项内容。Hcy为同型半胱氨酸
②相对于血清叶酸水平为≥7~14 ng/mL(表3):血清Hcy浓度对其他3个血清叶酸水平的影响均有统计学意义(P<0.05),其中血清Hcy浓度每增加1 μmol/L,血清叶酸水平为<7 ng/mL、≥14~18 ng/mL、≥18~20 ng/mL的可能性分别为增加到原来的1.369倍(OR=1.369)、减少到原来的0.483倍(OR=0.483)、减少到原来的0.644倍(OR=0.644);血清维生素B12水平对血清叶酸水平为≥14~18 ng/mL、≥18~20 ng/mL的影响均有统计学意义(P<0.05),其中血清维生素B12水平每增加1 pg/mL,血清叶酸水平为≥14~18 ng/mL、≥18~20 ng/mL的可能性分别增加到原来的1.003倍(OR=1.003)、1.003倍(OR=1.003);孕龄对血清叶酸水平为≥18~20 ng/mL的影响有统计学意义(P<0.05),其中孕龄≥12~19孕周孕妇血清叶酸水平为≥18~20 ng/mL的可能性是孕龄≥19~25孕周孕妇的2.244倍(OR=2.244)。
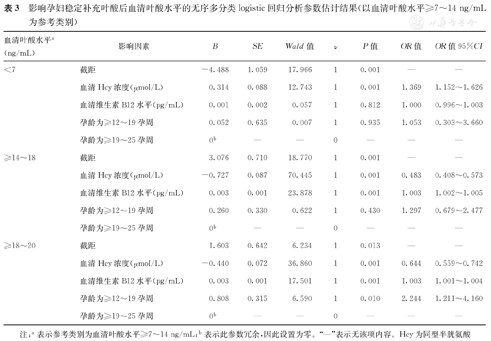
影响孕妇稳定补充叶酸后血清叶酸水平的无序多分类logistic回归分析参数估计结果(以血清叶酸水平≥7~14 ng/mL为参考类别)
影响孕妇稳定补充叶酸后血清叶酸水平的无序多分类logistic回归分析参数估计结果(以血清叶酸水平≥7~14 ng/mL为参考类别)
| 血清叶酸水平a(ng/mL) | 影响因素 | B | SE | Wald值 | ν | P值 | OR值 | OR值95%CI |
|---|---|---|---|---|---|---|---|---|
| <7 | 截距 | -4.488 | 1.059 | 17.966 | 1 | 0.001 | — | — |
| 血清Hcy浓度(μmol/L) | 0.314 | 0.088 | 12.743 | 1 | 0.001 | 1.369 | 1.152~1.626 | |
| 血清维生素B12水平(pg/mL) | 0.001 | 0.002 | 0.057 | 1 | 0.812 | 1.000 | 0.996~1.003 | |
| 孕龄为≥12~19孕周 | 0.052 | 0.635 | 0.007 | 1 | 0.935 | 1.053 | 0.303~3.660 | |
| 孕龄为≥19~25孕周 | 0b | — | — | 0 | — | — | — | |
| ≥14~18 | 截距 | 3.076 | 0.710 | 18.770 | 1 | 0.001 | — | — |
| 血清Hcy浓度(μmol/L) | -0.727 | 0.087 | 70.445 | 1 | 0.001 | 0.483 | 0.408~0.573 | |
| 血清维生素B12水平(pg/mL) | 0.003 | 0.001 | 23.878 | 1 | 0.001 | 1.003 | 1.002~1.005 | |
| 孕龄为≥12~19孕周 | 0.260 | 0.330 | 0.622 | 1 | 0.430 | 1.297 | 0.679~2.477 | |
| 孕龄为≥19~25孕周 | 0b | — | — | 0 | — | — | — | |
| ≥18~20 | 截距 | 1.603 | 0.642 | 6.234 | 1 | 0.013 | — | — |
| 血清Hcy浓度(μmol/L) | -0.440 | 0.072 | 36.860 | 1 | 0.001 | 0.644 | 0.559~0.742 | |
| 血清维生素B12水平(pg/mL) | 0.003 | 0.001 | 17.501 | 1 | 0.001 | 1.003 | 1.001~1.004 | |
| 孕龄为≥12~19孕周 | 0.808 | 0.315 | 6.590 | 1 | 0.010 | 2.244 | 1.211~4.160 | |
| 孕龄为≥19~25孕周 | 0b | — | — | 0 | — | — | — |
注:a表示参考类别为血清叶酸水平≥7~14 ng/mL;b表示此参数冗余,因此设置为零。"—"表示无该项内容。Hcy为同型半胱氨酸
③相对于血清叶酸水平为≥14~18 ng/mL(表4):血清Hcy浓度对其他3个血清叶酸水平的影响均有统计学意义(P<0.05),其中血清Hcy浓度每增加1 μmol/L,血清叶酸水平为<7 ng/mL、≥7~14 ng/mL、≥18~20 ng/mL的可能性均分别增加到原来的2.832倍(OR=2.832)、2.069倍(OR=2.069)、1.333倍(OR=1.333);血清维生素B12水平对血清叶酸水平为<7 ng/mL、≥7~14 ng/mL的影响均有统计学意义(P<0.05),其中血清维生素B12水平每增加1 pg/mL,血清叶酸水平为<7 ng/mL、≥7~14 ng/mL的可能性均减少到原来的0.996倍(OR=0.996)、0.997倍(OR=0.997)。
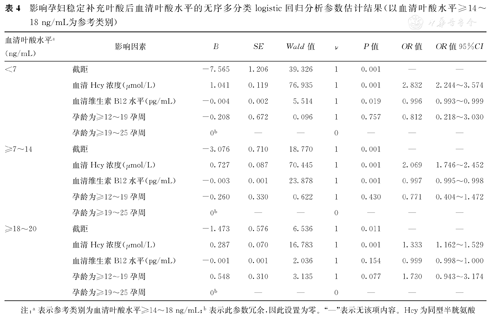
影响孕妇稳定补充叶酸后血清叶酸水平的无序多分类logistic回归分析参数估计结果(以血清叶酸水平≥14~18 ng/mL为参考类别)
影响孕妇稳定补充叶酸后血清叶酸水平的无序多分类logistic回归分析参数估计结果(以血清叶酸水平≥14~18 ng/mL为参考类别)
| 血清叶酸水平a(ng/mL) | 影响因素 | B | SE | Wald值 | ν | P值 | OR值 | OR值95%CI |
|---|---|---|---|---|---|---|---|---|
| <7 | 截距 | -7.565 | 1.206 | 39.326 | 1 | 0.001 | — | — |
| 血清Hcy浓度(μmol/L) | 1.041 | 0.119 | 76.935 | 1 | 0.001 | 2.832 | 2.244~3.574 | |
| 血清维生素B12水平(pg/mL) | -0.004 | 0.002 | 5.514 | 1 | 0.019 | 0.996 | 0.993~0.999 | |
| 孕龄为≥12~19孕周 | -0.208 | 0.672 | 0.096 | 1 | 0.757 | 0.812 | 0.218~3.030 | |
| 孕龄为≥19~25孕周 | 0b | — | — | 0 | — | — | — | |
| ≥7~14 | 截距 | -3.076 | 0.710 | 18.770 | 1 | 0.001 | — | — |
| 血清Hcy浓度(μmol/L) | 0.727 | 0.087 | 70.445 | 1 | 0.001 | 2.069 | 1.746~2.452 | |
| 血清维生素B12水平(pg/mL) | -0.003 | 0.001 | 23.878 | 1 | 0.001 | 0.997 | 0.995~0.998 | |
| 孕龄为≥12~19孕周 | -0.260 | 0.330 | 0.622 | 1 | 0.430 | 0.771 | 0.404~1.472 | |
| 孕龄为≥19~25孕周 | 0b | — | — | 0 | — | — | — | |
| ≥18~20 | 截距 | -1.473 | 0.576 | 6.536 | 1 | 0.011 | — | — |
| 血清Hcy浓度(μmol/L) | 0.287 | 0.070 | 16.783 | 1 | 0.001 | 1.333 | 1.162~1.529 | |
| 血清维生素B12水平(pg/mL) | -0.001 | 0.001 | 2.036 | 1 | 0.154 | 0.999 | 0.998~1.000 | |
| 孕龄为≥12~19孕周 | 0.548 | 0.310 | 3.135 | 1 | 0.077 | 1.730 | 0.943~3.174 | |
| 孕龄为≥19~25孕周 | 0b | — | — | 0 | — | — | — |
注:a表示参考类别为血清叶酸水平≥14~18 ng/mL;b表示此参数冗余,因此设置为零。"—"表示无该项内容。Hcy为同型半胱氨酸
④相对于血清叶酸水平为≥18~20 ng/mL:相关数据及结果描述在前述①~③(表2,表3,表4)中均有重复,故不再赘述。
孕妇补充叶酸对预防出生缺陷至关重要。在孕妇血清叶酸水平降低或不足情况下,母体会首先将其供给胎儿以保证正常孕育。孕期母体叶酸不足可能导致新生儿出生体重过低、叶酸相关性贫血及新生儿感染等发病率增加。人体自身不能合成叶酸,完全依靠食物摄入,叶酸主要储存于肝脏。可以通过检测血清、血浆或红细胞中叶酸含量反映体内叶酸水平[15]。血清叶酸是反映体内近期叶酸水平的1个重要指标[16]。排除饮食和导致叶酸缺乏的慢性疾病干扰,人体血清叶酸水平反复偏低提示叶酸不足或缺乏[17]。孕期补充叶酸,对于预防新生儿神经管畸形及先天性心脏病疗效显著[14]。然而孕妇补充建议量叶酸后,血清叶酸水平存在差异,临床仍然存在30%~60%补充叶酸不敏感孕妇,其吸收和利用叶酸的能力降低[18,19]。血清叶酸水平3 ng/mL为人类预防巨幼红细胞贫血的最低风险值,<3 ng/mL增加该病发生风险[20]。预防新生儿神经管畸形的孕妇最佳血清叶酸水平为>7 ng/mL[21,22,23];血清叶酸水平维持在>13 ng/mL,可以预防原发性高血压患者发生脑梗死[24,25]。
维生素B12和叶酸缺乏,被认为是导致巨幼红细胞贫血的主要原因[26]。维生素B12是类似卟啉的分子,含钴胺素。维生素B12缺乏会导致功能性叶酸缺乏和DNA合成障碍,导致恶性(巨幼母细胞)贫血。血液循环中约20%的维生素B12与蛋白质载体转钴胺结合。维生素B12缺乏可能为不孕或孕妇反复自发性流产的原因[27]。早孕期维生素B12不足可能增加出生缺陷风险及导致早产[28]。孕妇维生素B12水平与孕期糖尿病发生有关,妊娠期糖尿病孕妇血清维生素B12水平明显低于血糖正常孕妇[29]。
孕妇各孕期的血清Hcy浓度均低于未孕女性,中孕期浓度最低,约32孕周至孕足月升高[30,31,32]。孕妇补充叶酸可能会降低孕期血清总Hcy浓度[30],血清叶酸及维生素B12不足可能导致血清Hcy浓度升高,从而损害内皮细胞功能,对胚胎发育产生负面影响[33]。孕妇血清Hcy浓度升高导致的不良后果包括先兆子痫、自然流产、胎盘早剥、胎儿宫内生长受限及早产等[34,35]。孕期补充叶酸有助于减少先兆子痫发生[36]。叶酸、维生素B12及Hcy在机体叶酸代谢途径中相互作用、相互影响[37]。Hcy是叶酸代谢途径中重要的代谢产物,也是导致复发性流产、先兆子痫、早产、胎盘早剥,胎儿宫内生长受限及妊娠期糖尿病的独立危险因素[38];维生素B12是叶酸代谢途径中的关键辅酶,其浓度与活性与所有人群叶酸及Hcy水平关系密切[39]。
本研究718例孕妇在正常饮食情况下,每日补充叶酸400 μg,稳定、持续补充>60 d,于孕龄12~24孕周时的血清叶酸水平为≥7.0~20 ng/mL者占比可达96.80%。根据本研究无序多分类logistic回归分析结果,若将本研究的血清叶酸水平分别定义为如下4个水平(仅见于本文),低(<7 ng/mL)、中(≥7~14 ng/mL)、较高(≥14~18 ng/mL)、高(≥18~20 ng/mL)水平,则3个因素对孕妇补充叶酸后血清叶酸水平的影响如下。①血清Hcy浓度:对血清叶酸低、中、较高3个水平为负向影响,即孕妇血清Hcy浓度越高,该孕妇补充叶酸后的血清叶酸更易为其中2个水平中的低一级水平;但是,对于血清叶酸水平≥14~18 ng/mL和≥18~20 ng/mL而言,孕妇血清Hcy浓越高,补充叶酸后的血清叶酸却更易达到这2个水平中的高一级水平(正向影响)。②血清维生素B12水平:对于补充叶酸后孕妇的血清叶酸水平为<7 ng/mL还是为≥7~14 ng/mL、为≥14~18 ng/mL还是为≥18~20 ng/mL、为<7 ng/mL还是为≥18~20 ng/mL,血清维生素B12对2个水平的影响不大;除此之外,血清维生素B12对血清叶酸水平为正向影响,即孕妇血清维生素B12水平越高,该孕妇补充叶酸后的血清叶酸更易达到2个水平中的高一级水平。③孕龄仅对血清叶酸为≥7~14 ng/mL与≥18~20 ng/mL有影响,即≥12~19孕周孕妇相较于≥19~25孕周孕妇在补充叶酸后,更易达到这2个水平中高一级别的血清叶酸水平。
所有作者声明无利益冲突



























