
颅颌面骨缺损或异常不仅会造成相应功能的障碍,还会影响患者的美观及心理健康。间充质干细胞向成骨细胞谱系分化是骨组织发生与形成的物质基础,也是维持骨稳态的重要因素。成骨分化异常既与多种骨相关疾病有着密切关系,也会对骨组织修复产生消极影响。长链非编码RNA作为近年来新发现的调控因子,在成骨分化过程中发挥着重要的作用。本文拟阐述目前在成骨分化方面起重要调控作用的lncRNA及其机制,并探讨目前研究存在的不足及未来的发展前景。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
光盘如有质量问题,请向编辑部调换
颅颌面骨作为全身形态、结构最为复杂的骨骼,不仅维持了面部的形态与美观,更是咀嚼、呼吸、吞咽和言语等多项重要生理功能行使的基础。它们的损伤或异常既会造成患者相应功能的障碍,也会严重影响其心理健康。骨组织是全身最活跃的组织之一,骨吸收与骨形成间微妙的平衡既维持着骨组织的稳定,也可使其发生一定的适应性改建以应对外部条件的变化。多潜能的间充质干细胞(mesenchymal stem cell,MSC)向成骨细胞谱系分化(osteoblast lineage differentiation)是骨组织发生与形成的物质基础,也是维持骨稳态的重要因素。成骨分化过程的异常可能打破生理性的骨平衡,这与骨质疏松、骨肿瘤和骨关节炎等多种骨相关疾病有着密切联系,同时也对骨折愈合与骨组织缺损修复产生消极影响。探究成骨分化的过程及其调控因素,一方面有助于深入认识骨发生、发育和改建等重要生理过程,理解骨相关疾病的致病机理;另一方面也可深化对骨组织工程(bone tissue engineering,BTE)的认知,为骨组织缺损的修复寻找有效的策略。长链非编码RNA(long non-coding RNA,lncRNA)作为胞内重要的调控因子,可参与细胞多种生物学过程,在调控成骨分化方面也发挥着重要作用。本文拟阐述目前在成骨分化方面起重要作用的lncRNA及其机制,并探讨目前研究存在的不足及未来的发展前景。
在哺乳动物基因组内,约有80%的基因能被转录,但其中仅有1%左右的转录本最终能被翻译为有功能蛋白质。在其余无成熟蛋白质编码功能的转录本中,长度大于200个核苷酸的被称lncRNA。随着研究的深入,人们发现这些曾被认为是基因组内"转录噪音"(transcriptional noise)的lncRNA可能在机体多项生命活动中发挥着重要的调控作用,这为理解细胞多种生物学过程提供了新的角度与方向[1,2]。LncRNA在基因组上位置各异,剪接及修饰机制复杂,这给分类带来了诸多困难。目前,多位学者尝试从不同角度给lncRNA进行分类,暂时没有统一的标准[3,4,5]。但可以肯定的是,lncRNA特殊的基因组定位是其发挥作用的重要基础。相较于微小RNA(microRNA,miRNA)等小片段非编码RNA,更长的片段及更复杂的结构赋予lncRNA更丰富的作用方式。有学者将lncRNA的作用机制归纳为信号(Signals)、诱骗(Decoys)、引导(Guides)和结构骨架(Scaffolds)这四种基本方式[6]。从功能上来看,lncRNA可在基因表观遗传水平、转录水平、转录后修饰及翻译等多个阶段发挥顺式或反式调控作用,进而影响细胞相应的生物学过程及机体各项生命活动[7,8]。某些lncRNA也可通过编码小分子多肽调控相关基因表达从而发挥其生物学作用[9]。而在骨生物学领域,lncRNA作为调控成骨分化的重要因子,正逐渐成为研究者关注的焦点。
MSC向成骨谱系分化是一时序性极强的动态过程,受到微环境多种因素的调控。从整体的角度上看,成骨分化过程可分为谱系定向、细胞增值、基质成熟及基质矿化这四个连续而无明显界限的阶段[10,11]。从细胞的角度看,MSC将经历骨祖细胞(osteoprogenitor cells)、前体成骨细胞(pre-osteobalst)、成熟成骨细胞(osteoblast)及终末阶段的骨细胞/骨衬里细胞(osteocyte/bone lining cells)几个重要时期[12,13]。而从基因表达的角度看,特定的基因在成骨分化过程的不同时期,不同阶段受控地表达是整个过程顺利进行的关键。参与成骨分化的基因数量众多,其中编码RUNX家族转录因子2(RUNX family transcription factor 2,RUNX2)、成骨相关转录因子抗体(ostrix,OSX)、碱性磷酸酶(alkaline phosphatase,ALP)、骨钙素(osteocalcin,OCN)等重要成骨相关蛋白的基因均显示出明显的时序性表达特征[14,15,16]。从调控的角度看,成骨分化是一多因素参与的精密过程。细胞通过细胞膜或胞质内的特定受体接受外界的信号,进而通过复杂的信号转导过程将信息传递到基因层面,保证成骨相关基因,尤其是一些关键基因的正确表达。同时,不同调控因子间可通过信号通路网组成复杂的调控网络,共同维持着成骨分化的平衡。骨形成蛋白(bone formation protein,BMP)、转化生长因子β(transforming growth factor-β,TGF-β)、甲状旁腺激素(parathyroid hormone,PTH)、前列腺素E2(prostaglandin E2,PGE2)、血管内皮生长因子(vascular endothelial growth factor,VEGF)等多种调控因子及Wnt/β-Catenin、TGF-β/BMP、Notch等多条信号通路在成骨分化中的作用机制已有了较为深入的研究[10,17],而以miRNA为代表的非编码RNA在成骨分化过程中的作用也逐步被揭示[18]。LncRNA作为成骨分化调控网络中的重要一员也逐渐受到研究者们关注。
如前所述,由MSC向成骨谱系定向分化是一多时期、多阶段的动态过程。不同来源的MSC,成骨分化不同的时期与阶段间,基因的表达情况可能完全不同,作用的方式也可能存在差异。随着基因测序技术的不断发展,利用高通量测序配合生物信息学分析已成为大规模筛选与成骨分化相关lncRNA的重要手段。例如,Zhang等[19]利用高通量测序手段对正常及成骨诱导分化后的人骨髓间充质干细胞(human bone marrow-derived mesenchymal stem cell,hBMSC)进行基因测序,配合生物信息学手段对比两者之间表达存在明显差异基因,发现hBMSC成骨向分化后,有785个lncRNA表达显著升高,有623个显著下降。接下来其又进一步筛选出6个可能的关键lncRNA,并通过细胞学实验验证了其中的lncRNA XR_111050对hBMSC成骨分化的影响。又如,Yu等[20]通过类似方式筛选人脂肪间充质干细胞(human adipose tissue-derived mesenchymal stem cell,hASC)成骨诱导分化过程中差异性表达的lncRNA,最终明确了在hASC成骨分化中特异性高表达的lncRNA PCAT1,并进一步探究其可能的调控机制。本文试总结了近年来不同研究中与成骨分化相关的lncRNA表达谱,具体内容可参见表1。

与间充质干细胞成骨分化相关的长链非编码RNA
与间充质干细胞成骨分化相关的长链非编码RNA
| 研究模型 | LncRNA表达谱 | 注释 | 参考文献 | 年份 |
|---|---|---|---|---|
| hBMSC | 785个上调;623个下调 | 成骨诱导分化-未成骨诱导分化对比 | [19] | 2017 |
| hBMSC | 318个上调;732个下调 | 成骨诱导分化-未成骨诱导分化对比 | [21] | 2019 |
| hBMSC | 208个上调;131个下调 | 与hAMSC共培养后成骨诱导分化-未共培养后成骨诱导分化对比 | [22] | 2017 |
| hBMSC | 433个上调,233个下调 | 成骨诱导分化-未成骨诱导分化对比 | [23] | 2017 |
| hBMSC | 1392个上调,641个下调 | 经葡萄球菌A蛋白(SpA)处理后成骨诱导分化-未处理后成骨诱导分化对比 | [24] | 2016 |
| hASC | 478个上调;507下调 | 成骨诱导分化-未成骨诱导分化对比 | [25] | 2018 |
| hASC | 1460个上调,1112个下调 | 成骨诱导分化-未成骨诱导分化对比 | [26] | 2017 |
| hPDLSC | 777个上调;183个下调 | 成骨诱导分化-未成骨诱导分化对比 | [27] | 2017 |
| mBMSC | 16个上调;24个下调 | 成骨诱导分化-未成骨诱导分化对比 | [28] | 2018 |
| mBMSC | 140个上调;151个下调 | 成骨诱导分化-未成骨诱导分化对比 | [29] | 2018 |
| rMSC | 281个上调;14个下调 | 经4-胆甾烯-3-酮诱导成骨向分化-未经诱导对比 | [30] | 2018 |
| iMSC | 574个差异性表达 | 成骨诱导分化-未成骨诱导分化对比 | [31] | 2015 |
| Mouse calvarial preosteoclast cells | 3948个差异性表达 | 成骨诱导分化前期(2 ~ 8 d)与后期(10 ~ 18 d)对比 | [32] | 2018 |
| C3H10T1/2 cells | 59个上调;57个下调 | 骨形成蛋白2(BMP-2)处理前后对比 | [33] | 2013 |
注:hAMSC为人羊膜来源间充质干细胞;hPDLSC为人牙周膜干细胞;mBMSC为小鼠骨髓间充质干细胞;rMSC为大鼠间充质干细胞;iMSC为永生化间充质干细胞;Mouse calvarial preosteoclast cells为小鼠颅骨前成骨细胞;C3H10T1/2 cells为小鼠胚胎间充质干细胞株
表观遗传修饰是基因特异性表达的重要分子机制,主要包括DNA甲基化、组蛋白修饰及染色质重构等[34]。lncRNA可通过与相关修饰蛋白相互作用,在表观遗传水平调控成骨分化。例如,抑制成骨分化长链非编码RNA 1(osteogenic differentiation inhibitory lncRNA 1,ODIR1)可通过募集簇集蛋白3(clusterin 3,CUL3),介导F盒单蛋白25(F-box only protein 25,FBXO25)的降解,抑制FBXO25对OSX启动子区域的组蛋白第二亚基120号赖氨酸泛素化(H2BK120ub)和组蛋白第三亚基四号赖氨酸的三甲基化(H3K4me3)修饰,进而降低OSX的表达,最终显著抑制人脐带间充质干细胞(human umbilical cord-derived mesenchymal stem cells,hUC-MSC)成骨向的分化[35](图1A)。在人经血源性子宫内膜干细胞(human menstrual blood-derived stem cell,hMenSC)与hUC-MSC中HOXA转录本反义RNA 1(HOXA transcript antisense RNA myeloid-specific 1,HOTAIRM1)可通过级联激活JNK/AP-1通路(包括JNK蛋白与C-JUN蛋白的磷酸化),促使磷酸化的C-JUN蛋白募集P300蛋白至RUNX2基因附近,介导此区域组蛋白第三亚基27号赖氨酸乙酰化(H3K27ac)修饰,进而促进RUNX2的表达及成骨向分化[36]。有趣的是,在人牙滤泡干细胞(human dental follicle derived stem cell,hDFSC)中,HOTAIRM1通过调控DNA甲基转移酶1(DNA methyltransferase 1,DNMT1)的表达水平及DNMT1在HOXA2启动子区的富集程度,进而在表观遗传水平发挥成骨分化的调控作用[37]。提示,lncRNA的调控机制远比想象中复杂,在不同细胞中、不同条件下,其发挥作用的机制和效果都可能存在差异。
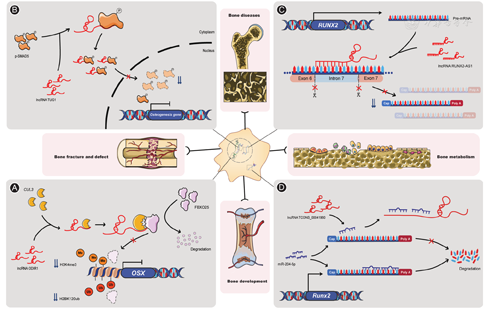

已有足量证据显示,lncRNA可通过调控反式因子或者顺式元件,进而在转录水平影响相关基因的表达[38]。目前的研究结果提示lncRNA也可在基因转录水平调控成骨分化。例如,长链非编码RNA牛磺酸上调基因1(taurine up-regulated gene 1,TUG1)可显著抑制hBMSC成骨向的分化。具体机制为TUG1在胞质中结合SMAD5蛋白,抑制磷酸化SMAD5蛋白(p-SMAD5)的核转位,从而抑制其后续的生物学作用(图1B)。众所周知,SMAD蛋白作为一经典的转录因子,可激活多种成骨关键基因的表达而促进成骨向分化[39]。lncRNA AK045490对成骨分化也有明显抑制作用。体外实验表明AK045490可通过抑制β-CATENIN蛋白的核转位,抑制T细胞转录因子1(T cell transcription factor 1,TCF1)的激活,减少Runx2的表达进而抑制MC3T3-E1细胞的成骨分化;而体内实验则表明敲低AK045490的表达可部分逆转卵巢去势小鼠中骨质疏松的表型[40]。
lncRNA可通过参与mRNA的剪接、修饰等多个环节,在基因转录后水平调控成骨分化。例如,位于胞核的RUNX2反义转录本1(RUNX2 antisense transcript 1,RUNX2-AS1)可通过特异性结合RUNX2前体mRNA(pre-mRNA)的第七号内含子,从而阻止其后续的选择性剪接,进而抑制RUNX2的表达及hBMSC的成骨向分化[41](图1C)。在多发性骨髓瘤患者来源的间充质干细胞(multiple myeloma-derived mesenchymal stem cell,MM-MSC)中,位于胞质的HOXC反义转录本3(HOXC antisense transcript 3,HOXC-AS3)作为HOXC10的天然反义lncRNA,可通过与HOXC10 mRNA碱基互补的部分与之结合,增加HOXC10 mRNA的稳定性,进而增加HOXC10的表达,削弱MM-MSC的成骨向分化性能。而在正常人来源的间充质干细胞(normal donor-derived mesenchymal stem cell,ND-MSC)中选择性敲低HOXC-AS3,则会能提高其成骨分化的能力[42]。综上,lncRNA在pre-mRNA的选择性剪接及mRNA的后续修饰中均起到了重要的作用,这可能是其调控MSC成骨向分化的重要机制。
值得注意的是,lncRNA与miRNA组成调控网络也是其发挥作用的重要方式。例如,胞质内的基因间长链非编码RNA-重编程调控因子(long intergenic noncoding RNA-regulator of reprogramming,Linc-ROR)可通过竞争内源性RNA(competing endogenous,ceRNA)机制,富集miR-138与miR-145两种miRNA,从而解除两者对于E盒结合锌指蛋白2(zinc finger E-box protein 2,ZEB2)的表达抑制作用。ZEB2又进一步促进β-CATENIN的表达,进而通过Wnt/β-Catenin通路促进hBMSC的成骨向分化[43]。又如lncRNA TCONS_00041960可通过ceRNA机制,富集miR-204-5p,解除其对Runx2的表达抑制,进而促进大鼠骨髓间充质干细胞(rat bone marrow-derived mesenchymal stem cells,rBMSC)成骨向分化(图1D);同时,通过富集miR-125a-3p,解除其对亮氨酸拉链蛋白(glucocorticoid-induced leucine zipper,GIlz)的表达抑制,GILZ蛋白又进一步抑制成脂关键因子过氧化物酶体增殖剂激活受体γ(peroxisome proliferators-activated receptors gamma,Pparγ)的表达,最终削弱rBMSC的成脂分化性能。由此可见,lncRNA TCONS_00041960在MSC成骨-成脂平衡中起到了重要的调控作用[44]。
Wnt/β-Catenin通路作为细胞信号转导的重要途径,参与众多生物学过程。β-CATENIN可激活众多成骨关键因子,如RUNX2或者OSX等的转录,进而促进成骨向分化[45]。例如,白藜芦醇(RSV)可上调长链非编码RNA KCNQ1重叠转录本1(LncRNA KCNQ1OT1)的表达,进而通过Wnt/β-Catenin通路促进小鼠间充质干细胞(mice mesenchymal stem cell,mMSC)的成骨分化[46]。而TWIST1同系物1相关长链非编码RNA(LncRNA TWIST1)可抑制与其在基因组上反向毗邻的编码基因TWIST1的表达,进而激活Wnt/β-Catenin通路,促进hPDLSC的成骨向分化[47]。TGF-β通路在细胞的增殖、分化、凋亡,胚胎发育,器官的形成等方面有重要的调控作用;而BMP蛋白作为TGF-β超家族的成员,可有效激活MSC成骨分化的潜能[48,49]。例如,LncRNA LOC10369133可通过竞争性结合miR-138-5p,解除其对骨形成蛋白受体2(bone morphogenetic protein receptor type 2,Bmpr2)的表达抑制作用,进而激活BMP通路促进rBMSC的成骨向分化[50]。而前文所述的Zhang等[39]的研究显示,lncRNA TUG1可通过抑制p-SMAD5蛋白的核转位,进而抑制TGF-β通路,显著抑制hBMSC的成骨分化能力。核转录因子κB(nuclear transcription factor-kappa B,NF-κB)通过调控多种关键基因的表达,参与机体免疫反应、炎症反应、细胞凋亡、肿瘤发生等多种生物学过程[51]。NF-κB通路作为机体炎症的重要中介分子,是理解炎症微环境对于成骨分化影响的重要切入点。在hMenSC与hUS-MSC中,NF-κB可通过募集组蛋白去乙酰化酶抑制剂2(histone deacetylase 2,HDAC2)至成骨关键基因特异性磷酸酶7(specificity phosphatase 7,SP7),也就是OSX的启动子附近,促进此区域组蛋白第三亚基27号赖氨酸乙酰化(H3K27ac),进而抑制SP7的表达,抑制MSC成骨向分化;而HOXA反义转录本2(HOXA antisense transcript 2,HOXA-AS2)则可通过阻止RELA蛋白310号赖氨酸乙酰化,抑制NF-κB的功能,进而解除其对SP7的转录抑制作用,促进MSC的成骨向分化[52]。同时也有研究显示,lncRNA可通过其他途径,如PI3K/Akt通路[25],p38 MAPK通路[53]等参与成骨分化过程的调控。
总的来说,lncRNA复杂的结构及其在基因组上位置的多样性暗示了其调控机制的复杂。目前来看,lncRNA作为调控成骨向分化的重要因子,在基因表观遗传水平、转录水平及转录后修饰等多各方面均发挥着重要的作用。同时,lncRNA可与各成骨相关信号通路间组成复杂的交联网络。在不同细胞、不同条件下,lncRNA可通过不同的信号通路调控成骨分化性能。
本文试从细胞模型、体内验证、调控机制、相关信号通路及作用效果几个方面对近年来lncRNA调控成骨向分化相关的研究做一总结,具体内容可参见表2。
长链非编码RNA(lncRNA)调控MSC成骨分化的研究总结
长链非编码RNA(lncRNA)调控MSC成骨分化的研究总结
| LncRNA | 细胞模型 | 体内验证 | 调控机制 | 相关信号通路 | 作用效果 | 参考文献 | 年份 |
|---|---|---|---|---|---|---|---|
| NKILA | hMenSC & hUC-MSC | 无 | NF-κB/HDAC2/RUNX2;RXFP1/Akt | NF-κB通路;PI3K-Akt通路 | 促成骨 | [54] | 2020 |
| FER1L4 | hPDLSC | 有 | miR-874-3p/VEGFA | 未明确 | 促成骨 | [55] | 2020 |
| LINC00707 | hBMSC | 无 | miR-145/LRP5/β-catenin | Wnt/β-catenin通路 | 促成骨 | [56] | 2020 |
| HOXA-AS2 | hUC-MSC | 无 | NF-κB/HDAC2/SP7 | NF-κB通路 | 促成骨 | [52] | 2019 |
| XIXT | hBMSC | 无 | miR-30a-5p/RUNX2 | 未明确 | 促成骨 | [57] | 2019 |
| MSC-AS1 | BMSC | 无 | miR-140-5p/BMP2/Smad | BMP通路 | 促成骨 | [58] | 2019 |
| AK045490 | MC3T3-E1 | 有 | β-Catenin/TCF1/Runx2 | Wnt/β-Catenin通路 | 抑制成骨 | [40] | 2019 |
| LncRNA-OG | hBMSC | 有 | hnRNPK/LncRNA-OG/BMP family | BMP通路 | 促成骨 | [21] | 2019 |
| HOXC-AS3 | hBMSC;U266 cell line | 有 | 提高HOXC10 mRNA稳定性 | 未明确 | 抑制成骨 | [42] | 2019 |
| LOC103691336 | rBMSC | 有 | miR-138-5p/BMP2 | BMP通路 | 促成骨 | [50] | 2019 |
| ODIR1 | hUC-MSC | 有 | CUL3/FBXO25/OSX | 未明确 | 抑制成骨 | [35] | 2019 |
| HOTAIRM1 | hMenSC;hUC-MSC | 无 | JNK/c-Jun/P300/RUNX2 | JNK/AP-1通路 | 抑制成骨 | [36] | 2019 |
| hDFSC | 无 | DNMT1/HOXA2 | 未明确 | 促成骨 | [37] | 2020 | |
| SNHG1 | mBMSC | 无 | Nedd4/p38 | P38 MAPK通路 | 抑制成骨 | [59] | 2019 |
| PCAT1 | hASC | 无 | miR-145-5p/TLR4 | TLR通路 | 促成骨 | [20] | 2018 |
| HIF1A-AS2 | hADSC | 无 | miR-665/IL6/PI3K/Akt | PI3K/Akt通路 | 促成骨 | [25] | 2018 |
| RUNX2-AS1 | hBMSC | 有 | 抑制RUNX2 pre-mRNA选择性剪接 | 未明确 | 抑制成骨 | [41] | 2018 |
| DANCR | hBMSC | 无 | 抑制p38磷酸化 | P38 MAPK通路 | 抑制成骨 | [53] | 2018 |
| H19 | mBMSC | 无 | miR-188/LCoR | 不明 | 促成骨 | [29] | 2018 |
| hBMSC | 无 | miR-138/PTK2 | PTK通路 | 促成骨 | [60] | 2018 | |
| KCNQ1OT1 | mMSC | 无 | 与Wnt/β-catenin通路相关 | Wnt/β-catenin通路 | 促成骨 | [46] | 2018 |
| Linc-ROR | hBMSC | 无 | miR-138 & miR-145/ZEB2/β-catenin | Wnt/β-catenin通路 | 促成骨 | [43] | 2018 |
| MEG3 | hBMSC | 无 | miR-133a-3p/SLC39A1 | 未明确 | 抑制成骨 | [61] | 2017 |
| hDFSC | 无 | EZH2/β-catenin | Wnt/β-catenin通路 | 抑制成骨 | [62] | 2018 | |
| TUG1 | hPDLSC | 无 | 募集LIN28A | 未明确 | 促成骨 | [63] | 2018 |
| hBMSC | 无 | 抑制p-SMAD5核转位 | 未明确 | 抑制成骨 | [39] | 2019 | |
| TCONS_00041960 | rBMSC | 无 | miR-204-5p/RUNX2 | 未明确 | 促成骨 | [56] | 2020 |
| hBMSC | 无 | miR-143/OSX | 未明确 | 促成骨 | [64] | 2018 | |
| MALAT1 | hASC | 无 | miR-30/RUNX2 | 未明确 | 促成骨 | [65] | 2019 |
| hBMSC & hFOB1.19 | 有 | miR-34c/SATB2 | 未明确 | 促成骨 | [66] | 2019 |
注:hDFSC为人牙滤泡干细胞;hFOB1.19为人成骨细胞系;U266为人骨髓瘤细胞系
随着研究的不断深入,lncRNA在多种生物学过程中的调控作用正被逐步地揭示。可目前来看,lncRNA对成骨分化调控的相关研究仍存在着不少的盲点与不足。
首先,对于调控机制的研究仍需进一步深入。不同的lncRNA因来源、剪接、修饰等的不同,其结构、定位、功能可能产生巨大差异,这提示lncRNA的作用机理可能远比想象中复杂。如果能从lncRNA在基因组的位置及其与毗邻基因的联系,或者从lncRNA的结构、修饰、亚细胞分布与功能的联系等角度思考其对基因信息传递的影响,可能更有助于进一步理解其中复杂的调控网络。同时也需要注意,成骨分化是精确而又具有很强时序性的过程,同一个lncRNA在不同时间段对成骨分化的影响可能不同,对其机制的研究有必要考虑时间这一重要维度。
其次,MSC的命运决定和成骨谱系分化受到微环境多种因素的影响,故研究成骨分化的调控不应忽略细胞与细胞、细胞与微环境间的信息交流。有趣的是,有文献指出lncRNA可被包裹入外泌体内,由一个细胞内传递到另一个细胞内,进而发挥其调控功能[41,67,68]。这提示,lncRNA不仅是胞内信息传递的重要因子,也可能是细胞与细胞、细胞与微环境间信息交流的重要媒介。这也为深入理解lncRNA对成骨分化调控的机制提供了新的思路。
最后,目前的研究与临床应用间仍存在着不小的差距。目前已有大量研究揭示了lncRNA在成骨分化过程中的重要作用,但遗憾的是,其中大多数的研究仅集中于细胞水平,缺乏稳定可靠的动物模型加以确证。这说明目前对lncRNA的研究仍处于起步阶段,将lncRNA应用于骨相关疾病的治疗或者促进骨组织再生修复的靶点也只停留在理论阶段,临床应用条件仍不成熟。
近年来,蓬勃发展生物信息学成为研究者从"大数据"视角探究基因信息传递相关调控网络的重要工具;基因编辑技术,尤其是CRISPR/Cas9系统的飞速发展,让研究者看到了对特定细胞进行安全、精准、高效基因编辑的希望[69];而生物材料学等新兴交叉学科的不断进展,则为组织工程学提供了更多的可能性[70]。相信随着基础研究的不断进展,lncRNA调控成骨向分化的更多机制将被揭示,我们将对骨发生、发育、改建等生理过程及多种骨相关疾病的致病机理有更深入的理解,也终将寻找到安全、有效的策略实现骨相关疾病的治疗及骨缺损的再生与修复。
所有作者均声明不存在利益冲突






























