
探讨肾移植术后移植肾局灶性节段性肾小球硬化(FSGS)复发的危险因素及其治疗效果。
回顾性分析2008年1月至2017年4月浙江大学医学院附属第一医院肾脏病中心16例原发病为FSGS的肾移植受者资料,根据术后移植肾FSGS早期复发情况分为复发组(6例)和未复发组(10例)。两组受者肾移植术前原发病发病年龄、肾移植手术时年龄和供者年龄比较采用t检验;两组受者肾移植术前进展至终末期肾病(ESRD)时间、HLA错配数和透析时间比较采用Mann-Whitney检验;两组受者性别、供肾方式、供者性别、是否进行免疫诱导和是否预防性使用利妥昔单抗比较采用Fisher确切概率法。P<0.05为差异有统计学意义。
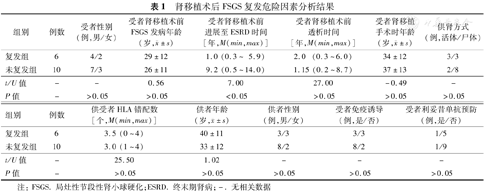
复发组和未复发组进展至ESRD的时间分别为1.0年(0.3~5.9年)和9.2年(0.5~14.0年),差异有统计学意义(U=7.00,P<0.05)。两组间受者性别、发病年龄、透析时间、供者类型、手术时年龄、HLA错配数、是否进行免疫诱导、是否预防性使用利妥昔单抗、供者年龄和性别等差异均无统计学意义(P均>0.05)。复发组6例受者经血浆置换联合大剂量环孢素治疗后,3例完全缓解,2例短期内部分缓解,1例部分缓解。
早期使用血浆置换联合大剂量环孢素能快速、有效且持续缓解移植肾FSGS复发的病变程度和进程。原发性FSGS快速进展至ESRD时间可能是影响肾移植术后移植肾FSGS早期复发的重要因素。

版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅,光盘如有质量问题,请向编辑部调换
局灶性节段性肾小球硬化(focal segmental glomerulosclerosis,FSGS)是导致激素抵抗型肾病综合征的常见原因,50%~70%FSGS患者最终会发展为终末期肾病(end stage renal disease,ESRD)[1]。肾移植术后FSGS复发率约为30%~50%,因FSGS复发致移植肾失功再次肾移植后复发率高达100%,因此临床上不提倡此类受者再次接受肾移植[2,3,4,5]。移植后FSGS复发可分为两种类型[6]:(1)早期复发,常在肾移植术后数小时至数天内发生大量蛋白尿(>3.5 g/d),血浆白蛋白降低及血清肌酐升高;(2)晚期复发,常在肾移植术后几个月至几年内发生,表现相对隐蔽。肾移植术后FSGS复发患者的治疗包括:血浆置换、糖皮质激素、环孢素、环磷酰胺和吗替麦考酚酯(mycophenolate mofetil,MMF)、肾素血管紧张素醛固酮系统阻断剂、抗CD20单克隆抗体等[7]。目前大多数报道仅涉及儿童肾移植后FSGS复发患者,不同报道中的不同治疗方案临床效果也存在差异,且国内无相关报道[1]。本研究回顾性分析2008年1月至2017年4月因ESRD于浙江大学医学院附属第一医院肾脏病中心行同种异体肾移植的16例原发病为FSGS受者临床资料,探讨肾移植术后FSGS复发的危险因素,并总结血浆置换联合大剂量环孢素治疗FSGS的经验。
根据肾移植术后早期是否复发FSGS,将16例受者分为复发组和未复发组,其中复发组6例,未复发组10例。截至2017年4月,复发组和未复发组中位随访时间分别为为2.1年(1.5~9.2年)、1.8年(0.5~5.4年)。本研究由医院医学伦理委员会审核通过并签署知情同意书。
所有受者术后均采用泼尼松+MMF+CNI三联免疫抑制方案。泼尼松:术后当天12 mg/kg,第1~2天10 mg/kg,第3天5 mg/kg,第4~7天40 mg/d,第8天20 mg/d,之后逐渐减量。MMF:1.5 g/d。CNI:9例使用他克莫司,起始剂量为0.12 mg·kg-1·d-1,血药浓度谷值维持在5~10 mg/L;7例使用环孢素,起始剂量为6 mg·kg-1·d-1,血药浓度谷值维持在150~250 mg/L。8例受者术中及术后第4天应用巴利昔单抗进行免疫诱导(20 mg/d),3例受者术中及术后第2~4天应用抗胸腺细胞球蛋白(antithymocyte globulin,ATG)进行免疫诱导(1 mg·kg-1·d-1),余未进行免疫诱导。2例受者术中预防性使用利妥昔单抗(375 mg/m2)。
比较复发组和未复发组受者性别、原发病发病年龄、进展至ESRD时间、透析时间、供肾类型、手术时年龄、HLA错配数、是否进行免疫诱导、是否预防性使用利妥昔单抗、供者年龄和性别等一般资料。观察复发组受者使用血浆置换联合大剂量环孢素对移植肾FSGS复发的治疗效果。
移植肾早期复发FSGS定义为:原发病为FSGS,术后3个月内发生大量蛋白尿(>3.5 g/d),且移植肾活检明确为FSGS。蛋白尿完全缓解、部分缓解、快速缓解、持续缓解分别定义为尿蛋白定量<0.3 g/d、尿蛋白量较复发后最多时减少50%、复发治疗3个月内缓解、缓解期>12个月。移植肾急性排斥反应(acute rejection,AR)采用肾穿刺活检确诊。
应用SPSS 22.0统计软件进行数据处理。符合正态分布的计量资料采用均数±标准差( ±s)表示,采用独立样本t检验比较复发组与非复发组受者原发病发病年龄、手术时年龄和供者年龄的差异。不符合正态分布的计量资料采用中位数表示,采用Mann-Whitney检验比较两组进展至ESRD时间、透析时间和HLA错配数的差异。计数资料采用百分比表示,采用Fisher确切概率法比较复发组与非复发组受者性别、供肾类型、供者性别、是否进行免疫诱导和是否预防性使用利妥昔单抗的差异。P<0.05为差异有统计学意义。
±s)表示,采用独立样本t检验比较复发组与非复发组受者原发病发病年龄、手术时年龄和供者年龄的差异。不符合正态分布的计量资料采用中位数表示,采用Mann-Whitney检验比较两组进展至ESRD时间、透析时间和HLA错配数的差异。计数资料采用百分比表示,采用Fisher确切概率法比较复发组与非复发组受者性别、供肾类型、供者性别、是否进行免疫诱导和是否预防性使用利妥昔单抗的差异。P<0.05为差异有统计学意义。
复发组和未复发组受者肾移植术前进展至ESRD的中位时间分别为1.0年(0.3~5.9年)和9.2年(0.5~14.0年),差异有统计学意义(U=7.00,P<0.05)。两组受者性别、发病年龄、透析时间、供者类型、手术时年龄、HLA错配数、是否进行免疫诱导、是否预防性使用利妥昔单抗、供者年龄及性别等差异均无统计学意义(P均>0.05)。详见表1。
肾移植术后FSGS复发危险因素分析结果
肾移植术后FSGS复发危险因素分析结果
| 组别 | 例数 | 受者性别(例,男/女) | 受者肾移植术前FSGS发病年龄(岁, ±s) ±s) | 受者肾移植术前进展至ESRD时间[年,M(min,max)] | 受者肾移植术前透析时间[年,M(min,max)] | 受者肾移植手术时年龄(岁, ±s) ±s) | 供肾方式(例,活体/尸体) |
|---|---|---|---|---|---|---|---|
| 复发组 | 6 | 4/2 | 29±12 | 1.0 (0.3~ 5.9) | 2.0 (0.3~6.0) | 34±12 | 3/3 |
| 未复发组 | 10 | 7/3 | 26±11 | 9.2 (0.5~14.0) | 1.15 (0.2~8.7) | 37±13 | 2/8 |
| t/U值 | - | - | 0.56 | 7.00 | 27.00 | -0.49 | - |
| P值 | - | >0.05 | >0.05 | <0.05 | >0.05 | >0.05 | >0.05 |
| 组别 | 例数 | 供受者HLA错配数[个,M(min,max)] | 供者年龄(岁, ±s) ±s) | 供者性别(例,男/女) | 受者免疫诱导(例,是/否) | 受者利妥昔单抗预防(例,是/否) |
|---|---|---|---|---|---|---|
| 复发组 | 6 | 3.5 (0~4) | 40±11 | 3/3 | 3/3 | 1/5 |
| 未复发组 | 10 | 3.0 (1~4) | 33±12 | 8/2 | 8/2 | 1/9 |
| t/U值 | - | 25.50 | 1.02 | - | - | - |
| P值 | - | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 |
注:FSGS.局灶性节段性肾小球硬化;ESRD.终末期肾病;-.无相关数据
复发组3例受者复发时间分别为移植后第1、2和14天。复发时尿蛋白分别为9.5、11.1和4.5 g/d,血清肌酐分别为314、236和345 mmol/L。采用血浆置换联合大剂量环孢素治疗后完全缓解。血浆置换次数分别为5、5和3次。环孢素使用时间分别为移植后第5、3和18天;给药方式分别为口服、口服和静脉输注;使用1个月内中位环孢素血药浓度谷值分别为337(306~381)、395(361~422)和413 ng/mL(388~450 ng/mL)。末次随访血清肌酐分别为131、127和125 mmol/L,尿蛋白均为阴性。
复发组2例受者采用血浆置换联合大剂量环孢素治疗后短期部分缓解。1例移植后第2天出现少尿,尿蛋白23.1 g/d,血清肌酐200 mmol/L,考虑发生AR,予静脉输注ATG(1 mg/kg,连用3 d)治疗后效果不佳。分别于术后第5、7和9天各行血浆置换1次(一次分离),置换量分别为2 700、2 250和2 460 mL;术后第27天移植肾穿刺活检结果提示FSGS复发,开始使用环孢素,使用后1个月内中位血药浓度谷值为313 ng/mL(286~346 ng/mL)。术后第45天达到部分缓解,血清肌酐维持在110~130 mmol/L,尿蛋白1.5~2.5 g/d。术后第120天尿蛋白升高至10.0 g/d,移植肾穿刺活检结果仍提示FSGS复发。术后第130、133天行各行1次血浆置换(一次分离),置换量分别为2 070、1 930 mL;同时联合环孢素治疗,中位血药浓度谷值为299 ng/mL(272~344 ng/mL),治疗效果不佳。术后第162天发生移植肾失功,恢复血液透析。另1例复发组受者移植后第3天出现少尿,尿蛋白4.5 g/d,血清肌酐260 mmol/L。移植肾穿刺活检结果提示ⅡA级细胞性AR,可能伴肾小管上皮细胞空泡变性,见图1。予ATG(1 mg/kg,连用3 d)抗排斥反应治疗后血清肌酐逐渐下降,尿蛋白维持在0.8~2.5 g/d。术后第72天出现大量蛋白尿(14.9 g/d),再次行移植肾穿刺活检结果提示FSGS复发伴新月体形成,予血浆置换及口服环孢素治疗,分别于术后第77、79和82天各行血浆置换1次(一次分离),置换量分别为2 020、2 010和2 070 mL;第73天使用环孢素,使用后1个月内中位血药浓度谷值为306 ng/mL(285~340 ng/mL)。第177天部分缓解,移植1年后发生移植肾失功,恢复血液透析。
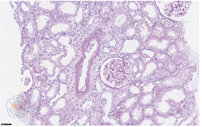

注:FSGS.局灶性节段性肾小球硬化;PAS.过碘酸雪夫染色
复发组1例受者采用血浆置换联合大剂量环孢素治疗后部分缓解。该受者肾移植后第2天出现大量蛋白尿(16.2 g/d),血清肌酐为336 mmol/L,移植肾穿刺活检结果提示FSGS复发。分别于术后第4、6、8、11和15天各行血浆置换1次(一次分离),置换量分别为1 970、2 010、1 950、2 020和2 010 mL。移植后第4天使用环孢素,使用1个月内中位血药浓度谷值为251 ng/mL(222~272 ng/mL)。术后第90天部分缓解,血清肌酐维持在140~170 mmol/L,尿蛋白维持在1.0~2.0 g/d。
肾移植后FSGS复发危险因素主要包括:受者发病年龄、是否存在肾小球系膜增生、原发病进展至ESRD时间、移植前双侧肾切除、活体供肾、术后免疫抑制剂的使用、白种人、携带相关特殊基因、移植前大量蛋白尿及因移植肾FSGS复发的二次移植等[1,8,9,10,11,12]。本研究发现,原发病快速进展至ESRD是肾移植后移植肾FSGS复发的危险因素。
据文献报道,常规剂量环孢素似乎不能有效预防或治疗肾移植后FSGS复发[13,14],目前认为与肾病综合征高脂血症抑制环孢素活性部分有关,而大剂量环孢素能有效预防或治疗肾移植后FSGS复发,可能与大剂量环孢素通过抑制T细胞和去磷酸化足细胞特异性突触连接蛋白(足细胞肌动蛋白细胞骨架的关键稳定剂)来减少蛋白尿有关[15]。此外,环孢素可引起肾小球血管收缩,减少肾小球血流量或降低囊内压,从而减少蛋白尿[16]。Salomon等[17]报道静脉注射环孢素(其中4例同时接受血浆置换)的17例肾移植后复发性肾病综合征的儿童受者中,14例蛋白尿减轻;4年后,11例持续缓解。Raafat等[18]报道了16例肾移植后复发FSGS儿童受者接受大剂量口服环孢素治疗,13例获得缓解(其中7例同时接受血浆置换),包括11例完全缓解和2例部分缓解,余3例未缓解。Canaud等[19]报道了10例成人肾移植后复发FSGS受者接受大剂量糖皮质激素+大剂量环孢素+血浆置换治疗,静脉输注环孢素(血药浓度谷值200~400 ng/mL),2周后改为口服环孢素(血药浓度峰值1 200~1 400 ng/mL),同时口服糖皮质激素(前4周1 mg·kg-1·d-1,然后逐渐减量),并进行血浆置换,最终9例完全缓解,1例未缓解(使用利妥昔单抗后缓解)。本研究6例复发受者中,3例应用血浆置换联合大剂量环孢素治疗后达到完全缓解;1例使用环孢素后1个月内中位血药浓度谷值为251 ng/mL(222~272 ng/mL),未能达到完全缓解,可能与环孢素浓度较低有关;2例短期内部分缓解的受者肾移植术后早期即出现了大量蛋白尿,其中1例第1次穿刺活检时病理即提示伴足细胞病变,但由于2例受者均存在AR,掩盖了同时合并存在的FSGS复发,导致治疗延误(分别在复发后第25天和第70天使用环孢素),影响了治疗效果,最终导致移植肾失功。
血浆置换和免疫吸附对于移植肾FSGS复发的治疗是基于清除循环中的"FSGS因子"(一种可能来自T淋巴细胞,能增加肾小球对白蛋白通透性的因子,包括suPAR、心肌营养蛋白样细胞因子1、脂蛋白A-Ⅰ、血管扩张刺激磷蛋白等),以缓解肾小球损伤、蛋白尿进展和肾功能恶化[1,19,20,21]。1985年,Zimmerman等[22]首次发现血浆置换可缓解FSGS复发后蛋白尿。Gohh等[23]报道关于预防性使用血浆置换对FSGS复发的影响,10例具有高复发风险的FSGS肾移植受者在围手术期中进行了8次血浆置换,7例(包括4例接受首次移植和3例复发)在随访结束时没有复发。Chikamoto等[24]研究发现,接受第2次活体肾移植的FSGS高复发风险儿童受者(移植肾由于FSGS复发而丢失)预防性使用血浆置换(在移植前12 d进行4次血浆置换),同时接受2周疗程的利妥昔单抗+甲泼尼龙+他克莫司+MMF,移植后8个月,移植肾活检未发现FSGS复发。
利妥昔单抗是一种人鼠嵌合的抗CD20单克隆抗体,自2006年有研究证实其可用于治疗移植肾FSGS复发后[25],陆续有研究进一步验证了该结论[26,27],但目前关于其对预防移植肾FSGS复发的报道较少。2011年,Fornoni等[3]回顾性分析27例具有FSGS高复发风险的肾移植受者,围手术期预防性使用利妥昔单抗,术后随访1年,蛋白尿发生比例较低,肾功能亦较稳定。利妥昔单抗对于FSGS的预防和治疗机制尚未明确,目前认为主要通过直接影响B细胞或间接影响T细胞或其他细胞,从而减少FSGS相关影响因子的产生[28]。此外,利妥昔单抗还可能通过调节筏微结构中酸性鞘磷脂酶活性,保护足细胞鞘磷脂相关酶,防止肌动蛋白细胞骨架重塑,从而减少蛋白尿的产生[29]。本研究中2例预防性使用利妥昔单抗的受者中,1例移植肾FSGS早期复发,其复发时间、复发时蛋白尿定量、治疗后蛋白尿缓解速度、肾功能恢复情况与未使用利妥西单抗受者无明显差异。
综上所述,早期使用血浆置换联合大剂量环孢素能快速、完全并持续缓解移植肾FSGS的病变程度和进展。原发病快速进展至ESRD是移植肾FSGS复发的独立危险因素。但本研究病例数较少,因此尚需长期、多中心研究来进一步证实。






























