
总结新型胃癌——胃底腺型胃癌的临床、内镜及病理特征。
回顾性分析2019年4月至2022年6月于国家消化系统疾病临床医学研究中心发现的20例胃底腺型胃癌病例,对临床表现、内镜特点、治疗及病理特征做了归纳和总结。
胃底腺型胃癌缺乏特异性临床表现,白光内镜下表现为一种发生于胃底(65%)及胃体中上部(35%)正常胃底腺之上的黏膜下肿物样肿瘤,放大内镜下表现为渐进式由正常胃底腺黏膜逐渐过渡至腺管开口消失、"白区"异常鲜明以及血管异形型明显的病变区域,在超声内镜下表现为主体位于黏膜肌层的低回声占位,黏膜表层高回声似乎完整未中断,与黏膜下层分界欠清。病理方面,可见病变浅层有小凹上皮分布,深层见不规则的、相互融合的腺体,病变向深层延伸,突破黏膜肌层向下生长,部分侵犯黏膜下层。该型胃癌根据免疫组织化学标志物pepsinogen(主细胞)和H/K-ATPase(壁细胞)区分为主细胞型、壁细胞型和混合细胞型,临床上以主细胞型(76.5%)及混合细胞型(23.5%)多见。胃底腺型胃癌恶性度较低,内镜黏膜下剥离术可有效完整切除肿瘤。
胃底腺型胃癌是一种容易漏诊的新型胃癌,需要内镜医生借助放大胃镜、超声胃镜来加强识别能力,基层医院可借助病理活检明确诊断,早期诊断并行内镜下治疗可取得良好预后。

本刊版权归人民卫生出版社有限公司所有。任何机构或个人欲转发本刊图文,请与本刊联系。凡未经授权而转载、摘编本刊文章者,本刊将保留追究其法律责任的权利。
根据病理组织学不同,胃癌分为乳头状腺癌、管状腺癌、黏液腺癌、印戒细胞癌、腺棘癌、未分化癌等。伴随消化内镜学及病理学的飞速发展,临床医生对胃癌的分型进行了越来越细致的认识和划分。2007年Tsukamoto教授[1]等首次发现一种分化于胃底腺的新型胃癌。随后在2010年,Ueyama等[2]发表了10例该型胃癌的整理数据,并正式命名为胃底腺型胃癌(gastric adenocarcinoma of fundic gland type,GA-FG)。我国也在2018年报道了首例GA-FG的病例[3],随后陆续有我国学者从临床特点、内镜表现及病理特征等方面做了个案报道,这种新型胃癌逐渐被内镜医生和病理医生所认识,但仍有很多诊断和治疗相关科学问题尚未明确,亟待更多病例数据的总结和归纳。
GA-FG起病隐匿,缺乏特异性临床特点,且其黏膜下生长的方式导致该型胃癌在胃镜下不易发现。即使发现病变,因很多内镜医生缺乏对这种新型胃癌内镜特征的认识,容易与胃底腺息肉或肠化灶等良性病变混淆,从而忽视了活检造成漏诊。因此,我们对2019年4月至2022年6月于国家消化系统疾病临床医学研究中心发现的20例GA-FG病例的临床、内镜表现、治疗及病理特征做了总结,希望对消化内镜医生提高对该型胃癌诊断率有所帮助。
自2019年4月至2022年6月于我中心于内镜下发现并经病理确诊的GA-FG患者20例。
内镜主机为奥林巴斯290主机/富士能VP-7000主机;放大内镜(magnifying endoscopy,ME)为奥林巴斯GIF-HQ290Z/奥林巴斯GIF-H260Z/富士能EG-760Z;超声内镜为奥林巴斯或富士能小探头超声;治疗内镜为奥林巴斯GIF-Q260J。
以VS分类系统作为标准,在奥林巴斯内镜窄带成像术(narrow band imaging,NBI)或富士能蓝光成像技术(blue light imaging,BLI)下放大观察微血管及微结构。
所有接受治疗的患者均采用内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)作为治疗手段。
苏木精-伊红(hematoxylin-eosin staining,HE染色)及免疫组织化学染色Mucin-6、Desmin、Pepsinogen、H/K-ATPase、Ki-67、P53。
本研究于2019年4月至2022年6月共纳入20例病理诊断为GA-FG患者,其中男性9例,占45%,女性11例,占55%。年龄37~79岁,其中45岁以下的3例,45~60岁的8例,60岁以上的9例,平均年龄59岁(表1)。

胃底腺型胃癌患者的临床特征及临床表现
胃底腺型胃癌患者的临床特征及临床表现
| 病例编号 | 性别 | 年龄(岁) | 症状描述 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| 腹胀 | 嗳气 | 上腹痛 | 反酸 | 恶心 | 呕吐 | 无不适 | |||
| 1 | 女 | 61 | √ | ||||||
| 2 | 女 | 39 | √ | ||||||
| 3 | 男 | 47 | √ | √ | |||||
| 4 | 男 | 39 | √ | √ | √ | ||||
| 5 | 女 | 37 | √ | ||||||
| 6 | 女 | 55 | √ | √ | √ | ||||
| 7 | 女 | 60 | |||||||
| 8 | 女 | 60 | √ | ||||||
| 9 | 女 | 55 | √ | ||||||
| 10 | 女 | 78 | √ | √ | √ | ||||
| 11 | 男 | 56 | √ | ||||||
| 12 | 男 | 66 | √ | ||||||
| 13 | 女 | 73 | √ | √ | |||||
| 14 | 男 | 74 | √ | ||||||
| 15 | 女 | 51 | |||||||
| 16 | 男 | 59 | √ | ||||||
| 17 | 女 | 70 | √ | ||||||
| 18 | 男 | 76 | √ | ||||||
| 19 | 男 | 79 | √ | ||||||
| 20 | 男 | 65 | √ | ||||||
从症状上分析,5例患者有餐后腹胀、嗳气等消化不良症状,占25%;6例患者有反酸、烧心等胃食管反流病症状,占30%;2例患者有规律性餐后上腹痛症状,占10%;1例患者有恶心、呕吐症状,占5%;7例患者为无症状健康体检,占35%(表1)。
白光内镜下主要观察患者胃内背景黏膜、肿瘤发生部位、形态及色调改变情况。
20例患者中16例未发生胃黏膜萎缩,3例病例存在C-1型胃黏膜萎缩(3例在胃窦部位见到胃黏膜萎缩),1例病例存在C-3型胃黏膜萎缩,即19例患者肿瘤发生于无胃黏膜萎缩的胃底腺黏膜,1例患者肿瘤发生于萎缩的胃底腺黏膜。
分析肿瘤发生部位,有12例肿瘤发生于胃底的不同部位,占60%;8例肿瘤发生于胃体,其中胃体上部5例,占25%;胃体中部2例,占10%,胃体下部1例,占5%。
肿瘤的形态以圆形或类圆形为主,直径介于4~20mm不等,平均大小为7.6mm。10例肿瘤表现为红色调改变,7例病例表现为褪色调改变,3例病例未见明显色调改变。以巴黎分型区分肿瘤形态,1例为0-Ⅰs型,占5%;13例为0-Ⅱa型,占65%;4例为0-Ⅱb型,占20%;2例为0-Ⅱa+Ⅱc型,占10%(表2,图1)。
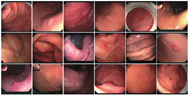

注:自左向右第一排病例编号为1、2、3、5、6、7;第二排病例编号为8、9、10、11、12、13;第三排病例编号为14、16、17、18、19、20。
胃底腺型胃癌白光内镜下表现
胃底腺型胃癌白光内镜下表现
| 病例编号 | 背景黏膜 | 部位 | 大小(mm) | 色调改变 | 形态(巴黎分型) |
|---|---|---|---|---|---|
| 1 | 慢性非萎缩性胃炎 | 胃底前壁近贲门 | 5 | 发红 | Ⅱb |
| 2 | 慢性非萎缩性胃炎 | 胃底大弯 | 6 | 发红 | Ⅱa |
| 3 | 慢性萎缩性胃炎C1级 | 胃体上部前壁 | 8 | 发红 | Ⅱa |
| 4 | 慢性非萎缩性胃炎 | 胃底穹隆 | 8 | 褪色 | Ⅱa |
| 5 | 慢性非萎缩性胃炎 | 胃体上部前壁 | 10 | 无色调改变 | Ⅱa |
| 6 | 慢性非萎缩性胃炎 | 胃体下部大弯 | 6 | 发红 | Ⅱa |
| 7 | 慢性非萎缩性胃炎 | 胃体上部小弯 | 10 | 褪色 | Ⅱb |
| 8 | 慢性非萎缩性胃炎 | 胃底穹隆 | 8 | 褪色 | Ⅱa |
| 9 | 慢性非萎缩性胃炎 | 胃底小弯 | 10 | 无色调改变 | Ⅱa+Ⅱc |
| 10 | 慢性非萎缩性胃炎 | 胃底小弯近贲门 | 6 | 无色调改变 | Ⅱa |
| 11 | 慢性非萎缩性胃炎 | 胃底小弯 | 8 | 发红 | Ⅱa |
| 12 | 慢性非萎缩性胃炎 | 胃体中部大弯 | 5 | 发红 | Ⅱb |
| 13 | 慢性非萎缩性胃炎 | 胃底后壁 | 20 | 发红 | Ⅱa+Ⅱc |
| 14 | 慢性萎缩性胃炎C3级 | 胃体上部小弯 | 5 | 发红 | Ⅰs |
| 15 | 慢性非萎缩性胃炎 | 胃底穹隆 | 4 | 褪色 | Ⅱa |
| 16 | 慢性萎缩性胃炎C1级 | 胃体中部前壁 | 10 | 褪色 | Ⅱb |
| 17 | 慢性非萎缩性胃炎 | 胃底小弯近贲门 | 6 | 褪色 | Ⅱa |
| 18 | 慢性非萎缩性胃炎 | 胃体上部后壁 | 10 | 发红 | Ⅱa |
| 19 | 慢性萎缩性胃炎C1级 | 胃底穹隆 | 6 | 发红 | Ⅱa |
| 20 | 慢性非萎缩性胃炎 | 胃底穹隆 | 8 | 褪色 | Ⅱa |
20例病例中共有10例完成了ME检查。微结构方面,与正常胃底腺比较,病变区域"黑点状"腺管开口消失,取而代之的是"类圆形""长条形""树枝状"等多形结构,在NBI下呈茶褐色改变。病变内"白区"异常鲜明,腺窝边缘上皮和窝间部增宽。尽管病变区域内腺管开口、腺窝边缘上皮及窝间部等微结构与正常胃底腺黏膜不一致,但病变区域内部微结构异形型较低(图2)。
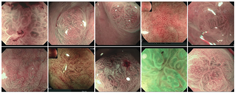

注:自左向右第一排病例编号为1、2、5、7、9;第二排病例编号为13、16、18、19、20。
微血管方面,NBI-ME下观察病变区域内沿"白区"分布的多边形毛细血管及集合静脉均消失,取而代之的是不规则的多形血管,并可见"分枝状"血管,微血管排列紊乱,异形型比较明显(图2)。
分析该类病例在ME下的共同点可以发现,病变区域内微血管及微结构与周围黏膜区分度较大,尽管部分病例的变化并非为"断崖式"分界,而呈渐进式变化,但仔细观察仍然可见分界线。
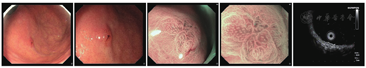
20例病例中有4例完成了超声内镜检查,与其他类型胃癌有相同之处,也有不同之处。GA-FG在超声下表现为低回声占位性病变,似起源于黏膜肌层,肿瘤浅层仍保留有较为完整的高回声黏膜层,病变主体向下生长,与黏膜下层分层欠清,固有肌层完整(图3)。
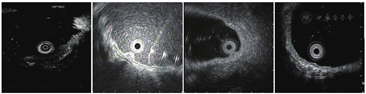

注:自左向右病例编号为1、2、5、20。
综合以上GA-FG内镜下表现,我们选取了第20号病例作为典型病例展示其白光内镜、ME及超声内镜结果(图4),并在后文继续展示内镜下治疗及术后病理。

20例病例中,有12例于我中心接受了ESD手术治疗,1例因合并严重心脏疾病暂缓治疗,7例未于我中心继续治疗而失访。接受ESD治疗的患者术前的腹盆腔增强CT均未见邻近器官转移或腹腔淋巴结转移。为保证完整切除病变,12例病例中,有5例发生不同程度固有肌层损伤,其中有1例胃底穹隆部病变在治疗中发生局部小穿孔,明显高于我中心整体胃ESD手术平均水平。所有创面均于内镜下成功封闭,未发生术后迟发出血或穿孔等并发症。术后病理证实,水平及基底切缘均为阴性,脉管未见侵犯,无需追加外科手术。
HE染色可见病变浅层有小凹上皮分布,深层可见不规则的、相互融合的腺体,且病变向深层延伸,突破黏膜肌层向下生长(图5)。17例病例完成了免疫组织化学染色,分别染色了代表分化为颈黏液细胞的Mucin-6、评估黏膜肌层侵犯的Desmin以及判断具体分型的Pepsinogen、H/K-ATPase(图6),部分病例还评估了增殖指数Ki-67及P53突变(图7)。


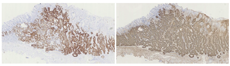

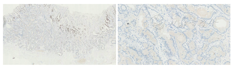

首先看分化情况,所有病例均有向颈黏液细胞分化的情况,其中7例有向小凹上皮分化的趋势。代表主细胞的Pepsinogen在所有病例中均为阳性,H/K-ATPase在4例病例中为阳性。该结果提示13例为主细胞型GA-FG,占76.5%;另外4例为混合细胞型GA-FG,占23.5%,未发现壁细胞型GA-FG。有15例病例完成了Ki-67染色,增殖水平均偏低。8例病例完成了P53突变染色,均为野生型(表3)。
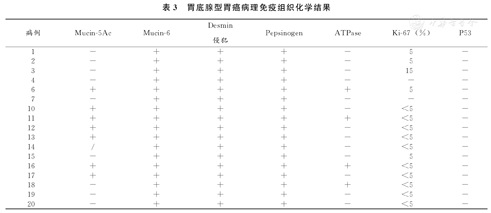
胃底腺型胃癌病理免疫组织化学结果
胃底腺型胃癌病理免疫组织化学结果
| 病例 | Mucin-5Ac | Mucin-6 | Desmin侵犯 | Pepsinogen | ATPase | Ki-67(%) | P53 |
|---|---|---|---|---|---|---|---|
| 1 | - | + | + | + | - | 5 | - |
| 2 | - | + | + | + | - | 5 | - |
| 3 | - | + | + | + | - | 15 | - |
| 4 | - | + | + | + | - | - | - |
| 6 | + | + | + | + | + | 5 | - |
| 7 | - | + | + | + | - | - | - |
| 10 | + | + | + | + | - | <5 | - |
| 11 | + | + | + | + | + | <5 | - |
| 12 | + | + | + | + | - | <5 | - |
| 13 | + | + | + | + | - | <5 | - |
| 14 | / | + | + | + | - | <5 | - |
| 15 | - | + | + | + | - | 5 | - |
| 16 | + | + | + | + | + | <5 | - |
| 17 | + | + | + | + | - | <5 | - |
| 18 | - | + | + | + | + | <5 | - |
| 19 | - | + | + | + | - | <5 | - |
| 20 | - | + | + | + | - | <5 | - |
发病人群方面,男女均有发病,其中女性略高于男性,男性和女性的比例为1∶1.2,相比较于日本学者研究结果有所不同,日本男性发病率高于女性,男性和女性的比例为(4~5.5)∶1[4,5]。发病年龄方面,以中老年人群为主,青年亦有发病,平均年龄为59岁,与国外研究结果基本一致。临床表现方面,35%的患者为无症状体检时偶然发现;30%的患者有反酸、烧心等胃食管反流病症状;25%的患者表现为腹胀、嗳气等消化不良症状;10%的患者表现为规律上腹痛的溃疡症状。因此,该型胃癌在早期与其他类型胃早癌相似,缺乏特异性临床表现。
内镜方面,首先总结肿瘤的发生部位,所有病变均发生于胃底及胃体中上部,且除1例病例以外,其他病例背景黏膜均未发生萎缩,该结论与国外研究一致[4,5,6],该结论也进一步提示,该型胃癌分化于正常的胃底腺。有1例特殊病例发生于胃体小弯的萎缩黏膜之上,我们推测该病例在黏膜发生萎缩之前即有胃底腺的恶变,随后在幽门螺杆菌或胆汁刺激下,背景黏膜发生了萎缩,但因患者缺少此前胃镜数据,无法进一步考证。肿瘤形态方面,多数肿瘤表现为0-Ⅱa型及0-Ⅱb型,未见Ⅱc型。0-Ⅱa型易与胃底腺息肉或淋巴瘤混淆,0-Ⅱb型易漏诊,需要通过仔细观察黏膜色调改变加以识别。同时,该型胃癌体积偏小,平均只有7.6mm,更增加了发现病变的难度。因此,内镜医生在做胃镜时,如在无萎缩的胃底体发现隆起或色调改变需尤其注意鉴别。ME下,该型胃癌缺乏典型"断崖式"分界线表现,而是渐进式由正常胃底腺黏膜逐渐过渡至腺管开口消失、白区异常鲜明以及血管异形型明显的病变区域。该型胃癌于超声内镜下表现为主体位于黏膜肌层的低回声占位,肿瘤的深层截面横径大于浅层截面横径,黏膜层高回声似乎完整未中断,肿瘤向深层浸润突破黏膜肌层,与黏膜下层边界欠清,因此在超声内镜下极易与胃神经内分泌肿瘤、胃间质瘤等黏膜下肿瘤混淆。总结GA-FG与胃神经内分泌肿瘤等黏膜下肿瘤在内镜下的主要鉴别点是:①白光内镜下,肿瘤表面黏膜常有色调或形态改变;②超声内镜下,肿瘤深层横径常大于浅层横径,且与黏膜肌层、黏膜下层分层不清。
病理方面,根据组成细胞不同,该型胃癌可进一步分为3种亚型:主细胞型、壁细胞型和混合细胞型,其中绝大多数属于主细胞型。根据病理表现推测其生长方式,肿瘤起源于黏膜层,病变浅层可见小凹上皮分布,未见肿瘤突破浅层黏膜向外生长表现,与超声内镜下表现为黏膜层完整相一致;而深层可见不规则的、相互融合的腺体,病变向下生长突破黏膜肌层侵犯黏膜下层,该结论与国外报道病例特点一致[7]。这与常见的乳头状腺癌、管状腺癌等胃癌向胃腔内生长的特点完全不同,GA-FG的生长特点在一定程度上增加了内镜诊断的难度。所有病例的Ki-67表达偏低,且均未发现P53突变,提示该型胃癌恶性度较低,生长缓慢。因此,与常见胃癌的快速生长和早期转移特点不同,GA-FG从早期癌到进展期癌可能经历一个较长的病程。但尽管如此,临床医生不能轻视该型胃癌,国外有报道进展期GA-FG的病例[8,9],早期诊断与患者预后关系密切。
治疗上,绝大部分肿瘤可行ESD手术完整切除,不需追加外科手术或放化疗。但因其向深层浸润的特点,剥离过程中容易损伤固有肌层,尤其是发生于胃底穹隆部的病变,需要由具备一定ESD实践经验的医生实施。部分患者术后长期于我中心随诊,截至目前尚未发现复发或转移,预后良好。
以上是对我中心所发现的20例GA-FG的总结归纳,希望对消化内镜医生有一定帮助。后续我们将重点关注该型胃癌的内镜和病理的一致性研究,联合病理医生共同理解GA-FG的内镜下表现,为内镜医生更好地识别该型胃癌提供依据。



























