
本研究应用磁共振T2-mapping软骨定量成像技术评估发散式体外冲击波疗法(radial extracorporeal shock wave therapy,rESWT)对膝骨关节炎(knee osteoarthritis,KOA)患者关节软骨损伤的影响,并通过视觉模拟评分法(Visual Analogue Score,VAS)评分,以及西安大略和麦克马斯特大学骨关节炎指数(The Western Ontario and McMaster Universities,WOMAC)评分评估rESWT对患者疼痛和关节功能的改善情况。
69例KOA患者被随机分为试验组(n=36)和对照组(n=33),试验组应用rESWT治疗患膝疼痛及软骨损伤区域(1次/5d,3次为1个疗程,共治疗2个疗程),对照组口服塞来昔布胶囊(200mg/次,q.d.,连服5d后停药5d为1个疗程,共用药3个疗程)。应用T2-mapping软骨成像技术分别获取治疗前及治疗后12周两组患者膝关节不同软骨分区的T2-mapping值,对软骨损伤的修复程度进行量化比较;同时采集两组患者治疗前、治疗结束后第1天、4周、12周时的VAS评分和WOMAC评分比较两组的疗效差异,记录治疗及随访期间可能出现的不良反应。
在所有软骨分区中,治疗后12周试验组胫骨平台前区的软骨T2-mapping值较治疗前显著下降(P<0.05),其余分区的T2-mapping值与治疗前相比无显著性差异(P>0.05);治疗后12周试验组与对照组T2-mapping值无显著性差异(P>0.05)。同时两组患者在治疗后各随访时间的VAS和WOMAC评分较治疗前均有所改善(P<0.05),在治疗后第1天和4周时试验组VAS和WOMAC评分均明显优于对照组(P<0.05),在治疗后12周时,两组间比较差异无显著性差异(P>0.05)。在治疗过程中两组均未出现严重不良反应,发生频次的比较无明显差异(P>0.05)。
磁共振T2-mapping软骨定量成像技术可用于评估rESWT治疗KOA胫骨平台的软骨损伤变化,同时rESWT能有效缓解KOA患者膝痛症状,促进关节功能的恢复。

本刊版权归人民卫生出版社有限公司所有。任何机构或个人欲转发本刊图文,请与本刊联系。凡未经授权而转载、摘编本刊文章者,本刊将保留追究其法律责任的权利。
膝骨关节炎(knee osteoarthritis,KOA)是一种是以软骨破坏、软骨下骨质硬化及骨赘增生为主要特征的慢性疾病[1,2,3]。研究显示KOA的患病率目前正呈现出逐年上升的趋势[4,5],因此尽早对疾病其进行及时有效的治疗干预尤为关键。关节软骨的损伤及退变是OA发病典型的病理特征[3,6],相关研究报道显示,磁共振T2-mapping成像技术可通过测量T2弛豫时间对关节软骨内组织成分的变化进行定量分析,根据观察T2-mapping生成的伪彩图中不同色阶的颜色变化来区分正常与异常的软骨区域[7,8,9],从而更加直观地分辨软骨损伤的区域及面积,有助于发现关节软骨损伤及退变状况,对于评价软骨损伤的修复具有一定的指导作用。
发散式体外冲击波疗法(radial extracorporeal shock wave therapy,rESWT)作为一种无创性的物理治疗方法,具有作用直接、组织损伤小、疗效显著等治疗优势,现已广泛应用于肌骨疾病的临床治疗[10,11,12,13]。与此同时相关的基础与临床研究也已证实ESW可延缓OA退变,推迟疾病的进展[14,15,16]。然而目前rESWT对于KOA患者关节软骨影响及其评价方法的临床研究很少[17,18],本研究运用rESWT干预KOA患者,通过磁共振T2-mapping值的变化情况分析rESWT对关节软骨的影响,同时应用视觉模拟评分法(Visual Analogue Score,VAS)、西安大略和麦克马斯特大学骨关节炎指数(Western Ontario and McMaster Universities,WOMAC)评分对患者的疼痛及膝关节活动功能的临床疗效进行评估,总体评价rESWT治疗KOA患者的有效性和安全性。
选取2020年6月至2021年3月就诊于解放军总医院第三医学中心骨科的69例KOA患者。根据随机数字表产生随机序列,患者被随机分入治疗组(n=36)和对照组(n=33)。治疗组中男7例,女29例;年龄42~67岁,平均年龄(57.26±12.37)岁;病程7~49个月,平均病程(32.7±13.8)个月;病变部位:左侧12例,右侧24例,平均体质指数(body mass index,BMI)(25.8±2.4)kg/m2。对照组中男5例,女28例;年龄44~71岁,平均年龄(55.14±10.64)岁;病程9~43个月,平均病程(34.8±12.2)个月;病变部位:左侧10例,右侧23例,平均BMI(25.5±2.8)kg/m2。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。两组患者均以下肢肌力锻炼为基础治疗方案,在此基础上试验组进行体外冲击波治疗,对照组口服塞来昔布治疗。本临床试验已通过我院伦理委员会批准(批准号:Z181100001718018)。
参照中华医学会骨科学分会关于骨关节炎诊治指南(2007版)所制定的KOA的诊断标准[19],如下:①近1个月内反复出现膝关节疼痛;②X线片(站立或负重位)示关节间隙变窄、软骨下骨硬化和/或囊性变、关节缘骨赘形成;③关节液(至少2次)清亮、黏稠,白细胞计数低于2000个/ml;④中老年患者(≥40岁);⑤晨僵≤30 min;⑥活动时有骨摩擦音(感)。注:综合临床、实验室及X线检查,符合①+②条或①+③+⑤+⑥条或①+④+⑤+⑥条,则可诊断KOA。
纳入标准:①符合KOA诊断标准;②年龄40~75岁;③受试者知情同意,并签署相关文件;④受试者能严格遵照医嘱,并能如期接受随访。排除标准:①X线影像学表现为Kellgren-Lawrence分级Ⅳ级,关节间隙明显变窄,软骨下骨硬化的患者;②既往病变膝关节接受过关节镜手术、开放性手术;③继发性膝关节KOA患者,如膝关节急慢性感染、肿瘤、结核、血液性、创伤性疾病所导致;④膝关节严重畸形,膝内翻>10°、膝外翻>20°及关节间隙完全消失不适合保守治疗的患者;⑤患有严重的原发性心血管病变、肺脏疾病、代谢性疾病、内分泌疾病及凝血机制异常或其他影响生存的严重疾病;⑥近3个月接受过对乙酰氨基酚、软骨营养药、关节腔类注射药及其他相关治疗;⑦不能配合磁共振成像(magnetic resonance imaging,MRI)检查及有MRI检查禁忌证者;⑧有体外冲击波治疗禁忌证者;⑨孕妇或哺乳期妇女;⑩存在使用塞来昔布胶囊严重不良反应和禁忌证的患者。
治疗方案参照美国骨科医师协会推荐的循证医学治疗指南[20],主要包括下肢肌肉静态及动态训练、低强度有氧运动及神经肌肉训练等系统性运动康复治疗方案,每日3组训练,每组10次,连续训练30d。
对照组配合口服非甾体抗炎药塞来昔布胶囊[21],200mg/次,连服5d后停药5d,为1个疗程,共用药3个疗程。
对试验组患者使用发散式冲击波治疗仪(瑞士EMS,Swiss Dolor Clast)进行治疗。治疗前参考MRI检查结果,先在患膝上标记痛点及其对应的可能存在软骨损伤的部位为治疗部位,然后将膝关节置于合适的体位,使治疗部位能最大限度地暴露于ESW治疗区域。当软骨损伤位于膝关节内、外侧间室及髌股关节面,分别调整冲击波探头角度,对准关节相应侧的间室,结合MRI影像,找到相应痛点及软骨损伤部位;而当损伤部位位于股骨内、外侧髁后侧时,则将探头对准内、外侧膝眼,结合MRI影像找到软骨损伤区域,避开周围重要的神经及血管,最大限度地使ESW直接作用于损伤区域。在治疗同时可根据患者的主诉将ESW作用于膝关节周围疼痛的肌群部位以解除膝周的肌肉痉挛[28],包括膝关节屈伸活动和周围肌肉、肌腱、韧带被动牵拉时或按压时的痛点。设置冲击频率为6~8Hz,根据患者的疼痛耐受程度调节治疗能量为1.5~2.5bar,每次治疗选择2~3个治疗点,每个点冲击2 000次,共冲击4 000~6 000次,5d治疗1次,3次为1个疗程,每例患者连续治疗2个疗程。每次治疗过程中不使用任何麻醉药物和镇静剂。同时观察患者可能出现的任何不良反应,操作完成后嘱患者膝关节制动休息10min,半小时无异常不适后可离开治疗室。
使用GE公司Optima MR 360 1.5T超导型磁共振成像仪,通过T2-mapping软骨成像技术获取两组的关节软骨T2-mapping伪彩图,在治疗前及治疗后12周(±7d)对所有患者进行膝关节磁共振T2-mapping序列扫描,扫描序列包括T1WI及T2-mapping。扫描参数:TR为1 200.00ms,TE范围在8.7~69.8ms,层厚3mm,层距1mm,层数设置为19,视野17cm×17cm,矩阵256×256,NEX 1.00,扫描时间12min。扫描结束后将T2-mapping图像传输到GE ADW 4.6工作站,使用Functool中的T2-mapping后处理软件并生成膝关节软骨的T2-mapping伪彩图。选用矢状位T1WI或PDWI(具体视扫描时而定)作为参考图匹配伪彩图,调节层面参照Mosher等[22]标注。图像由3位核磁科经验丰富的副高级以上(含副高级)医师独立完成图像阅片,遇到有争议的,协商讨论达成共识,通过膝关节MRI的T2-mapping值的变化来评估软骨损伤修复情况。软骨分区参照膝关节骨性关节炎全器官磁共振成像评分(Whole-Organ Magnetic Resonance Imaging Score,WORMS)[23],在MRI矢状T2-mapping序列图像上,对膝关节软骨划分为以下亚区:股骨内、外侧髁软骨中区和后区(MFc、MFp、LFc、LFp),胫骨内、外侧平台软骨前、中、后区(MTa、MTc、MTp、LTa、LTc、LTp),髌软骨区(PAT)及滑车软骨区(TRO),以相似大小的ROI对每个亚区进行测量,连续测量3次,取其均值,每个ROI的范围均需≥2mm2,以避免由于ROI太小造成的测量误差,观察并比较各亚区T2值的变化。测量膝关节各软骨分区的T2-mapping值,统计治疗前及治疗后12周(±7d)膝关节磁共振T2-mapping值。
患者治疗及随访期间所测量的数据均以病例报告表方式记录并规范填写。其中包括治疗前基线特征以及KOA X线Kellgren-Lawrence分级[24]。根据不同分组,分别记录每组各种局部及全身的不良反应。对不良事件的观察从开始治疗至随访结束后2周持续跟踪纳入患者。
应用SPSS 25.0软件进行统计学处理。计量资料服从正态分布且方差齐的数据采用均数±标准差(standard deviation)表示,组间比较和组内治疗前后比较分别采用独立样本t检验和配对样本t检验;计数资料以频数、构成比或百分比描述,组间比较采用卡方检验,疗效评价使用意向性治疗分析法(intent to treat,ITT分析)。对计量资料缺失值的处理采用记录最后一次观察值结转方法(LOCF)。所有统计检验均采用双侧检验,以P<0.05为差异具有统计学意义。
本研究按照纳入、排除标准筛选后共有69例患者入组,其中试验组36例,失访3例,对照组33例,失访2例,采用ITT分析对治疗后的疗效指标进行评价。
两组受试者在年龄、性别、病程、BMI、膝关节X线Kellgren-Lawrence分级等基线资料方面均没有差别(P<0.05),具有可比性(表1)。
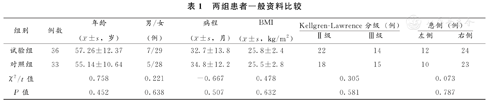
两组患者一般资料比较
两组患者一般资料比较
| 组别 | 例数 | 年龄( ±s,岁) ±s,岁) | 男/女(例) | 病程( ±s,月) ±s,月) | BMI( ±s,kg/m2) ±s,kg/m2) | Kellgren-Lawrence分级(例) | 患侧(例) | ||
|---|---|---|---|---|---|---|---|---|---|
| Ⅱ级 | Ⅲ级 | 左侧 | 右侧 | ||||||
| 试验组 | 36 | 57.26±12.37 | 7/29 | 32.7±13.8 | 25.8±2.4 | 22 | 14 | 12 | 24 |
| 对照组 | 33 | 55.14±10.64 | 5/28 | 34.8±12.2 | 25.5±2.8 | 18 | 15 | 10 | 23 |
| χ2/t值 | 0.758 | 0.221 | -0.667 | 0.478 | 0.305 | 0.073 | |||
| P值 | 0.452 | 0.638 | 0.507 | 0.632 | 0.581 | 0.787 | |||
注:BMI,体质指数。
组内比较:两组的VAS和WOMAC评分在治疗前、后各随访时间点比较差异均有统计学意义(P<0.05)。组间比较:两组的VAS和WOMAC评分治疗后第1天和4周时,治疗组下降较对照组更显著,差异有统计学意义(P<0.05);治疗后12周时,与对照组相比,治疗组的VAS评分及WOMAC评分有所改善,但是两组间比较差异无统计学意义(P>0.05),见图1、图2。
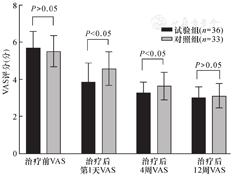

注:VAS,视觉模拟评分法。
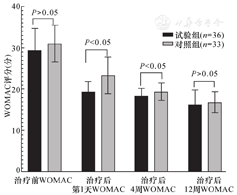

注:WOMAC,西安大略和麦克马斯特大学骨关节炎指数。
试验组治疗后胫骨内侧平台前区(MTa)的T2-mapping值较治疗前显著下降,差异具有统计学意义(P<0.05),其余各区治疗前后T2-mapping值均无显著变化(P>0.05);对照组治疗前后各区T2-mapping值均无显著变化(P>0.05)(表2)。
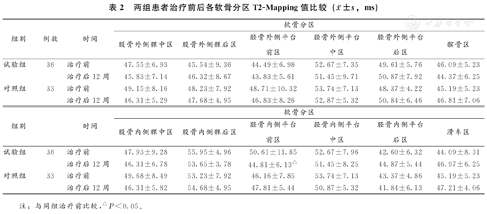
两组患者治疗前后各软骨分区T2-Mapping值比较( ±s,ms)
±s,ms)
两组患者治疗前后各软骨分区T2-Mapping值比较( ±s,ms)
±s,ms)
| 组别 | 例数 | 时间 | 软骨分区 | |||||
|---|---|---|---|---|---|---|---|---|
| 股骨外侧髁中区 | 股骨外侧髁后区 | 胫骨外侧平台前区 | 胫骨外侧平台中区 | 胫骨外侧平台后区 | 髌骨区 | |||
| 试验组 | 36 | 治疗前 | 47.55±6.93 | 45.54±9.36 | 44.49±6.98 | 52.67±7.35 | 49.61±5.76 | 46.09±5.23 |
| 治疗后12周 | 45.83±7.14 | 46.32±8.67 | 43.83±5.61 | 51.45±9.71 | 50.87±7.92 | 44.37±6.25 | ||
| 对照组 | 33 | 治疗前 | 49.15±8.16 | 48.23±7.92 | 48.71±10.32 | 53.74±7.13 | 48.37±4.22 | 45.19±5.23 |
| 治疗后12周 | 46.31±5.29 | 47.68±4.95 | 46.83±8.26 | 52.87±5.32 | 50.84±6.46 | 46.81±7.06 | ||
| 组别 | 时间 | 软骨分区 | ||||||
|---|---|---|---|---|---|---|---|---|
| 股骨内侧髁中区 | 股骨内侧髁后区 | 胫骨内侧平台前区 | 胫骨内侧平台中区 | 胫骨内侧平台后区 | 滑车区 | |||
| 试验组 | 36 | 治疗前 | 47.93±9.28 | 55.95±4.96 | 50.61±11.85 | 52.67±7.96 | 42.60±6.32 | 44.09±8.31 |
| 治疗后12周 | 46.31±6.78 | 53.65±3.78 | 44.81±6.13△ | 51.45±8.25 | 44.87±5.44 | 46.97±6.25 | ||
| 对照组 | 33 | 治疗前 | 49.68±8.49 | 53.23±7.92 | 46.16±7.85 | 53.74±7.13 | 43.37±4.86 | 45.19±5.23 |
| 治疗后12周 | 46.31±5.82 | 54.68±4.95 | 47.81±5.44 | 50.87±5.32 | 41.84±6.13 | 47.21±4.06 | ||
注:与同组治疗前比较,△P<0.05。
本次临床研究中,两组均未出现呼吸、脉搏、心率、血压等生理指标的异常变化及严重不良反应。治疗过程中试验组有2例患者出现局部治疗点疼痛及皮肤红肿;对照组中3例出现胃肠道不适症状。出现上述情况后均暂停治疗并详细询问病史,排除发现无其他特殊诱因后,征求患者同意后继续参与试验,经后续随访其不适症状均在第12周前自行消退。两组不良反应发生率的差异无显著差异(χ2=0.010,P>0.05),见表3。
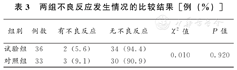
两组不良反应发生情况的比较结果[例(%)]
两组不良反应发生情况的比较结果[例(%)]
| 组别 | 例数 | 有不良反应 | 无不良反应 | χ2值 | P值 |
|---|---|---|---|---|---|
| 试验组 | 36 | 2(5.6) | 34(94.4) | 0.010 | 0.920 |
| 对照组 | 33 | 3(9.1) | 30(90.9) |
KOA的主要症状包括疼痛、关节活动受限及肌肉功能下降,从而影响生活质量[5]。目前临床上KOA的治疗方法众多,其治疗主要目的在于缓解关节的疼痛症状、提高生活质量,并推迟疾病进展[2,3,4]。我国最新版骨关节炎的诊疗指南对于OA疾病提出了个体化和阶梯化的治疗原则[27],使不同疾病阶段的OA患者均可结合自身病情接受有针对性的治疗。ESWT契合最新版骨肌疾病体外冲击波疗法指南的治疗原则[28,29],根据患者的病情特点进行靶向治疗,从而缓解疼痛,改善肌肉功能。
本研究治疗后中两组患者的VAS评分及WOMAC评分在各随访时间点比较差异均具有统计学意义(P<0.05),说明两种治疗方法联合下肢肌力训练的辅助治疗对于KOA治疗均有效。与此同时试验组在ESW治疗后第1天和4周时,膝关节VAS评分及WOMAC评分与对照组相比下降更为显著,表明就控制疼痛及恢复膝关节功能活动而言,ESWT能够快速有效地减轻疼痛,改善膝关节的活动及功能。在随访12周时,VAS评分及WOMAC评分较治疗前均有所下降,但组间比较无显著差异,可说明就改善疼痛与提高日常生活质量的短期疗效而言,rESWT具有同西药相似的镇痛疗效,经治疗后两组患者的疼痛症状及功能活动均得到一定程度的改善,这与此前的研究结果一致[17,18]。Chen等[30]对KOA患者分别进行ESWT和超声波治疗,结果显示ESWT组患者疼痛缓解明显,VAS及Lequesne指数评分下降,膝关节活动范围明显增加。Ho等[31]将36例KOA患者随机分为ESWT组和假ESWT组,同时两组均接受常规物理治疗,结果显示ESWT组在VAS评分、WOMAC评分及6分钟步行距离测试的改善方面均优于假ESWT组。赵喆等[32]将70例KOA患者随机分为ESWT组和对照组,对ESWT组患膝周围触发点或髌股和胫股关节边界处进行ESW治疗,干预后12周WOMAC和Lequesne指数评分均显著下降。目前多项研究证实ESW治疗KOA后,不论短期还是长期随访的疗效,在VAS评分、WOMAC评分上均有明显改善[17,33,34,35]。而就改善OA的疼痛而言,既往研究表明,ESW作为一种有效的生物力学刺激可发挥机械传导作用,通过抑制从背根神经节到膝关节的P物质阳性神经纤维和膝关节周围的降钙素基因相关肽从而减轻疼痛,改善膝关节的活动功能[11,17,37]。
近年来研究发现,ESW对于KOA的治疗作用还体现在松解肌肉组织的粘连、改善肌肉的代谢及促进肌肉功能的恢复[12,36]。Mattyasovszky等[38]通过体外研究首次发现,适度的能流密度(energy flow density,EFD)下rESWT有助于提高肌卫星细胞的标志蛋白Pax7以及肌细胞标志物NCAM、MyoD和Myf5的基因表达,从而增强骨骼肌细胞的活性。Kisch等[39]将低强度ESW的能量分别设定为0.981J和1.635J两种模式,并对肌肉干细胞和其他肌细胞进行干预,发现ESW可增强骨骼肌细胞的活性,促进肌肉的再生。此外,应用ESWT可以对神经肌肉的传导产生影响,延缓神经肌肉接头(neuromuscular junction,NMJ)的传导,降低复合肌肉动作电位,从而改善肌张力障碍和肌肉痉挛[40]。
目前临床上对于早及中期KOA的诊断主要依赖于普通X线平片[24,41],其影像学特征主要为关节间隙狭窄或消失、骨赘形成等骨性结构的改变,而对内在的软骨损伤、软骨下骨增厚、关节面磨损及骨髓水肿等典型病理特征则需要通过MRI进行诊断与评估[6]。在MRI软骨定量成像技术中,T2-mapping技术可通过测量不同软骨区域T2值以反映其结构成分的变化,从而进一步发现关节软骨损伤及退变的程度,成为目前研究最为广泛的评估关节软骨修复程度的无创性MRI检测手段[42]。本研究的软骨分区参照WORMS评分[23],在MRI矢状T2-mapping序列图像上,对膝关节软骨划分为12个亚区,结果显示,ESW治疗后在所有关节软骨的分区中仅胫骨平台前区的软骨值较治疗组显著下降,表明ESW对于此区域具有一定的软骨保护作用,这与此前的研究结果一致[15,43]。Wang等[44]运用ESW干预大鼠KOA模型观察膝关节不同部位关节软骨及软骨下骨的病理变化,结果发现ESW在胫骨内侧髁的软骨区域产生的软骨保护作用最强。对于本次研究ESW治疗后胫骨平台前区软骨值的改变,分析其可能原因,就膝关节所承受的生物力学的负重位置而言,胫骨前区和中区等亚区是膝关节的主要承重区,ESW治疗KOA时,能量可通过ESW治疗头及耦合剂分别从相应的治疗侧间室递送至关节腔内而到达对应的关节软骨区域,相较于其他位置,胫股内侧关节间室对应的体表皮肤及皮下组织相对表浅,治疗过程中在合适的体位下ESW易于穿透此区域从而使ESWT的能量最大限度地直接作用于软骨损伤区域,发挥其修复关节软骨的生物学机制,因而内侧胫骨平台前区的T2-mapping值在ESW治疗后显示出下降的趋势。此外,ESW对于不同软骨损伤区的改善可能存在敏感性的强弱不同[44],某些分区高度敏感,而其余区域则敏感性较差,因而会出现一处软骨亚区T2-mapping值的改变不一,从这个角度而言在此基础上下一步可开展ESWT对KOA患者不同软骨分区的具体位置的敏感性研究。本次结果虽未对所有的软骨分区产生改变,也可间接证实ESWT干预对于膝关节软骨的安全性。与此同时,在现有研究结果的基础上,本研究还可继续深入探讨ESWT作用于关节软骨的最佳EFD、治疗的时间节点以及治疗目标区域的定位方法。
综上所述,在磁共振软骨定量成像技术T2-mapping可应用于rESWT对KOA患者膝关节胫骨平台软骨损伤的评价,同时rESWT能够有效改善患者膝痛症状,促进关节功能的恢复,其临床疗效确切、安全可靠。



























