
血小板参与生理性止血和病理性血栓形成过程。血小板在肿瘤发生发展过程中也扮演了重要角色,基于此,通过对血小板的功能进行调控,可以实现肿瘤治疗的目的。但血小板的全身性抑制势必会给患者带来严重的出血风险,开发血小板的靶向调控策略尤为重要。本文将围绕血小板在肿瘤进展过程中的重要功能,总结靶向调控血小板的智能纳米药物用于肿瘤治疗的最新进展,为以血小板为靶点的抗肿瘤治疗策略提供参考,并对该领域的未来发展做出展望。

本刊版权归人民卫生出版社有限公司所有。任何机构或个人欲转发本刊图文,请与本刊联系。凡未经授权而转载、摘编本刊文章者,本刊将保留追究其法律责任的权利。
血小板是由骨髓造血组织中的成熟巨核细胞胞浆裂解脱落形成的无核血液细胞成分。血小板呈直径为2~4μm的圆盘状,血液循环寿命为7~14d,维持在(10~30)万/ml的数量。血小板的主要生理功能是凝血和止血,同时也参与血管的营养和修复[1]。当机体由于内源或者外源因素导致血管破损时,血小板通过黏附、激活和聚集等过程实现凝血和止血功能。可以说,血小板是机体血管系统的"巡逻卫士",维持着机体正常的血液循环。
此外,在某些病理条件下,血管内壁破损暴露内皮下的组织因子和胶原,从而启动凝血瀑布反应。在这个过程中,血小板被异常激活、黏附和聚集在血管破损部位,进而诱导血栓的初步形成[2]。随后,血小板通过表面活化的受体如:GPⅡb/Ⅲa受体、凝血酶受体、血栓素受体等,借助纤维蛋白原进一步聚集更多的血小板,促进病理血栓的形成。当血栓发展到一定程度,会对组织器官的供血产生影响,最终发展成为血栓性疾病,如:心肌梗死、缺血性脑卒中、肺栓塞和静脉血栓等[3]。因此,基于血小板参与病理血栓形成过程,临床上开发了多种抗血小板药物用于血栓疾病的预防和治疗,如:环氧酶抑制剂(阿司匹林)、P2Y12受体抑制剂(噻氯匹定、氯吡格雷、普拉格雷、替格瑞洛)、GPⅡb/Ⅲa受体抑制剂(阿昔单抗、依替巴肽、替罗非班)、蛋白酶活化受体-1拮抗剂(沃拉帕沙)等[4]。
血小板除了在以上描述的生理性止血和病理性血栓形成过程中发挥重要功能外,大量的研究也表明,血小板在肿瘤发生发展及转移过程中也发挥了至关重要的作用,如:血小板参与瘤内血栓的形成[5,6]、血小板维持肿瘤血管的完整性[7]、血小板与肿瘤细胞发生广泛的受体配体相互作用[8]、血小板促进肿瘤细胞转移[9]等。因此,深入了解血小板在肿瘤发生发展过程中的重要功能,可以为肿瘤治疗提供新的治疗靶点和治疗思路。同时,我们需要意识到,血小板是机体凝血和止血的主要参与者,过度抑制血小板的功能会给患者带来严重的出血并发症。
在临床上,血栓的形成是恶性肿瘤常见的表现之一[10]。肿瘤细胞可以通过直接或间接的机制诱导血小板活化与聚集从而引起血栓的形成,这种现象被称为肿瘤细胞诱导的血小板聚集(tumor cell induced platelet aggregation,TCIPA),且各癌种都有发生瘤内血栓的风险[11]。肿瘤细胞可分泌凝血酶、ADP、血栓素A2或组织因子等血小板活化介质,或通过诱发中性粒细胞外陷阱刺激血小板活化,过程中涉及一系列复杂的分子机制[12,13]。当肿瘤血管中的血小板被活化后,它们将发生微聚集,并与纤维蛋白原、红细胞等相结合,促进微血栓的形成。瘤内血栓将参与肿瘤的转移,严重影响患者的预后。
血小板膜表面上存在多种蛋白受体,包括跨膜蛋白、免疫调节蛋白和整合素等[14]。血小板可通过不同功能的膜蛋白与肿瘤细胞发生相互作用,参与肿瘤进展的多种生理病理过程,其对肿瘤细胞具有天然亲和力和靶向性[8,15]。二者之间的相互作用是通过介导黏附和聚集的血小板受体与配体来完成的,例如整合素α6β1和αⅡbβ3、GPⅡb/Ⅲa受体及P-选择素等[13,16]。这些相互作用在促进肿瘤生长与迁移、协助肿瘤细胞实现免疫逃逸等方面发挥重要作用,可将其作为肿瘤治疗的靶点。
血小板可通过多种机制促进肿瘤细胞的血行转移[17]。在原发灶中,血小板分泌转化生长因子(transforming growth factor,TGF)-β等刺激肿瘤细胞发生上皮间质转化,使其获得侵袭能力,可从原发部位脱离而进入血液循环。循环肿瘤细胞(circulating tumor cells,CTCs)在血液中迁移时,血小板可黏附在CTCs表面,使其免受自然杀伤细胞的免疫攻击;通过形成癌栓,也可以降低CTCs所受血流剪切力的机械损伤[18]。当存活的肿瘤细胞顺利到达转移灶时,血小板可以分泌趋化因子,辅助其在远端组织进行定植[9]。
血小板在维持肿瘤血管的稳态调节中发挥重要作用,可防止肿瘤内出血,调控血管通透性[19,20]。肿瘤相关血小板可通过分泌5-羟色胺、血小板第四因子、TGF-β等颗粒内容物或黏附诱导血管破裂的中性粒细胞来维持肿瘤血管内皮的完整性[21]。此外,血小板也可通过表面的GPVI受体,结合到破损血管内皮下的胶原成分,来维持肿瘤血管的完整性[17,22]。
结合纳米载体的特殊药物代谢动力学属性及靶向药物递送的功能,我们团队提出了用于局部血小板功能调控的智能纳米药物的设想,例如通过肿瘤局部激活血小板诱导血栓形成,实现肿瘤栓塞治疗、靶向抑制血小板功能,增加肿瘤血栓通透性和实现肿瘤转移预防、肿瘤靶向药物递送系统开发等。这些探索为肿瘤治疗提供了新的思路,在抗肿瘤联合治疗领域具有广阔的应用前景。
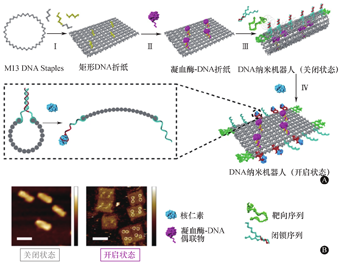
肿瘤细胞的快速增殖决定了其对血液和营养供应具有高度依赖性。因此,切断肿瘤营养供应成为肿瘤治疗的有效策略。临床上,肿瘤新生血管抑制剂的成功应用,已经证明了该策略的优势。我们设想,如果血栓形成于肿瘤血管内时,将会阻塞血流供应,切断外界向肿瘤输送氧气和营养物质的主要通道,以此诱导肿瘤组织坏死。基于此设想,课题组在前期工作中通过DNA折纸技术构建了智能DNA纳米机器人系统,对本来不能成药的凝血酶进行有效递送,并以肿瘤血管内皮细胞高表达的核仁素作为促发凝血酶暴露的信号分子,实现对肿瘤血管特异性栓塞,达到靶向栓塞肿瘤血管、饿死肿瘤细胞的目的(图1)[23]。DNA纳米机器人到达肿瘤血管后,会被肿瘤血管标志物核仁素触发"开关"暴露凝血酶。肿瘤局部暴露的凝血酶可以招募血小板并使其活化,同时将纤维蛋白原转化为纤维蛋白,它们相互聚集将会诱导血栓的形成。本研究可在短时间内诱导大量肿瘤细胞死亡,不会导致肿瘤细胞耐药的产生。但是,实现过程中,我们观察到单纯的肿瘤栓塞治疗对肿瘤组织的乏血管区域效果不是特别理想。为了克服该挑战,课题组构建了同时载带凝血酶和细胞毒性药物多柔比星的共递送系统,该协同疗法在实现栓塞肿瘤血管丰富区域的同时,通过小分子化疗药物的组织渗透,对乏血管区域也具有很好的治疗效果。该策略和单一疗法相比具有更好的治疗效果,减少肿瘤复发,延长荷瘤小鼠生存期[24]。因肿瘤血管栓塞疗法会增加肿瘤细胞的缺氧水平,所以Ma等[25]利用肿瘤归巢配体叶酸(folic acid,FA)修饰的金属有机骨架材料(metal-organic frameworks,MOFs)作为纳米载体,靶向递送凝血酶和缺氧激活前药替拉扎明(Tirapazamine,TPZ)用于肿瘤治疗。FA靶向肿瘤细胞后,肿瘤的酸性微环境将导致载体解离,释放凝血酶诱导血栓形成,提供了重度缺氧的微环境。TPZ在缺氧条件下被激活而产生高细胞毒性的苯并三嗪,实现高效肿瘤细胞杀伤的目的。

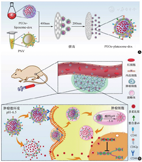
基于血小板与肿瘤细胞间受体与配体广泛的相互作用,血小板膜成为一种有效的肿瘤靶向药物递送系统[15]。与传统外源纳米递送载体相比,血小板膜作为内源性载体,其在血液循环过程中可以"伪装"成天然细胞,降低被免疫系统捕获、清除的风险,具有"隐形"效果[26]。Ki-Hyun Bang等[27]将紫杉醇(paclitaxel,PT)载入纳米结构脂质载体(nanostructured lipid carrier,NLC)中得到PT-NLC,而后使用血小板膜(platelet membrane)将其包被得到P-PT-NLC。实验结果显示,P-PT-NLC比PT-NLC对肿瘤组织具有更好的靶向性和肿瘤杀伤效果。我们课题组将提取的血小板膜与pH敏感型载药脂质体膜相杂合,构建了同时具有pH响应性和肿瘤靶向性的血小板仿生药物递送体系PEOz-platesome-dox(图2)[28]。血小板与肿瘤细胞之间具有强亲和力,使该纳米载体可以高效靶向肿瘤组织,随后在酸性的肿瘤微环境或胞内溶酶体中实现响应性药物释放,并最终实现高效的肿瘤杀伤目的。

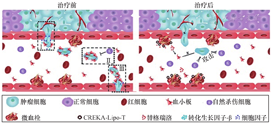
血小板在肿瘤转移过程中扮演重要角色,阻断其与肿瘤细胞间的相互作用,成为预防肿瘤转移的潜在靶点。替格瑞洛是一种可逆的抗血小板药物,可以抑制血小板的活化与聚集。我们课题组使用脂质体作为递送载体包封替格瑞洛,并在其表面修饰肿瘤归巢肽CREKA,这种肽对肿瘤组织具有很好的主动靶向性(图3)[29]。所得纳米药物CREKA-Lipo-T随着血液循环到达肿瘤部位后,可在肿瘤局部释放替格瑞洛,特异性地结合肿瘤微血栓、抑制肿瘤相关的血小板,阻断血小板的功能,从而减少肿瘤的转移。实验结果显示,与游离的替格瑞洛相比,纳米药物不会产生明显的出血并发症和毒副作用,并有效降低了肿瘤细胞向小鼠肺部转移。Xu等[30]设计了一种基于人血清白蛋白的纳米颗粒Ptx@AlbSNO,其通过肿瘤微环境进行响应而特异性释放血小板抑制剂NO与化疗药物紫杉醇,可以有效抑制肿瘤活化血小板和分泌TGF-β的能力,达到抑制原发性肿瘤生长、减少远端组织转移的目的。

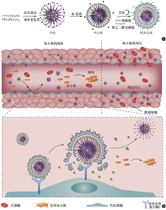
肿瘤细胞的快速增殖导致其血管具有结构不完整的特点,并存在异常的血管内皮间隙,凭借其异于正常血管的这种特点,血液循环中的纳米药物可依靠其尺寸效应渗透进入肿瘤部位,实现被动靶向的作用(即实体瘤的高通透性和滞留效应)。与此同时,由于血小板具有修复破损血管的生理功能,肿瘤相关的血小板便会通过分泌血管保护因子等途径来维持肿瘤血管的完整性。但这将使肿瘤血管的渗透性减弱,阻碍药物进入实体瘤中。基于此,通过耗竭肿瘤血管中血小板的方法,破坏肿瘤血管屏障,可以提高纳米药物在瘤内积累与递送的效率。我们课题组设计了一种基于聚合物-磷脂-多肽的药物递送系统(PLP-D-R),使其携带化疗药物多柔比星和血小板敲除抗体R300,这种单抗可诱导血小板产生微聚集进而耗竭血小板(图4)[31]。同时,该纳米药物的磷脂壳层连接有可被肿瘤微环境高特异性表达的基质金属蛋白酶2裂解的多肽,从而达到于肿瘤部位定点释放药物的效果。该系统可实现局部血小板耗竭与血管通透性提升的目的,从而增强药物在肿瘤组织中的富集,也大大降低了全身性血小板耗竭所带来的出血风险。Zhou等[32]筛选出全氟三丁胺(perfluorotributylamine,PFTBA)作为血小板抑制剂,选用人血清白蛋白(human serum albumin,HSA)作为药物递送载体构建PFC@HSA纳米颗粒,其可以通过抑制血小板而有效破坏肿瘤血管屏障,进一步选择性地增强肿瘤血管的通透性与肿瘤内的药物输送效果。

肿瘤细胞及其微环境可通过多种机制诱导血小板活化、聚集,并最终导致瘤内血栓形成。同时,血小板在促进肿瘤的生长、转移、调节肿瘤血管的通透性等方面发挥了至关重要的作用。血小板在促进癌症进展过程中的这些重要作用,直接决定了血小板调控或将成为肿瘤治疗的有效策略。然而,血小板的全身抑制势必给患者带来严重的出血风险,基于此,我们提出靶向肿瘤组织的血小板调控新方法。通过对纳米药物的结构及所装载的药物进行合理设计,可使其在生物体内对肿瘤组织实现被动或主动靶向作用,减轻药物带来的毒副作用。利用纳米药物这一特性结合调控血小板-肿瘤的有效靶点,可达到局部调节血小板功能,实现肿瘤治疗的目的,同时有效预防全身性的出血风险。在未来的研究中,应更进一步探究血小板与肿瘤间潜在、复杂的作用机制,剖析各过程中的主导因素,为更好地实现血小板调控在抗肿瘤领域的应用提供理论基础。血小板在肿瘤进展过程中还发挥着一些其他功能,如:参与肿瘤免疫反应和诱导肿瘤细胞耐药等[33,34,35]。基于这些功能,后期可以将抗血小板疗法与免疫治疗或化疗进行联合应用。此外,将受血小板启发的抗肿瘤疗法策略与其他传统或新兴的疗法相结合,可进一步推进血小板调控策略在抗肿瘤领域的应用。



























