
版权所有,未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别申明,本刊刊出的所有文章不代表中华医学会和本刊编辑委员会的观点。
本刊为电子杂志,以光盘形式出版。本册应读者需求按需印刷,随光盘免费赠阅,光盘如有质量问题,请向编辑部调换
肝脾T细胞淋巴瘤(hepatosplenic T cell lymphoma,HSTCL)是临床较罕见的一种外周T细胞淋巴瘤(peripheral T cell lymphoma,PTCL)。Farcet等[1]于1990年首次报道了该病,其主要临床表现为明显肝脾肿大,而无相关淋巴结累及;病理学特征表现为淋巴瘤细胞多侵犯肝、脾、骨髓的窦内[2]。2001年世界卫生组织(World Health Organization,WHO)将HSTCL列为造血与淋巴组织系统肿瘤分类中一个独立的疾病。本文报道1例脾外周T细胞淋巴瘤,分析其临床病理学特征及鉴别诊断以加深对该肿瘤的认识并对相关文献进行分析。
患者,女性,55岁,腹部撑胀6个月,于2017年7月4日入住泰安市中心医院。患者约6个月前无明显诱因的出现腹部撑胀,并出现食欲不振,无恶心呕吐、腹胀腹泻、寒战发热,发病后曾就诊于泰安市解放军八十八医院,超声提示:巨脾、副脾、门脉高压,为求进一步治疗,由门诊收入我院外科保健科。患者有糖尿病史1年,服用"二甲双胍"、"格列吡嗪",血糖控制尚可。查体腹软,未触及腹部肿块,腹部无压痛,肋缘下未触及肝脏,未触及胆囊。可触及脾脏,脾下级达髂棘,脾缘超过正中线3指。肝浊音界正常,肝区无叩痛,双侧肾区无叩痛,腹部移动性浊音阴性,肠鸣音正常,腹部未及血管杂音。
实验室检查:血常规应用XN9000 Sysmex全自动血液分析仪进行检测,肿瘤标志物使用西门子XP化学发光仪检测,血生化使用罗氏Cobas全自动生化分析仪检测。结果显示:白细胞计数2.88×109/L,红细胞计数3.29×1012/L,血红蛋白98 g/L,血小板79×109/L,β2-微球蛋白5.31 mg/L,乳酸脱氢酶198 U/L,女性肿瘤标志物无显著异常,抗核抗体阴性。患者取平卧位,充分暴露腹部,使用飞利浦彩色多普勒超声诊断仪进行腹部器官的检查。结果为巨脾、副脾、门脉高压。骨髓穿刺:患者取侧卧位后在髂后上棘同时采集骨髓,并使用流式细胞仪进行细胞检测。骨髓粒系增生(部分混血),单核细胞比例增高,可见幼稚单细胞;患者骨髓取材不良,胸骨及髂骨均干抽,外周血流式细胞术示可见0.06%髓系原始细胞,7.71%偏幼稚单核细胞,JAK2、CALR、MPL基因未见突变,TCRG重排阳性,IgH重排阴性,MDS基因突变检测示KRAS、DNMT3A、KMT2A阳性。脾脏标本病理结果:脾脏外周T细胞淋巴瘤伴脾组织坏死,免疫组化结果:PAX-5(局灶+),CD2(+),CD3(+),CD5(-),CD7(+),CD4(-),CD8(散在+),CD56(散在+),CD68(-),CD30(-),ALK(-),Ki67(阳性指数10%~15%);淋巴结活检病理结果:(颈部淋巴结)非霍奇金T细胞淋巴瘤,免疫组化结果:CD20(-),PAX-5(-),CD2(+),CD3(+),CD5(-),CD7(+),CD4(散在+),CD8(散在+),CD56(散在+),GranzymeB(-),T细胞胞质内抗原(T-cell-restricted intracellular antigen,TIA-1)(+),CD21(FDC网+),Ki67(阳性指数40%)(见图1)。
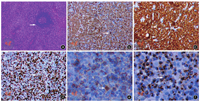

注:图a所示为肿瘤细胞围绕残存滤泡(苏木素-伊红染色40×),图b-f依次为CD3、CD7、KI67、CD56、TIA-1免疫组化染色结果(其中图b-d为100×,图e、f为400×),各图箭头所指均为阳性细胞
治疗:排除化疗禁忌,行EPOCH+L(依托泊苷0.1 g、吡柔比星20 mg、长春地辛1 mg d1-5、环磷酰胺d5、泼尼松100 mg bid d1-5、门冬酰胺酶10000 U d2,4,6,8,10)方案化疗,并辅以护胃、补钙、碱化、水化、保肝、降糖等对症支持治疗。
根据T细胞受体(T-cell receptors,TCR)的不同,HSTCL可分为γδ和αβ T细胞淋巴瘤两种亚型,其中γδ T亚型占绝大多数,且多见于青年男性,αβ T亚型多见于女性,但两者病理特点、临床表现以及遗传学特征等均相似,因此将它们都归类为HSTCL[3]。
HSTCL的病因及发病机制尚不明确,可能与长期的免疫功能抑制、遗传易感性以及慢性抗原刺激有关[4]。在查阅文献报道的238例HSTCL病例中有72%的病例发生在免疫功能低下的患者中,10%发生于接受硫嘌呤和/或肿瘤坏死因子α(TNF-α)抑制剂的炎性肠病患者[5,6],然而单独应用TNF-α抑制治疗并没有增加继发HSTCL的风险[7]。另外,感染疟原虫可引起长期的抗原刺激,亦可发生HSTCL[8]。也有学者认为HSTCL的发生与EB病毒有关,但作用机制并不完全清楚,可能是通过提供长期的抗原刺激使γδ T瘤细胞持续活化,从而对HSTCL产生影响[9]。
HSTCL主要见于青年男性,研究报道其中位年龄分别为29岁、34岁,中位生存期分别为8个月、16个月[10,11];Chernova等[12]报道3年总生存期为12%,中位生存期为26个月,γδ和αβ HSTCL的两年总生存期分别为25%、70%。由于HSTCL肿瘤细胞主要分布于结外,因此临床常表现为肝和(或)脾明显肿大、外周血细胞减少、常有发热、盗汗、体重减轻症状,淋巴结病变少见,并伴有乳酸脱氢酶、转氨酶及碱性磷酸酶轻度增高。该病进展迅速,且临床表现无特异性,目前尚无统一的诊断标准,因而诊断较困难,易被延误。从首次出现临床症状到确诊为HSTCL的中位时间为60天。HSTCL病理学特征性表现为肿瘤细胞在肝、脾、骨髓的窦内浸润[13],淋巴结多不累及。骨髓活检可见粒、红、巨核三系细胞过度增生,多侵犯窦内;脾脏显著增大,主要侵犯脾血窦及红髓,而白髓部位萎缩;肝脏轻度增大,肿瘤细胞常沿肝窦浸润,表现为肝窦扩张,而不侵犯肝门[14]。骨髓流式细胞免疫分型主要表达T细胞标记:CD2+、CD3+、CD4-、CD5-、CD7+、CD8-、也常表达NK细胞标记:CD16+、CD56+,B细胞标志物CD19、CD20、CD21、CD22常为阴性[10,11],TIA-1阳性,不表达细胞毒性分子颗粒酶B、穿孔素、Fas配体等。绝大多数表达TCRγδ,少数表达TCRαβ。最常见的染色体异常为7q等臂染色体存在,导致TCR基因重排[15],其次是8号染色体三体及11q14、t(7;14)(q34;q13)、2q23;q37和Y染色体丢失[16]。
HSTCL恶性程度高,预后差,中位生存时间小于2年[6],治疗方法主要包括常规化疗、脾切除、造血干细胞移植以及靶向药物等。脾切除仅能消除脾破裂的风险,改善外周血细胞减少,并不能改变疾病的自然病程[17];化疗通常选用标准CHOP方案,CHOP类似方案、以铂类为基础的方案、ESHAP(依托泊苷、甲泼尼龙、阿糖胞苷、顺铂)、Hype-CVAD、ICE(异环磷酰胺、卡铂、依托泊苷)等,但缓解率低,易复发[18,19];造血干细胞移植的疗效仍不确切,但可能会使患者获得长期生存,Voss等[20]研究了来自同一机构的14例HSTCL患者接受造血干细胞移植治疗,并报告中位生存期为65.6月。Rashidi和Cashen[21]对44例接受同种异体造血干细胞移植的HSTCL患者进行了系统回顾,其中有35%的患者复发,所有的复发都发生在造血干细胞移植后1.5年内,并没有患者在造血干细胞移植1.5年后出现复发,这些总体结果表明,同种异体造血干细胞移植产生的移植物抗淋巴瘤效应可使一定比例的HSTCL患者长期存活。肿瘤控制失败是HSTCL患者死亡的最常见原因,叠加的免疫缺陷和感染也可能导致患者死亡。最近的遗传学研究结果表明HSTCL可能的治疗靶点包括JAK1/2,STAT3和STAT5B,同时PI3KCD中的激活突变还为鉴定HSTCL患者的新疗法提供了框架。由于HSTCL病程进展快,常规化疗效果差、病死率高,因此积极探索新的靶向药物及其他治疗方法仍是今后的重点研究方向。





























