
患者,男,48岁。主因反应迟钝,言语减少1个月余入院。追问病史,家属诉患者性格改变1~2年,1个月前出现反应迟钝、言语减少、打字出错等认知障碍表现,曾两次就诊于当地医院,并给予相关治疗未见好转。
神清,不语,情感反应淡漠,体格检查不配合。智力评定不能完成。四肢可见自主活动,肌张力正常,腱反射(++),病理征未引出,脑膜刺激征阴性。
脑组织病理提示脱髓鞘以及根据2017版McDonald标准进行诊断。
采用甲泼尼龙琥珀酸钠冲击,并应用丙种球蛋白、吗替麦考酚酯,鞘内注射甲氨蝶呤。
出院后随访,患者认知水平明显提升,可主动简单正常交谈,生活可自理。
神经内科

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多发性硬化(multiple sclerosis,MS)是最常见的特发性炎症性脱髓鞘疾病之一,视力障碍是最常见的首发症状,也可表现为肢体无力(以不对称瘫痪常见),感觉异常,共济失调,精神症状和认知功能障碍等,极少数患者也可出现表达不能。现报道1例以表达不能以及认知障碍起病,影像学表现特异的MS患者的诊治经过,并进行相关鉴别诊断,以期提高神经内科医生对该疾病的认识,减少误诊漏诊。
患者,男,48岁。主因反应迟钝,言语减少1个月于2019年5月29日入院。患者于1个月前无明显诱因出现反应迟钝,表现为应答减少,打字出错,后出现肢体乏力,表情淡漠,极少回应,说话偶有颠三倒四。就诊于当地医院,诊断脑梗死,给予相关治疗,后出现嗜睡,醒后不言语,转至市级医院, MRI示:脑内组织多发异常强化灶,考虑炎性病变,腰椎穿刺术外送寡克隆区带(oligoclonal bands, OB)血与脑脊液均阴性,24 h IgG合成率正常范围,血寄生虫全套阴性。诊断急性播散性脑脊髓炎,后冲击甲泼尼龙,效果欠佳,复查头颅MRI示:双侧大脑半球多发异常信号,考虑感染性病变,对比之前检查强化减低。为求进一步诊治,转入我院。入院体格检查:体温36.7℃,脉搏80次/min,呼吸20次/min,血压126 /74 mmHg (1 mmHg= 0.133 kPa),一般内科体格检查未见明显异常。神经系统体格检查:神清,不语,有注视,缄默,情感反应淡漠,定向力计算力欠合作,语言、行为均无交流。体格检查不配合。智力评定不能完成。双侧瞳孔正大等圆,光反射灵敏。额纹及鼻唇沟对称,余脑神经体格检查欠合作。四肢可见自主活动,肌张力正常,腱反射(++),病理征未引出,脑膜刺激征阴性。既往糖尿病20年,高血压5年,30余年前有狗咬伤史,24 h内行狂犬疫苗接种,4年前再次被狗咬伤,24 h左右行狂犬疫苗接种,否认肝炎、结核等病史。
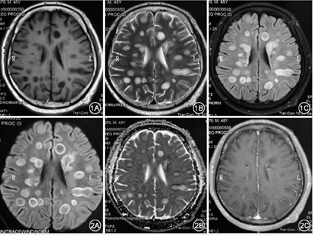
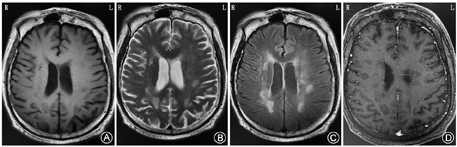
血常规:中性粒细胞0.777,淋巴细胞0.186,嗜酸粒细胞0.001,血红蛋白111 g/L,血小板计数110×109/L;尿常规:葡萄糖++,尿蛋白+;大便培养:菌群失调,有酵母样真菌生长;红细胞沉降率22 mm/h;补体:C3 0.72 g/L(0.8~1.6 g/L),血清免疫球蛋白G 5.92 g/L (7~16 g/L),CD20细胞105个/μl。血生化、凝血常规、便常规、甲状腺功能4项、术前4项、自身抗体、风湿4项、抗角质蛋白抗体、男性肿瘤全项、真菌D-葡聚糖、病毒系列均为阴性。脑脊液IgG合成率12.3 mg/d(-9.9~3.3 mg/d),血清及脑脊液寡克隆区带:阴性,抗MOG抗体IgG阴性,脑脊液蛋白1.1 g/L,脑脊液细胞学示:脑脊液可见12个淋巴细胞,13个单核细胞,3个嗜中性粒细胞。脑脊液二代测序阴性。肺CT(6月3日):①两肺下叶灌注不足;②心包少量积液;③两侧胸腔少量积液; ④主动脉硬化。颅脑CT:幕上脑白质多发低密度病变。入院MRI:双侧大脑半球多发异常信号,弥散受限符合脱髓鞘病变,感染继发?不除外脱髓鞘病变,请结合临床(图1,图2)。认知筛查:认知异常(欠合作),简易智力状态检查量表(mini-mental state examination,MMSE)8分,蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)2分,画钟检测0分。脑电图:中度异常,基本节律9 Hz,各导联混有大量中高幅3~7 Hz慢波及较多低幅18~ 28 Hz快波,尤以前头部导联为著。

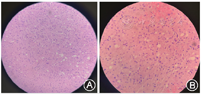
立体定向脑活检病理报告(北京会诊):少许脑白质组织,伴局灶髓鞘脱失、散在的泡沫细胞聚集及显著的胶质细胞增生、微囊变,可见多量的肥胖型星形细胞,免疫组化(NF)染色显示病变区轴索保留,未见明确血管周淋巴套袖形成,结合病史,影像学,特殊染色及免疫组化等不除外脱髓鞘病(非活动期),见图3。特殊染色Luxol Fast Blue染色:局灶髓鞘脱失。免疫组化结果示:CD68(+),GFAP(+),IDH1(-),NeuN(-),NF(+),Ki-67(+ 1%), MAP-2(-),Olig-2(少许+),IDH-1(-,)ATRX(+), p53(-),MGMT(+),抗酸病理(-)。

1954年ALLISON等[1]确立了时间多发性(dis- semination in time,DIT)与空间多发性(dissemina- tion in space,DIS)是诊断MS的基础,而后围绕此标准进行了丰富与修订,McDonald标准2017版是目前最新版[2],见表1,表2,表3[3]。

2017版McDonald标准内容
2017版McDonald标准内容
| 临床发作次数 | 有客观临床证据的病灶数 | 诊断MS还需要的证据 | |
|---|---|---|---|
| ≥2次临床发作 | ≥2 | 无 | |
| ≥2次临床发作 | 1(以及既往发作累及不同部位的明确病史证据) | 无 | |
| ≥2次临床发作 | 1 | 通过两次临床发作提示CNS不同部位受累或MRI显示DIS | |
| 1次临床发作 | ≥2 | 通过再次临床发作或MRI显示或通过脑脊液OB提示DIT | |
| 通过再次临床发作提示中枢神经系统不同部位受累或MRI显 | |||
| 1次临床发作 | 1 | 示DIS和通过再次临床发作或MRI显示或通过脑脊液OB提示DIT | |
注:CNS为中枢神经系统;DIT为时间多发性;DIS为空间多发性;OB为寡克隆区带

空间多发性和时间多发性的MRI标准
空间多发性和时间多发性的MRI标准
| 空间多发性可通过下列4个中枢神经系统部位中至少2个部位有至少1个符合典型MS的T2病灶a来显示:脑室旁b、皮层或近皮层、幕下、脊髓 |
| 时间多发性可通过任何时间同时出现增强和非增强病灶a,或者无论与基线MRI的时间间隔如何在随访MRI中新出现T2病灶或增强病灶来显示 |
注:a无须区分症状性和无症状性MRI病灶;b对>50岁或有血管危险因素者,要慎重寻找更多脑室旁病灶

原发性进展型多发性硬化的诊断标准
原发性进展型多发性硬化的诊断标准
| 残疾进展1年(回顾性或前瞻性确定)但无临床复发+下列中的两项: |
| 3个脑内部位中至少1个部位有至少1个符合典型MS的T2病灶a:脑室旁、皮层或近皮层、幕下 |
| 脊髓中至少2个T2病灶a |
| 检出脑脊液OB |
注:a无需区分症状性和无症状性MRI病灶;OB为寡克隆区带
根据McDonald标准2017版,本例患者1次发作,通过MRI证实了DIS(图1,图2),通过MRI增强扫描同时出现增强病灶与非增强病灶证实DIT(图2C),脑组织病理回报脱髓鞘病变,诊断:中枢神经系统脱髓鞘,多发性硬化。
是一种罕见的恶性淋巴瘤,占原发性颅内肿瘤的2%,占非霍奇金淋巴瘤的1%,其中弥漫性大B细胞淋巴瘤多见,好发于免疫缺陷患者,典型原发性中枢神经系统淋巴瘤多发生幕上脑深部、邻近脑室,表现为单发或多发病变,形态可规则,T1WI呈等或稍低信号,T2WI及T2FLAIR呈等或稍低信号;增强扫描时因为血脑屏障破坏而表现为均匀环形强化,典型病例可出现"握拳样"、"团块状"强化,可见"尖角征"等特征性改变[4]。激素治疗可使肿瘤缩小,症状减缓,且效果明显。本例患者排除该病的原因主要是:1.激素治疗效果欠佳,1 g甲泼尼龙冲击后未见改善; 2.MRI强化呈环形或者半环形强化,与原发性中枢神经系统淋巴瘤均匀环形强化相区别;3.脑脊液细胞学未见异常淋巴细胞,脑组织病理排除原发性中枢神经系统淋巴瘤。
结核性脑膜炎通常会侵犯蛛网膜或者软脑膜,当侵犯脑实质时可出现结核瘤,常见的起病表现为头痛发热,恶心呕吐,意识障碍等,伴有脑膜刺激征,脑脊液呈混杂细胞学反应,MRI上也可出现多发环靶征样结节或病灶,T2环靶征的形成,由内向外:高-低-高-低(液化坏死-干酪-炎性肉芽-纤维组织)。而病灶多位于脑内灰白质交界处和基底节区,少数位于颅底,分布特点符合经动脉的血源性播散。本例患者排除该病的原因主要是:1.无低热、盗汗、脑膜刺激征等结核感染中毒临床表现;2.脑脊液及脑脊液二代测序不支持; 3.无颅内结核的其他临床表现,如脑积水(梗阻或交通),脑膜强化等;4.病灶的位置,本例患者病灶多位于脑室旁,符合MS; 5.脑组织活检抗酸染色(-)。
是一种进行性亚急性脱髓鞘疾病,因JC病毒激活而导致局灶性或多灶性神经功能缺损,一般发生于细胞免疫反应缺陷患者。MRI表现为T2/FLAIR高信号,主要累及皮层下及脑室旁白质,额顶叶为著,有较轻的占位效应。病理特征:重度脱髓鞘并见肿胀的少突胶质细胞,伴/不伴广泛或局限性血管周围明显的炎性反应浸润。本例患者排除该病的原因主要是:1.缺乏免疫功能低下的证据;2.病灶位置,本例患者多位于脑室旁;3.脑脊液二代测序中未见病毒感染;4.治疗及预后不同。
又称Balo病,是一种罕见的中枢神经系统炎性脱髓鞘疾病,具有特异性病理改变,即病灶内脱髓鞘带与部分保留髓鞘,故称为同心圆硬化。头颅MRI具有典型的特征性改变:在白质区可见洋葱头样或树木年轮样黑白相间类圆形病灶,脱髓鞘区在T1WI上呈低信号环,在T2WI及FLAIR上呈高信号,正常髓鞘区在T1WI、T2WI及FLAIR上[5]。病理检查提示髓鞘保留区与髓鞘丢失区交替出现,脱髓鞘带中可见小血管周围淋巴细胞浸润并形成血管套。本例患者排除该病的原因主要是:1.病灶数量;2.同心圆样改变,患者复查也未见同心圆样改变,反而明显好转;3.病理检查结果。
是中枢神经系统急性炎症脱髓鞘性疾病中的一种。ADEM与MS的鉴别如表4, 表5[6]。
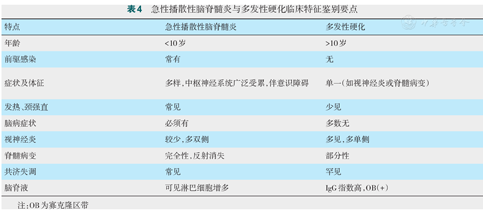
急性播散性脑脊髓炎与多发性硬化临床特征鉴别要点
急性播散性脑脊髓炎与多发性硬化临床特征鉴别要点
| 特点 | 急性播散性脑脊髓炎 | 多发性硬化 |
|---|---|---|
| 年龄 | <10岁 | >10岁 |
| 前驱感染 | 常有 | 无 |
| 症状及体征 | 多样,中枢神经系统广泛受累,伴意识障碍 | 单一(如视神经炎或脊髓病变) |
| 发热、颈强直 | 常见 | 少见 |
| 脑病症状 | 必须有 | 多数无 |
| 视神经炎 | 较少,多双侧 | 多见,多单侧 |
| 脊髓病变 | 完全性,反射消失 | 部分性 |
| 共济失调 | 常见 | 罕见 |
| 脑脊液 | 可见淋巴细胞增多 | IgG指数高,OB(+) |
注:OB为寡克隆区带
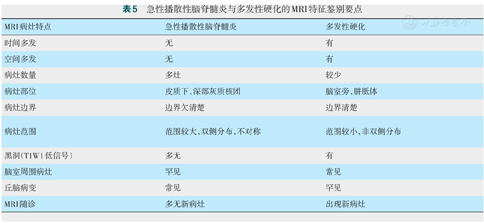
急性播散性脑脊髓炎与多发性硬化的MRI特征鉴别要点
急性播散性脑脊髓炎与多发性硬化的MRI特征鉴别要点
| MRI病灶特点 | 急性播散性脑脊髓炎 | 多发性硬化 |
|---|---|---|
| 时间多发 | 无 | 有 |
| 空间多发 | 无 | 有 |
| 病灶数量 | 多灶 | 较少 |
| 病灶部位 | 皮质下,深部灰质核团 | 脑室旁,胼胝体 |
| 病灶边界 | 边界欠清楚 | 边界清楚 |
| 病灶范围 | 范围较大,双侧分布,不对称 | 范围较小,非双侧分布 |
| 黑洞(T1W1低信号) | 多无 | 有 |
| 脑室周围病灶 | 罕见 | 常见 |
| 丘脑病变 | 常见 | 罕见 |
| MRI随诊 | 多无新病灶 | 出现新病灶 |
ADEM是广泛累及脑和脊髓白质的急性炎症性脱髓鞘疾病,通常发生在感染后、出疹后或疫苗接种后,常起病急,病情危重,合并脑病。其病理特征为多灶性、弥散性髓鞘脱失,病灶多围绕在静脉周围,血管周围有炎性细胞浸润形成血管套袖。临床上常与首次发作的急性MS难以区分,有文献表明,从病理角度考虑,静脉周围脱髓鞘常考虑ADEM,而融合性脱髓鞘常考虑MS。本例患者排除该病的原因主要是:1.起病形式:本例患者起病并不是典型的ADEM的急、重、合并脑病等特点,而是亚急性起病;2.病灶形态:本例患者可见边界清晰的"煎蛋征"、"开环"等提示MS的影像学特征,并不是大片状、边界不清晰的典型ADEM病灶形态;3.其中时间多发MS可表现为同一时刻MRI增强同时存在增强病灶与非增强病灶,而ADEM多无时间多发,表现为所有病灶同时增强或非增强,本例患者符合前者特征;4.到疾病后期MS出现星形细胞反应伴有纤维胶质增生,而ADEM无此表现。且本例患者MRI肉眼观察病灶周围并无明显水肿,如此多的病灶脑组织却无明显水肿,更与ADEM相区分,见表4,表5。
给予患者甲泼尼龙琥珀酸钠冲击,丙种球蛋白,吗替麦考酚酯,鞘内注射甲氨蝶呤。发病4个月后复查,MRI显示:颅内脑质多发异常信号,较前病变范围,程度明显减轻(图4)。认知明显提高,MSE 17分(治疗前8分),MoCA 13分(治疗前2分),画钟检测0分(治疗前0分)。患者能主动开玩笑,可进行简单的生活自理,可简单购物等。

MS多于20~40岁起病,急性或亚急性,常伴脑病,这也是区分ADEM与MS重要的症状。MS常见的临床症状和体征有:视力障碍是最常见且常为首发症状;肢体无力,以不对称瘫痪常见;感觉异常,可出现Lhermitte征,是多发性硬化特征性症状之一;共济失调;自主神经功能障碍往往提示脊髓受累;精神症状和认知功能障碍等,极少数患者也可出现表达不能。本例患者以表达不能起病,后出现认知障碍,无肢体无力、发热、颈强直等,起病形式少见,我们分析患者此次发作与额颞叶受累有关,同时无脑病,也暂不考虑ADEM。
影像学是MS诊断的关键之一,近年来诊断标准的修订愈显MRI的重要性。本例患者单个MRI切面上独立病灶最多达23个,实为罕见,大多分布于侧脑室旁,少数位于额颞顶枕叶,类圆形环状或结节状T1低信号T2高信号FLAIR高信号影,边缘清晰,大者约2.6 cm×1.6 cm,增强扫描初期部分强化,闭合环形强化或者开环样("C"形)强化,而后者多见于亚急性期;急性期以细胞水肿为主,DWI中心呈低信号,病灶周边呈环形高信号,其ADC值相对减低,称"晕环征",考虑为急性期MS病灶边缘聚集大量巨噬细胞,细胞外间隙缩小,水分子扩散受限,经激素规范治疗后,病灶多在数周内逐渐缩小或消散;本例患者有些病灶T1相病灶中心低信号,其外周信号稍高于中心信号,仍为低信号,T2相与FLAIR相病灶中心为高信号,外周信号逐渐减低,边界模糊,表现为"融冰征"[7]。有些病灶中心与周边信号差别较大,尤其T2相明显,中心为边界清楚的高信号,周围为稍低信号,形似一块"膏药",称"膏药征"[7];本例患者MRS示胆碱(Cho)峰升高,N-乙酰天门冬氨酸(NAA)峰降低, mI稍增高,提示代谢增高,胶质增生,尽管脑肿瘤也有类似表现,但其Cho峰升高、NAA降低程度更为显著;发生在侧脑室周围的病灶并无明显的与侧脑室壁垂直[8],与典型的MS特征性征象并不完全相符,个别病灶像手指一样平行于脑室周围静脉放射的方向,病理学上称"Dawson′s fingers"[9]。且本例患者MR肉眼观察病灶边缘较清晰,多位于脑室旁,无丘脑病变等,与ADEM相区别,且周围并无明显水肿,如此多的病灶脑组织却无明显水肿,更与ADEM相区分。
在最新的McDonald的诊断标准中,重点强调了脑脊液的诊断价值,脑脊液OB阳性可以支持DIT,增加了MS诊断的灵敏性,使得更多的MS可以及早确诊并及早得到治疗。相关文献指出,MS患者IgG指数与24 h IgG合成率高于视神经脊髓炎、神经系统炎性疾病、神经系统非炎性疾病患者,且差异有统计学意义[10],但亚洲人OB阳性率较欧洲人低是已存在的一个现象[11]。本例患者脑脊液OB阴性,IgG指数与24 h IgG合成率增高,血液中补体C3及免疫球蛋白的降低,从侧面证明了本例患者外周免疫系统的激活以及免疫细胞和抗体已进入中枢神经系统,攻击髓鞘,从而引起脱髓鞘反应。本例患者脑脊液中白细胞从未升高超过正常范围,可与ADEM相区别。
中枢神经系统白质内多发性脱髓鞘斑块为多发性硬化的特征性病理改变,多发于侧脑室周围、脊髓、视神经的白质。镜下急性期可有病灶充血水肿,以淋巴细胞为主,病灶内大多数髓鞘可被破坏,伴或不伴轴索损伤。本例患者发病1个月余后行立体定向脑活检术,患者在局麻下安装LEKSELL立体定向支架,并行头颅CT扫描获取坐标系数据,应用ELEKTA手术计划系统融合头颅MRI及CT数据,计算靶点及穿刺点坐标,取得病理组织,报告(北京会诊):提示脱髓鞘改变,显著的胶质细胞增生,可见多量的肥胖型星形细胞,而ADEM无此表现,且与相关疾病鉴别诊断后更加确信。
急性期推荐:①大剂量、短疗程激素冲击疗法(一线治疗Ⅰ级推荐),延长激素用药时间对神经功能恢复并无益处(Ⅱ级推荐)[12];②血浆置换(二线治疗):③丙种球蛋白:作为备选方案,适用于妊娠及哺乳期无法使用大剂量激素或激素治疗无效的儿童[13]。MS为终身性疾病,缓解期治疗目的为控制疾病进展,防止复发。目前我国批准上市的DMT药物包括口服特立氟胺与注射用重组人干扰素β-1b。研究表明,特立氟胺可显著降低复发风险并延缓疾病发展[14],本例患者因经济原因改为口服吗替麦考酚酯,目前患者病情无进展,认知障碍逐渐缓慢恢复。
综上所述,本例患者以认知障碍亚急性起病,颅内罕见多发病灶,T2相可见半环与闭环病灶,增强扫描可见增强与未增强病灶,病理结果支持脱髓鞘改变,该病例让我们更好地认识到MS影像学的多变性。
所有作者均声明不存在利益冲突



























