
患者于1个月前无明显诱因出现上腹部不适,偶伴腹胀,无恶心,呕吐,尿色深,皮肤巩膜黄染,皮肤瘙痒,无发热。
患者一般状态良好,皮肤巩膜黄染。心肺无著征。
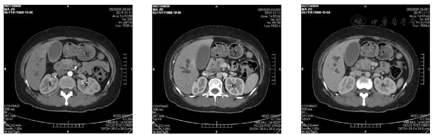
胰腺CT显示胰头钩突区占位,考虑胰腺癌、低位胆道梗阻。
行胰十二指肠切除术。术后病理:(胰腺)中分化腺癌。化学治疗采取GS方案(吉西他滨+替吉奥)。应用胸腺法新进行免疫治疗。
目前患者术后7个月处于随访中,精神状态良好,近期复查全腹CT未见异常
普通外科;肝胆外科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
胰腺癌是恶性程度极高的消化道恶性肿瘤之一,具有发病隐匿、进展迅速、预后差等特点,严重威胁人类的健康和生命。近年来,胰腺癌的发病率在全球范围内呈逐渐上升趋势,死亡率几乎等于发病率,5年生存率不足8%。由于胰腺癌早期缺乏特异性临床症状,大多数病例确诊时已失去手术的机会,而且目前常见的治疗手段(如放疗、化疗、靶向治疗等)均未能明显改善胰腺癌患者的预后。近年来,大量研究结果显示导致胰腺癌高致死性的一个重要原因与肿瘤微环境的免疫抑制作用有关。免疫疗法已成为胰腺癌研究的新热点,并成为继手术、化疗、放疗和靶向疗法之后的又一有效肿瘤治疗手段。部分免疫治疗方法已经进入临床或临床前期阶段并初步展现出一定的效果。我们对1例胰腺癌患者术后实施了胸腺法新联合GS方案治疗,现总结报道如下。
患者,女性,51岁。因"上腹部不适伴皮肤瘙痒1个月"于2019年11月11日入我院治疗。
现病史:患者于1个月前无明显诱因出现上腹部不适,偶伴腹胀,无恶心,呕吐,尿色深,皮肤巩膜黄染,皮肤瘙痒,无发热。于当地医院诊治,口服中医汤药治疗后症状无明显缓解。为求进一步明确诊治来我院,门诊医师经查以"梗阻性黄疸"收入院。病程中饮食睡眠正常,体重减轻10 kg。
既往史:既往体健。
入院体格检查:体温36.6℃,脉搏70次/min,血压126/84 mmHg(1 mmHg=0.133 kPa)。一般状态良好,皮肤巩膜黄染。心肺无著征。腹平软,未见胃肠型及蠕动波,无腹壁静脉曲张,无手术瘢痕,未触及包块,右上腹压痛阳性,无反跳痛,无肌紧张,肝脾未触及,Murphy征阴性,移动性浊音阴性,肝浊音界存在,肠鸣音3~5次/min,双下肢无水肿。
肝功能检查:丙氨酸氨基转移酶89.80 U/L,天门冬氨酸氨基转移酶112.50 U/L,总胆红素552.60 µmol/L,直接胆红素249.40 µmol/L,间接胆红素303.20 µmol/L;血淀粉酶139.30 U/l,尿淀粉酶3662.10 U/L;糖类抗原检测(CA-199)292.40 U/ml。
胰腺三期增强64层螺旋CT:胰头钩突区占位,考虑胰腺癌、低位胆道梗阻(图1)。

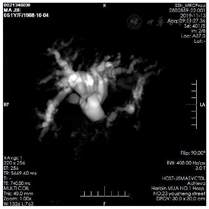
磁共振胰胆管水成像(MRCP):1.考虑胰腺钩突部占位继发肝内胆管、左右肝管、肝总管、胆总管中上段明显扩张,胆总管末端显示欠佳及胰管扩张。2.胆囊炎伴胆汁淤积(图2)。

于2019年11月28日在全麻下行胰十二指肠切除术。术后病理:(胰腺)中分化腺癌,累及胰腺周边脂肪组织,侵及十二指肠肌层,未累及十二指肠大乳头,可见神经侵犯;肿物体积2 cm×1.3 cm×1 cm;未见明确脉管内瘤栓;十二指肠黏膜见胰腺异位(d:0.6 cm)。(胃、十二指肠切缘、胰腺切缘)均未见癌;(肝总管断端)BilIN Ⅱ级;(胰周、胆囊颈旁、肠周、胃周淋巴结、第八组)淋巴结(4/9,1/1,0/9,0/7,0/9)见转移癌。
采取GS方案。方法:吉西他滨:生理盐水100 ml+吉西他滨1 000 mg/m2静脉输液30 min输完。第1天和第8天用药。替吉奥:每天2次(早饭后3粒、晚饭后3粒)连用14 d,休息7 d。每21天一个疗程,由于患者原因,共使用4个疗程。
应用胸腺法新。①术后1.6 mg,1次/d;②化疗前4 d,1.6 mg,1次/d;化疗后,1.6 mg,3次/周。
术后无胰瘘、腹腔感染、出血、胃功能障碍、假性动脉瘤、肿瘤复发转移等并发症出现。患者目前术后7个月,目前处于随访中,精神状态良好,近期复查全腹CT未见异常,CEA、CA-199、CA-125均在正常范围。
随着对胰腺癌发病机制的逐步了解,胰腺癌的免疫治疗已经逐渐成为胰腺癌治疗中的热点问题。肿瘤免疫治疗是指通过提高机体免疫系统对肿瘤细胞敏感度,特异性杀伤肿瘤细胞,以达到抑制肿瘤生长甚至消灭肿瘤目的的一种治疗方法。肿瘤的免疫治疗主要包括免疫检查点抑制剂单抗、肿瘤疫苗、过继性T细胞治疗、免疫调节剂等。
免疫调节剂是一类能增强、促进和调节免疫功能的非特异性生物制品,目前使用的免疫调节剂主要有干扰素(interferon,IFN)、白介素(interleukin,IL)、胸腺法新等。免疫调节剂对于抗体与抗原的结合T细胞杀伤靶细胞的过程发挥重要的作用,免疫调节剂可以增强T细胞的活化,促进T细胞的增殖能力,进而提高T细胞识别肿瘤的能力,促进T细胞对肿瘤细胞的杀伤作用。因此补充免疫调节剂可以增强自身免疫反应,抑制或杀死肿瘤细胞。免疫治疗是一个全新的领域,目前国内外开展了大量的临床及实验室研究。Ding等[1]通过试验研究证明IFN-γ可以通过抑制miR-212-3p表达,促进组织相容性复合体Ⅱ (MHC class Ⅱ)的表达,进而促进免疫细胞的抗肿瘤作用。同时有文献报道IL-2可以提高机体抗肿瘤免疫应答[2]。《原发性肝癌诊疗规范(2017年版)》明确胸腺法新作为免疫治疗药物之一,同时它也是胸腺肽类药物中唯一进入诊疗规范的免疫治疗药物[3]。既往研究中发现胸腺法新的主要成分胸腺肽主要通过3种机制达到预防、治疗肿瘤的作用。①胸腺肽可以促进肿瘤细胞凋亡,抑制肿瘤生长;②胸腺肽可以增强免疫功能提高免疫细胞对肿瘤的杀伤作用;③胸腺肽可以改善抗肿瘤治疗过程中产生的免疫抑制、器官损伤以及其他负面作用[4]。Lao等[5]通过体内及体外试验证明胸腺肽可以抑制肿瘤细胞的增值,诱导肿瘤细胞凋亡并增强抗肿瘤药物的抗癌作用。同时有研究发现胸腺法新联合程序性死亡受体1(programmed cell death 1,PD-1)治疗非小细胞肺癌和黑色素瘤的治疗效果显著[6,7]。有研究在肺癌中发现胸腺法新可以增强T细胞功能,刺激T细胞成熟和分化,在联合化疗时可减少免疫抑制的发生及改善患者预后[8,9]。
吉西他滨为二氟核苷类抗代谢药物,可以抑制脱氧核苷酸生成,干扰肿瘤细胞DNA合成及修复过程。替吉奥为氟尿嘧啶衍生物口服抗癌剂,可以抑制二氢嘧啶脱氢酶,促胸苷酸合成酶分解代谢,可长时间维持在血液及肿瘤组织中5-氟尿嘧啶的浓度,从而促进5-氟尿嘧啶的抗肿瘤作用。同时吉西他滨与替吉奥联合应用治疗晚期胰腺癌显示联合治疗显著延长患者生存期,《胰腺癌诊疗规范(2018年版)》推荐其为一线治疗选择[10]。



























