
患儿,男性,2个月13 d,主因"皮肤色素沉着伴体重增长缓慢2个月余"为代主诉入院。
入院时体格检查:体温36.2 ℃,脉搏134次/min,呼吸49次/min,血压76/48 mmHg (1 mmHg=0.133 kPa),体重2.17 kg,身长55 cm,头围37 cm,神志清,精神反应差,全身皮肤色素沉着明显,全身皮肤黏膜无明显干燥,皮肤弹性欠佳,前囟大小约1.5 cm×1.5 cm,眼窝稍凹陷,眼睑无水肿,口唇色素稍沉着,牙龈无明显色素沉着,颈软,双侧甲状腺未触及肿大,心肺腹部体格检查无异常。阴囊皮肤色素沉着,双侧睾丸体积各约1 ml,阴毛PH1。
患儿及其父母全外显子基因检测结果提示:患儿携带黑皮质素2受体(MC2R)基因:c.433C>T(p.R145C)和c.710T> C(p.L237P)复合杂合变异,其中c.433C>T(p.R145C)遗传自父亲,为已报道的致病性变异;c.710T>C(p.L237P )遗传自母亲,既往未见报道,ACMG评分为可能致病。诊断考虑为MC2R基因复合杂合变异导致的1型家族性糖皮质激素缺乏症。
给予糖皮质激素氢化可的松片替代应用,定期随访。
已随访3年余,患儿3岁5月龄时随访身长91.6 cm,体重13.3 kg,皮质醇7.68 μg/dl,促肾上腺皮质激素14.820 pg/ml,胰岛素样生长因子-1 134.225 ng/ml。目前氢化可的松剂量为3.3 mg,1次/12 h,口服。
内分泌遗传代谢科;新生儿科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
家族性糖皮质激素缺乏症(familial glucocorticoid deficiency,FGD)是一种罕见的常染色体隐性遗传病,主要临床特征是单一皮质醇缺乏而醛固酮、肾素水平正常,该病是由于肾上腺皮质束状带对促肾上腺皮质激素(adrenocorticotrophic hormone,ACTH)不敏感而导致ACTH水平明显增高,而皮质醇水平降低,同时伴有皮肤色素沉着的临床特点。该病的发病年龄早晚不一,临床表现因发病年龄不同而表现各异。随着基因检测技术的发展,越来越多FGD的致病基因被发现,约有70%的患者有明确的致病基因,目前已报道的与FGD相关的基因主要有黑皮素受体2 (MC2R )[1]、黑皮素受体2辅助蛋白(MRAR)[2]、硫氧还蛋白还原酶2(TXNRD2)[3]、类固醇激素急性调节蛋白(STAR)[4]、细胞色素p450(家族1、亚家族A、多肽1)、特殊类型三A综合征(alacrima achalasia adrenal insufficiency/triple A syndrome,AAAS)[5,6]。此外烟酰胺核苷酸转氢酶(NNT)[7]、微小染色体修复缺陷4同源基因(MCM4)[8]为参与氧化应激过程的相关基因。其中由MC2R基因引起的FGD为1型,其余均为2型,在2型中,由MRAP基因缺陷引起的FGD为经典2型。 FGD1型的平均发病年龄为2岁[9],相对晚于2型。为进一步提高临床医师对本病的认识,现报道1例2017年10月初次就诊我院内分泌遗传代谢科,并于2018年7月经基因检测确诊的家族性糖皮质激素缺乏症1型患儿的诊疗及随访经过。
患儿,男性,2个月13 d,主因"皮肤色素沉着伴体重增长缓慢2个月余"为代主诉入我院。患儿41+5周,因"胎膜早破7 h、胎位不正"于当地县妇幼保健院行剖宫产,生后即发现皮肤色素沉着,哭声可。生后第2天出现呼吸困难,遂转入当地上级医院,院外查血常规、血气分析、乳酸基本正常;电解质钠钾钙均正常。凝血功能基本正常;内分泌实验室检查:皮质醇1.38 μg/dl(参考范围7.26~ 32.28 μg/dl),未见ACTH检测报告单,醛固酮(卧位)206.57 pg/ml(参考范围:110~300 pg/ml);未见肾、血管紧张素报告单,甲状腺功能:TSH 12.40 μIU/ml(参考范围:0.7~5.97μIU/ml),FT4 13.31 pmol/L(参考范围:12.3~22.8 pmol/L),FT3 3.60 pmol/L(参考范围:3.69~8.46 pmol/L );性激素相关:FSH 1.57 mIU/ml,LH 7.16 mIU/ml,PRL 132.60 ng/ml, E2<5 pg/ml,P<0.03 ng/ml,T 1.71 ng/ml;彩超(肾上腺+头颅+心脏)示:双侧肾上腺体积小;颅内未见异常;动脉导管未闭,卵圆孔未闭,三尖瓣少量返流,肺动脉高压(轻度);胸部X线:双侧肺透明膜病?外周血CAH检测包+MLPA、性腺疾病大片段(CAH)+其他基因测序及NROB1基因检测均未找到可解释患儿临床表型的明确致病性变异。外院诊断为"新生儿高胆红素血症、新生儿败血症、新生儿肺炎、先天性肾上腺皮质增生症?甲状腺功能异常",给予抗感染、机械通气、蓝光、左甲状腺素片及氨基酸、脂肪乳等营养支持等治疗1个月余后出院。出院后患儿纳奶差,无反复呕吐腹泻,体重无增长,皮肤色素沉着无好转,至当地医院复查时发现静脉血糖2.0 mmol/L,遂至我院。
患儿系G2P2,母孕期因多次感冒予口服药物对症治疗(具体用药不详),有1位姐姐,2岁,体健。父母非近亲结婚,家族中无类似疾病史。
体格检查:体温36.2 ℃,脉搏134次/min,呼吸49次/min,血压76/48 mmHg(1 mmHg=0.133 kPa),体重2.17 kg,身长55 cm,头围37 cm,神志清,精神反应差,全身皮肤色素沉着明显,全身皮肤黏膜无明显干燥,皮肤弹性欠佳,前囟大小约1.5 cm×1.5 cm,眼窝稍凹陷,眼睑无水肿,口唇色素稍沉着,牙龈无明显色素沉着,颈软,双侧甲状腺未触及肿大,心肺腹部查体无异常。阴囊皮肤色素沉着,双侧睾丸各约1 ml,阴毛PH1。
入院辅助检查:卧位:血管紧张素I 37° 9.624 ng/ml,血管紧张素I 4° 2.342 ng/ml,每小时肾素活性7.28 ng/ml,血管紧张素Ⅱ 58.68 pg/ml,醛固酮114.9 pg/mL;睾酮2.730 ng/ml,孕酮<0.030 ng/ml ,硫酸脱氢表雄酮3.07 μg/dl;促肾上腺皮质激素>2 000 pg/ml,皮质醇0.24 μg/dl;电解质:钾5.33 mmol/L,钠138.0 mmol/L,氯101.0 mmol/L,钙2.73 mmol/L;17α-羟基孕酮0.653 ng/ml,肝肾功、心肌酶谱、血脂均正常。建议完善全外显子基因检测,家属拒绝。
结合患儿临床表现及相关辅助检查,初步诊断为原发性肾上腺皮质功能不全。给予口服氢化可的松片2.5 mg,1次/12 h。2018年7月,患儿1岁龄复诊,身长71.8 cm,体重10.5 kg,17α-羟基孕酮0.292 ng/ml,睾酮<0.025 ng/ml,孕酮(3代)0.062 ng/ml,促肾上腺皮质激素89.690 pg/ml,皮质醇18.16 μg/dl,钾4.59 mmol/L,钠135.7 mmol/L,氯97.4 mmol/L,钙2.59 mmol/L。
于2018年7月再次建议家属行基因检测,家属同意并签署知情同意书。抽取患儿及其父母外周血各2 ml,EDTA抗凝,送至北京信诺佰世医学检验所进行基因检测。利用Agilent Sure Select方法外显子捕获,Illumina测序平台进行高通量测序,测序数据经NextGENe软件匹配分析,采用Ingenuity在线软件进行变异过筛及解释,候选基因编译经Sanger测序验证。对明确与受检者的临床表现相关的变异氨基酸,将其与同源物种(同源物种氨基酸序列来源:http://www.ensembl.org)的氨基酸序列进行比对,分析氨基酸的保守性。对于疑似变异,参照美国医学遗传学与基因组学会(American College of Medical Genetics and Genomicsm,ACMG)评级指南对其致病性进行评估。检测结果:在受检者中发现MC2R基因上述复合杂合变异:经Sanger验证,受检者父亲携带c.433C>T(p.R145C)杂合变异,受检者母亲携带c.710T>C (p.L237P )杂合变异。 c.433C>T(p.R145C)杂合变异为已报道的致病性变异;c.710T>C (p.L237P )错义变异来源于母亲,为未见文献报道的新变异,根据ACMG指南,判断该变异为可能致病性变异。患者家系基因突变见图1及图2。本研究经医学伦理委员会批准[(伦)审编号:2021-K-042]。
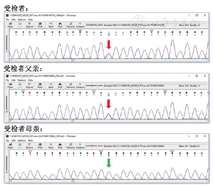

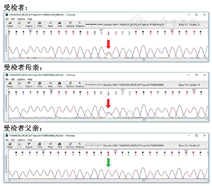

目前诊断为家族性糖皮质激素缺乏症1型,患儿3岁5月龄时随访身长91.6 cm,体重13.3 kg,皮质醇7.68 μg/dl,促肾上腺皮质激素14.820 pg/ml,胰岛素样生长因子-1 134.225 ng/ml,目前氢化可的松剂量为3.3 mg, 1次/12 h口服。
FGD最早于1959年由Shepard等[10]报道,主要介绍了2例家族性爱迪森病,姐妹二人均为肾上腺皮质功能减退,临床表现相似,均为皮肤色素沉着、乏力,之后出现抽搐发作,实验室检查均为皮质醇明显降低,电解质正常,醛固酮、肾素水平正常,姐姐夭折,妹妹在连续6 d给予40单位ACTH后血浆皮质醇水平仍为0,提示对ACTH无反应。目前FDG的诊断主要基于患儿的临床表现,最常见的表现为皮肤黏膜色素沉着、体重不增、呼吸困难、低血糖,实验室辅助检查主要为ACTH明显升高,皮质醇显著降低,电解质正常。随着基因检测技术的日益发展,越来越多疾病相关的致病基因被检出。 Clack等[11]于1993年首次报道MC2R基因突变导致FGD1型,MC2R基因突变导致其所表达的ACTH受体结构及功能出现异常,使ACTH减少或亲和力下降而导致FGD,并可出现肾上腺萎缩。本例患儿肾上腺超声提示肾上腺体积小。目前在MC2R基因突变中,共发现了47种突变形式,包括点突变、插入、缺失等,其中点突变是FGD1型最常见的原因。
FGD1型应与肾上腺皮质功能减退、先天性肾上腺皮质增生症、DAX-1缺陷、21p临近基因缺陷等疾病相鉴别。其中肾上腺皮质功能减退的病因中,由基因突变导致的约占72%,其他基因缺陷导致综合征相关的约占7%,后天获得性的如肾上腺肿瘤、肾上腺结核、肾上腺出血、自身免疫破坏等约占13%。肾上腺发育不良主要病因是DAX-1缺陷、 Xp21临近基因缺陷等;皮质激素合成障碍可导致先天性肾上腺皮质增生症;激素前体物质不足的病因是胆固醇合成缺陷;过氧化物酶缺陷可出现肾上腺脑白质营养不良。
本例患儿有生长迟缓、低血糖、皮肤色素沉着,但17-OHP和电解质正常。CYP21A2基因检测无异常发现,可排除21羟化酶缺乏症;该患儿外生殖器外观正常,电解质正常,CAH-Pannel基因检测阴性,可排除其他类型CAH;患儿NROB1基因检测正常,不支持AHC;患儿有低血糖、生长迟缓,但电解质正常,无CK异常增高,不支持Xp21临近基因缺失;该患儿无小头畸形、上腭裂、并指、先天性心脏病、男性化不全等表型,不支持胆固醇合成障碍类疾病如Smith-Lemli-Opitz综合征。
该例患儿生后出现严重的呼吸衰竭,考虑与糖皮质激素缺乏影响肺成熟相关。生后院外完善甲状腺功能异常,提示TSH升高,外院给予左甲状腺素片(优甲乐)治疗,患儿首次至我院就诊复查甲功正常,停用优甲乐3年余,甲功均正常,与波兰的报道一致[12]。该患儿的肾素-血管紧张素-醛固酮水平正常。文献报道FGD1型患儿由于MC2R突变导致ACTH受体作用缺陷,可能导致软骨和/或骨生长异常,因GH及IGF-1水平正常,提示该作用独立于GH-IGF-1轴,但可能依赖于ACTH通过其他黑素皮质激素受体的作用,导致患儿身材高大[13],同时可伴有远视、前额突出、内眦赘皮、手指纤细等表型特征。在FGD1型的高个患者中,在使用糖皮质激素替代疗法后,线性生长速率下降到正常水平[13]。本例患儿目前身高<3 rd,体重10 th,其2~3岁生长速率为10 cm/年,结合生后患儿严重肺部感染、低血糖、喂养不耐受,故分析2岁前生长迟缓可能与此相关,但该患儿是否合并生长激素缺乏症仍应考虑,仍需密切监测生长速率,必要时完善生长激素激发试验等相关检查。
FGD1型患者需进行糖皮质激素终身替代治疗,一般无需补充盐皮质激素。糖皮质激素剂量为8~10 mg/(m2·d);按生理节律给药;遭遇应激情况(感染、手术、外伤等),根据应激严重程度将糖皮质激素剂量增大2~3倍;发生急性肾上腺皮质功能衰竭,则应按肾上腺危象进行抢救,此时糖皮质激素应静脉滴注,推荐剂量50~100 mg/m2。而死亡病例多由于感染、休克、肾上腺危象等导致[14]。
综上所述,FGD1型是一种罕见的、可治疗的遗传性疾病,由于临床表现缺乏特异性易被忽略而延误诊治。诊断和治疗的早晚与疾病严重程度及死亡率有关。希望通过该病例能为临床医师提供帮助,指导临床早识别、早诊断、早治疗,改善预后。
所有作者均声明本研究不存在利益冲突



























