
患者,男性,67岁,主因“头晕、胸痛伴一过性意识丧失3 d”入院。患者2019年4月19日步行时突发头晕、胸背痛,2~3 s后一过性意识丧失。120急救测血压61/37 mmHg(1 mmHg=0.133 kPa),心率114 次/min,心电图未见异常。急诊查胸部CT:心包积液,主动脉根部增粗。心脏超声(UCG):左室肥厚,中量心包积液,左室射血分数(LVEF)38%。予升压治疗转至外院查肌钙蛋白I 1.2 ng/ml,D-二聚体2094 ng/ml。UCG:中量心包积液,LVEF 60%。主动脉CTA(computed tomographic angiography,CTA):未见夹层。4月20日晚转入本院,心电图胸前导联ST段可疑抬高,肌钙蛋白I轻度升高。心包穿刺出血性心包积液。既往高血压病、大量吸烟史。入院体格检查:血压129/88 mmHg,心率71次/min,心音略低钝,各瓣膜区无杂音。肝区叩击痛。双下肢不肿。
入院后复查主动脉CTA:未见明显夹层。4月26日经食道心脏超声(transesophageal echocardiography,TEE)示升主动脉根部小夹层,中度主动脉瓣关闭不全。
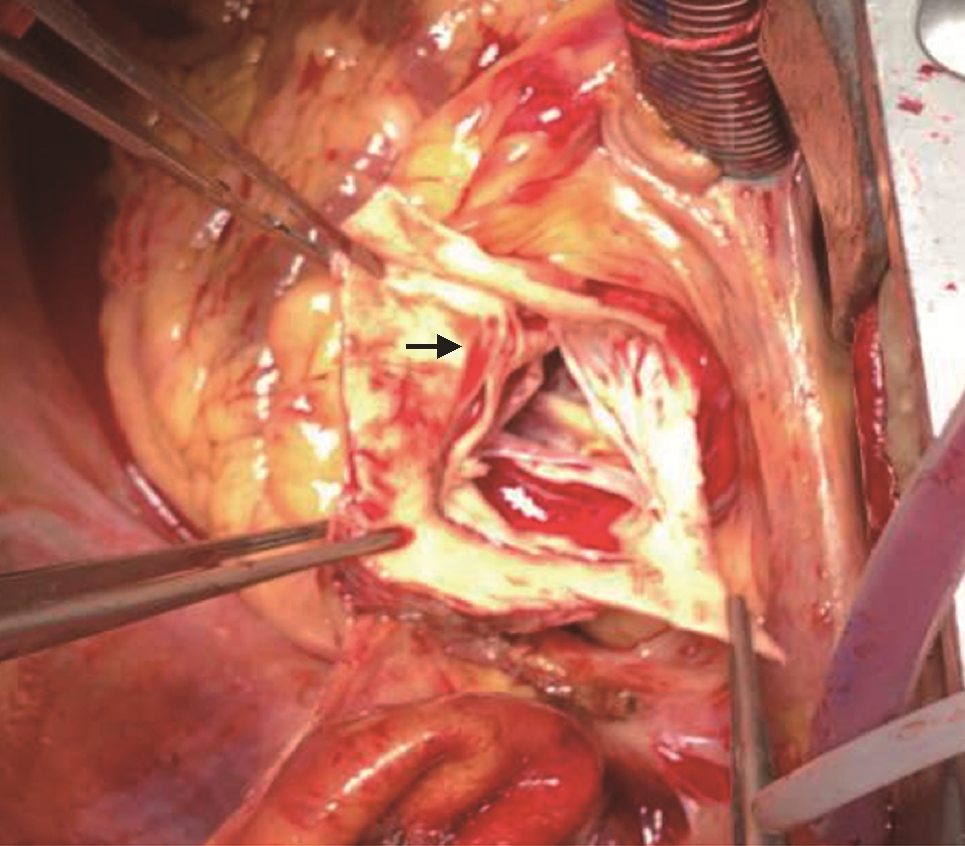
降压治疗后转至心外科全麻下行Bentall手术+主动脉瓣生物瓣置换术。
随诊至今2年余,病情稳定。
心内科;心外科;急诊科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
主动脉夹层(aortic dissection,AD)是指由主动脉内膜撕裂导致的主动脉壁血管层分离。急性AD一般是指发病14天内的AD,危险因素包括:高血压、动脉粥样硬化、既往心脏手术、已知的动脉瘤、已知的结缔组织病(如马凡综合征)等[1]。急性AD起病急,症状重,与急性冠脉综合征不易鉴别,一旦延误后果严重。我们报道1例以胸痛、晕厥为主要表现的隐匿性主动脉根部夹层,2次主动脉CTA均未发现夹层,最后通过TEE明确诊断,及时手术,旨在提高对本病的认识,减少误诊和漏诊。
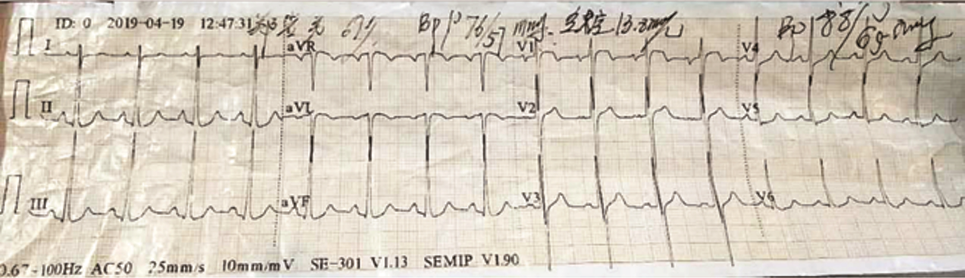
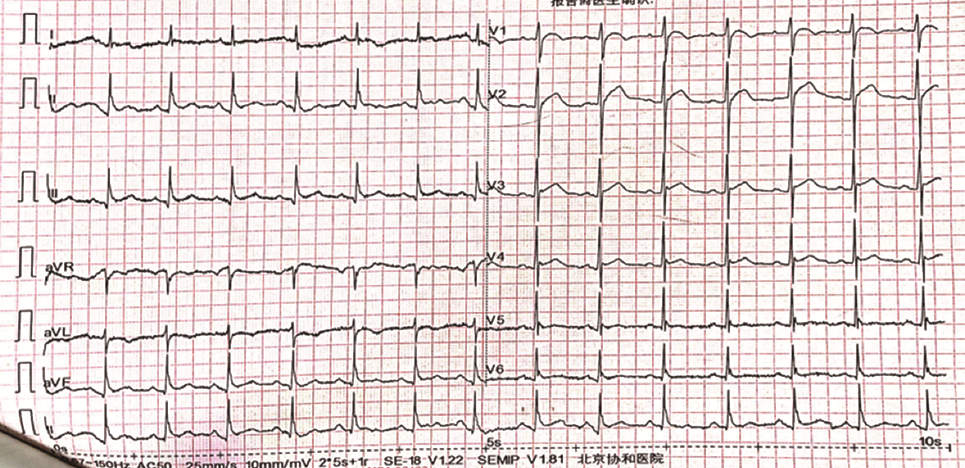
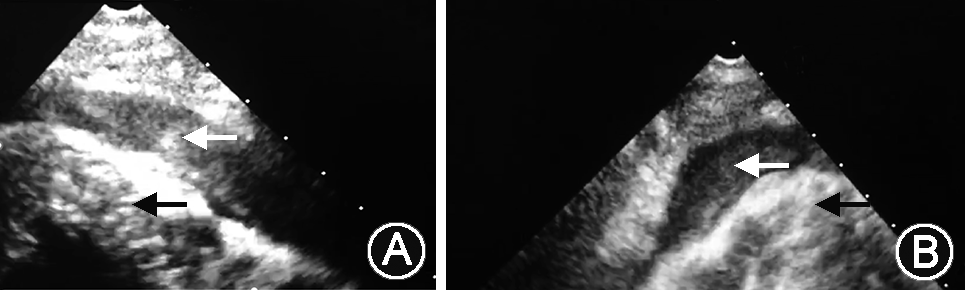
患者,男性,67岁,主因“头晕、胸痛伴一过性意识障碍3 d”入院。患者2019年4月19日13:00步行时突发头晕,伴胸背部疼痛,大汗、呼吸困难,2~3 s后一过性意识丧失,约20 min后恢复意识。14:00患者再发心前区压榨样疼痛,向胸背部放射,至当地医院急诊测血压61/37 mmHg(1 mmHg=0.133 kPa),心率114次/min,肝肾功能:谷丙转氨酶(ALT)156 U/L,谷草转氨酶(AST)262 U/L,肌酐 111 μmol/L;心肌酶(-),心电图未见明显异常(图1)。胸部CT:心包积液,主动脉根部增粗。UCG:左室肥厚,左室节段性室壁运动异常,中量心包积液,LVEF 38%,予多巴胺及去甲肾上腺素静脉泵入,维持血压 90~110/70~80 mmHg。4月20日中午转至北京某三甲医院,查肝肾功:ALT 2 139 U/L,AST 1 534 U/L,肌酐230 μmol/L,肌钙蛋白I:1.2 ng/ml,D-二聚体 2094 ng/ml(参考范围0~243 ng/ml)。床旁UCG:LVEF 60%,中量心包积液,主动脉瓣轻度返流。主动脉CTA:未见明显夹层。2019年4月20日晚转入本院抢救室,入院血压 71/52 mmHg,心率92次/min,SpO2 98%,查肌酐206 μmol/L,心电图可疑V1~V2 ST段可疑弓背向上抬高,T波低平(图2),肌钙蛋白I 1.659 μg/L。行诊断性心包穿刺得血性心包积液。04月21日床旁UCG:少量心包积液;下腔静脉增宽;左室肥厚;心包腔内可疑占位,血栓可能性大(图3A、B)。腹主动脉超声:腹主动脉粥样硬化伴多发斑块形成。给予补液、血管活性药维持血压,加用天晴甘美及多烯磷脂酰胆碱保肝,监测肝酶及肌酐缓慢下降,为进一步诊治收入我科。既往高血压病10年,收缩压最高170 mmHg,口服硝苯地平缓释片1片/d,收缩压控制在140~150 mmHg左右;有大量吸烟史,家族史无殊。入院体格检查:血压129/88 mmHg,心率71次/min,双下肺无罗音,心音略低钝,各瓣膜区无杂音。肝区叩击痛。双下肢不肿。



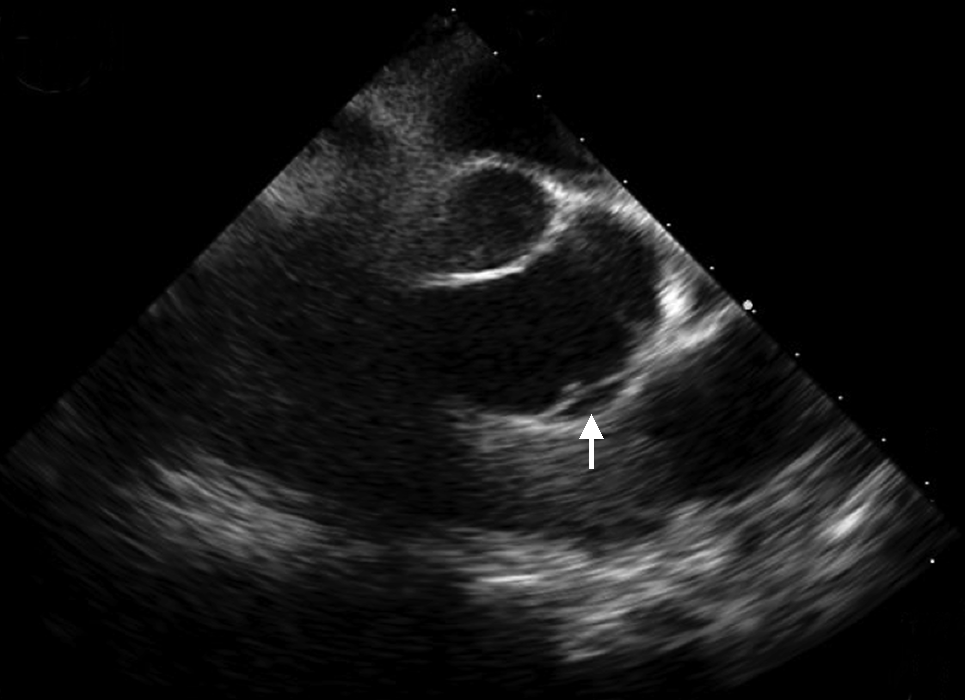
入院后查ALT 1976 U/L,AST 713 U/L;复查主动脉CTA未见明确夹层。4月26日TEE示升主动脉根部左冠窦壁呈2条分离的回声带,腔内可见纤细的剥离的内膜片,起始于主动脉瓣左冠瓣根部,局限于主动脉窦管部。彩色及频谱多普勒显示:舒张期左室流出道内可见中等量五彩镶嵌的主动脉瓣反流束,同时可见少量血流通过升主动脉内膜破口进入假腔(图4)。诊断AD(Stanford A型),中度主动脉瓣关闭不全。

1. 急性AD:患者为老年男性,有高血压、大量吸烟史,均为AD危险因素。临床表现也符合急性AD,考虑为主动脉根部夹层,破入心包,导致急性心包填塞,休克,以及急性肝功能损伤和急性肾功能损伤。患者D-二聚体明显升高,诊断性穿刺出血性心包积液亦支持AD诊断。但两次主动脉CTA均未发现夹层,最后通过TEE明确诊断,及时手术。
2. 急性冠脉综合征(ACS):患者老年男性,有高血压、大量吸烟史,也是冠心病的危险因素。患者临床表现为胸背痛,肌钙蛋白阳性,应警惕ACS可能。但患者心电图变化不典型,晕厥及血性心包积液也不能用ACS解释。ACS导致晕厥多见于下壁心梗导致的缓慢心律失常,或者是前壁心梗导致的室性心律失常,其心肌酶往往明显升高,本例均不符合。ACS导致血性心包积液,多见于ST抬高心梗合并心脏破裂,本例心电图及UCG均不支持。
3. 心包恶性肿瘤:患者老年男性,大量吸烟史,本院UCG提示心包内占位,还应该警惕心包恶性肿瘤可能,尤其是心包转移癌。
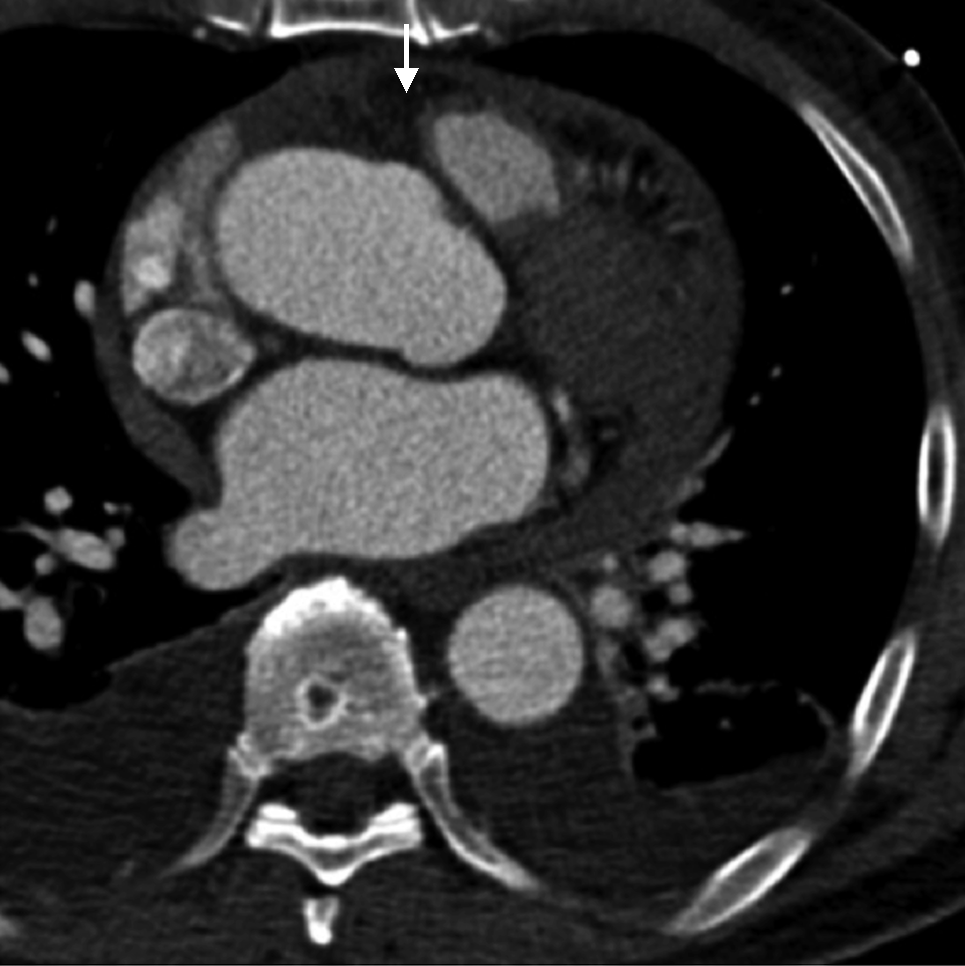
患者入院后血压逐渐恢复至140/85 mmHg,予络活喜控制血压及保肝治疗,患者肝肾功能逐渐好转。5月6日转至心外科全麻下行Bentall手术+主动脉瓣生物瓣置换术(图5)。术后回顾患者主动脉CTA,其主动脉根部冠脉窦水平可见夹层迹象(图6)。


患者出院后门诊随诊至今2年余,病情稳定。
AD临床并不常见,但往往发病突然且病情危重,可表现为剧烈胸痛、背痛和急性血流动力学紊乱,临床医师应尽早明确诊断并及时治疗。
本例老年男性,长期高血压,突发胸痛、低血压、一过性晕厥,首先需警惕急性心梗的可能。患者临床表现有低血压、一过性晕厥,应考虑急性下壁心梗合并缓慢性心律失常(比如严重的窦性心动过缓、高度房室传导阻滞等)、急性前壁心梗合并室速、室颤等。但是患者的心电图仅仅为V1~V2导联ST段抬高,肌钙蛋白轻度升高,后续也没有典型的急性心梗动态表现(病理性Q波、肌钙蛋白明显升高、下降动态变化),后续三甲医院的心脏超声也未见典型心肌梗死表现,所以基本可以除外急性心肌梗死。考虑本例患者的心电图及肌钙蛋白异常,为急性心包填塞、一过性低血压导致的继发改变可能性大。
本例患者发病之初在当地医院心脏超声提示节段性室壁运动异常,似乎支持急性心梗的诊断,但是后续三甲医院的心脏超声未见典型心肌梗死表现,所以考虑当地医院的心脏超声可能不准确。原因一个可能是当时心包积液比较多(中量),心室收缩舒张严重受限,导致收缩幅度也明显减少;再一个加上急性心包填塞相对少见,当地医院(县级医院)水平有限,可能没有发现典型的心包填塞征象。本例患者为老年男性,既往有高血压病史,血压控制未达标,属于AD的高危人群,这类患者突发胸背痛,除了要考虑急性心肌梗死,还应警惕AD的可能。文献显示,急性AD患者大多是60~80岁的老年男性[2, 3],常见的高危因素包括:高血压、遗传性结缔组织病(如马凡综合征)、主动脉瘤等。疼痛是AD最常见的症状,以胸痛或背痛最为常见,发生率超过90%[4]。85%的患者的疼痛是突然发作[5]。疼痛可伴有晕厥、脑血管意外、急性冠状动脉综合征、心力衰竭等其他症状。
本例患者意识恢复后测血压明显降低,文献显示升主动脉夹层患者更常在发病时存在晕厥、低血压、休克,而降主动脉夹层患者更常见高血压[6]。低血压或休克可能与夹层延伸至外膜引起主动脉破裂有关,相关机制如下:1.主动脉夹层破入心包引起心包填塞;2.夹层累及主动脉瓣导致急性主动脉瓣关闭不全;3.夹层导致冠状动脉闭塞引起的急性心肌缺血或心肌梗死。右冠状动脉最常受累,偶尔可导致完全性心脏传导阻滞;4.胸主动脉或腹主动脉夹层穿过外膜时可引起血胸或腹腔积血,可导致失血性休克。晕厥在主动脉夹层患者中的发生率为5%~10%,一般是提示心包填塞或头臂血管受累[6]。IRAD研究结果显示,对比B型夹层,A型夹层患者更容易出现晕厥(19% vs 3%),而出现晕厥的AD患者更有可能存在心包填塞(28% vs 8%)和脑卒中(18% vs 4%),也更有可能发生院内死亡(34% vs 23%)[2]。本例患者胸背痛后一过性晕厥、低血压,心脏超声提示中量心包积液,考虑是主动脉根部夹层累及心包,血液破入心包腔,引起急性心包填塞导致低血压、一过性晕厥、休克,并继发急性肝肾功能不全,在低血压纠正后患者肝肾功能亦逐渐好转。
另外本患病初为中量心包积液,此后复查心脏超声积液逐渐减少,而左室射血分数却逐渐恢复,结合本院床旁心脏超声可见心包腔内随心脏收缩舒张飘动的条索样中低回声占位,考虑为心包内血液形成血栓,导致心包腔内液体成分减少,同时血栓在一定程度上可能堵塞了破口,从而减少了主动脉内血液向心包腔内的持续流入,减轻了心包填塞程度,患者的左室射血分数、血压也逐渐恢复。
AD患者体格检查常发现双上肢血压不对称,多是由于夹层内膜瓣或血肿压迫血管真腔,引起一侧锁骨下动脉肱动脉搏动减弱或消失。本例患者由于主动脉根部夹层比较小,没有影响到锁骨下肱动脉,所以没有发现双上肢脉搏减弱或者血压不对称。主动脉根部的夹层还可累及主动脉瓣,导致急性主动脉瓣关闭不全,听诊发现主动脉瓣区杂音[7]。
D-二聚体是交联纤维蛋白的降解产物,血浆D-二聚体浓度升高提示近期或持续的血管内凝血和纤维蛋白溶解[8]。D-二聚体在临床主要用于检测深静脉血栓形成、肺栓塞、DIC、原发性纤维蛋白溶解亢进等疾病。主动脉夹层时因主动脉内膜撕裂后中膜内组织因子暴露于血液,从而激活外源性凝血级联反应,导致D-二聚体明显升高。因此D-二聚体可作为急性夹层的血清标志物。但它的特异性较差,很多种临床情况下都可升高。所以D-二聚体可用于除外急性AD的患者,临界值为500 ng/ml,低于该水平基本可以排除夹层[9]。本例患者的D-二聚体水平明显升高,也支持AD的诊断。
目前临床常用主动脉CT、磁共振血管造影(magnetic resonance angiography,MRA)和TEE明确AD诊断。由于普通CT往往无法发现由内膜瓣分隔的真腔和假腔,欧美指南推荐主动脉CTA作为初始检查[10, 11]。据报道,常规CTA诊断急性主动脉夹层的敏感性为83%~95%,特异性为87%~100%[12]。CTA的主要局限在于升主动脉,检测该区域的敏感性可能降至<80%。本例患者为主动脉根部夹层,前期两次主动脉CTA均阴性,最终通过TEE明确诊断。所以如果患者疑似AD且血流动力学不稳定或临床提示升主动脉受累(如心包填塞、急性主动脉瓣关闭不全、合并急性心梗、夹层累及颈部动脉证据),建议尽量以TEE作为初始检查[13]。TEE是便携式设备,几分钟内就可得出诊断结果,且易于在急诊室使用。其敏感性高达98%,特异性在63%~96%之间[14, 15]。TEE的优点包括使用简便以及能够在床边操作。此外,TEE可以发现初始撕裂口部位、假腔血流/血栓、主动脉弓或冠状动脉受累、主动脉瓣关闭不全的程度以及心包积液。如果患者没有提示升主动脉受累的临床特征且血流动力学稳定,则应首先进行CTA。如果CT结果不明确,或是需要进一步明确夹层情况,则需要TEE或MRA检查。
经胸壁超声心动图(transthoracic echocardiography,TTE)可替代TEE但效果较差;在彩色血流多普勒和声学造影剂的协助下,TTE有时可以识别近端升主动脉夹层,但最大的用途是识别夹层并发症,例如主动脉瓣关闭不全、心包积血[16],正如本例所示。TTE的主要缺点是无法充分显示升主动脉中段和远端、主动脉弓及降主动脉,在很多患者中也无法显示其他并发症。此外,TTE的敏感性和特异性不如CTA、MRA和TEE。急性AD的紧急内科处理包括镇痛、降低血压,从而减少夹层的延展。本例为急性Stanford A型AD,属于外科急症,应尽快手术治疗,以避免出现危及生命的并发症,例如急性主动脉瓣关闭不全、心包填塞和心肌梗死。
总之,本例提示AD起病急,病情重,临床医生应尽快利用各种检查手段明确诊断,以免贻误治疗;如怀疑主动脉根部夹层,TEE可以作为首选检查方法。
利益冲突声明 所有作者均声明本研究不存在利益冲突



























