
患儿,男,1岁7个月,因“间断发热19 d,抽搐伴意识障碍18 d”就诊。
感染发热后出现急性脑病,有反复惊厥、意识障碍。入院时体格检查:意识模糊,精神反应差、阵发性哭闹,颈抵抗,四肢无自主活动、肌张力明显增高,双侧膝腱反射及跟腱反射增强,双侧巴氏征阳性。
脑脊液PMseq病原微生物高通量基因检测:人类β疱疹病毒6B型。头颅MRI示双侧丘脑、脑干、小脑等处多发斑片状异常信号。
应用激素及丙种球蛋白抗炎、血浆置换、控制惊厥、正规康复等综合治疗,定期随访。
经住院治疗未再抽搐,意识转清,可独立行走但步态欠稳。语速慢,吐字不清晰,患儿词汇量逐渐增多,理解能力较同龄儿童稍落后。
神经科;儿科;康复科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
急性坏死性脑病(acute necrotizing Encephalopathy,ANE)是一种罕见的急性、暴发性重症脑病,1995 年在日本首次报道 [1]。临床以急性病毒感染发热后出现惊厥、意识障碍及对称性多灶性脑损害为特征,病情危重进展快,预后不良,病死率高达30%[2]。常发生在病毒感染后,最常见的感染是流感病毒和人类疱疹病毒6型(HHV-6)[3],目前国外共报道8篇15例HHV-6感染相关的ANE,国内尚无相关病例报道。现将本院确诊的1例典型HHV-6感染所致的儿童急性坏死性脑病报道如下,以提高临床医师对本病的早期认识。
患儿,男,1岁7个月,因“间断发热19 d,抽搐伴意识障碍18 d”为主诉于2019年3月入住本院神经内科。患儿急性起病,感染发热后出现频繁抽搐、浅昏迷,急至当地医院给予对症治疗,因仍有意识不清、异常哭闹、四肢不能自主活动、肌张力增高转入我院。既往无抽搐病史,发病前无外伤及毒物接触史,出生史及生长发育史正常,家族史中无相关遗传病史。体格检查:意识模糊,精神反应差、阵发性哭闹,竖头不稳,不会说话、不会咀嚼,经鼻留置胃管,颈抵抗,四肢无自主活动、肌张力明显增高,足背曲角右侧约100°、左侧约130°,双侧膝腱反射及跟腱反射增强,双侧巴氏征阳性。左侧皮层拇指征阳性。
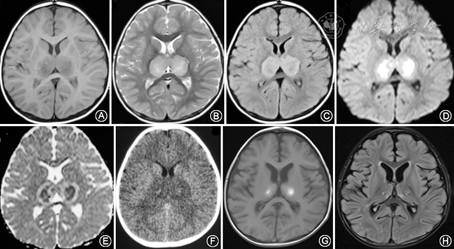
血常规检查:白细胞正常,中性粒细胞占比0.82,C反应蛋白54.6 mg/l,降钙素原115.21 ng/ml;血生化:谷丙转氨酶 210 U/L,谷草转氨酶 388 U/L,乳酸脱氢酶870 U/L,肾功能、电解质、血糖、血氨、血乳酸、丙酮酸均正常。凝血功能、铜蓝蛋白、同型半胱氨酸正常,呼吸道病原IgM抗体8项(包括甲型、乙型流感病毒)均阴性,血、尿有机酸遗传代谢筛查(-)。视频脑电图:背景活动慢、弥散性慢波。病程3 d脑脊液:白细胞计数、葡萄糖、氯化物均正常,蛋白1 410.8 mg/L(参考值0~450 mg/L),脑脊液病毒抗体、涂片及培养均(-),血及脑脊液自身免疫性脑炎抗体、AQP4、MOG抗体均阴性。病程第5天、第9天复查脑脊液常规及生化均(-)。脑脊液PMseq病原微生物高通量基因检测:人类β疱疹病毒6B型、检出序列数505,未检出其他相关病原体。头MRI见图1。

入院明确诊断后给予血浆置换,丙种球蛋白[1 g/(kg·d)×2 d],甲泼尼龙琥珀酸钠[10 mg/(kg·d)×3d],后予口服醋酸泼尼松[2 mg /(kg·d)]并逐渐减量, 阿昔洛韦针抗病毒、美罗培南及利奈唑胺抗感染,左乙拉西坦控制抽搐,氯硝西泮片改善肌张力,床旁作业疗法、手功能训练、关节松动训练等康复功能锻炼,辅以维生素B、辅酶Q10、左旋肉碱治疗。病程4 d后无发热;病程6 d后抽搐控制,意识障碍逐渐好转;病程22 d后意识转清,可逐渐经口进食、仍有四肢强直不能主动活动;病程第28天转至康复科康复治疗。半年随访时患儿未再抽搐、意识清,需扶站扶走。2年余随访时仍在间断康复治疗,患儿独走欠稳,语速慢,吐字欠清晰,词汇量逐渐增多,理解能力较同龄儿稍落后。
急性坏死性脑病1995年首先由日本学者Mizuguchi等[1]命名,诊断主要依靠典型临床症状和影像学检查。Mizuguchi等提出的ANE标准为[3]:(1)病毒感染后出现惊厥、意识障碍等急性脑病症状;(2)脑脊液白细胞计数正常,蛋白水平升高;(3)神经影像学提示多部位的对称性病灶,主要累及双侧丘脑、脑干、侧脑室周围白质、内囊、壳核、小脑髓质;(4)血清转氨酶不同程度升高,但无高血氨和低血糖;(5)排除其他类似疾病,即需与病毒性脑炎、急性播散性脑脊髓炎、中毒、Reye综合征、Wernick脑病、Leigh病、遗传代谢性疾病等进行鉴别。
ANE多见于流感季节病毒感染时,最常见感染是甲型、乙型流感病毒和人类疱疹病毒6型[3],另外其他病毒、肺炎支原体感染亦可引起,近期COVID-19也有合并ANE的报道[4]。ANE并非病毒感染直接侵袭所致,发病机制至今尚不明确,目前普遍认为中枢神经系统受累可能为细胞因子风暴所导致的过度免疫反应[5]。ANE多为散发病例,也可能存在遗传易感性[6]。目前已报道的基因变异包括RNABP2、SCN1A及CPT2可能参与了ANE的发病[6, 7, 8]。近年来RNABP2基因变异在家族性或复发性ANE中有多例相关报道,其外显率仅为40%[8],因而该病的发生可能是遗传背景和环境因素共同作用的结果。主要病理改变为局灶性血管损伤所致血脑屏障破坏、血浆渗出,最终引起脑水肿、点状出血、神经元及胶质细胞坏死[9]。本研究中1例患儿通过脑脊液病原微生物高通量基因检测示人类疱疹病毒6型,既往国外有8篇个案文献报道共15例,目前国内尚无相关报道。
ANE患者发病年龄多见于5岁以下儿童,高峰为6~18月龄,成人发病极其罕见,但也有发生于成人的报道,临床特征与儿童患者无明显差异。临床表现根据病情演变可分为前驱感染期、急性脑病期、恢复期3期[1, 2]。
前驱感染期:90%以上的患儿出现呼吸道、消化道、幼儿急疹等前驱感染症状,如发热、咳嗽、呕吐、腹泻、皮疹等。
急性脑病期:在前驱感染后1~3 d出现,多持续2~5 d,表现为频繁抽搐,多为全身强直阵挛发作,可呈惊厥持续状态;迅速出现意识障碍、去大脑强直。重症病例可合并多器官功能衰竭、弥散性血管内凝血、噬血细胞综合征等。此期病情迅速进展,约30%患者死于此期。
恢复期:多于脑病症状开始6~10 d后,以意识好转为标志,神经系统功能恢复持续数月,少于10%的患者可完全恢复,大多数患者有严重神经系统后遗症,通常运动障碍重于认知障碍[10]。本研究报道的患儿感染发热后,第2天迅速出现频繁抽搐、意识障碍,病程6天后抽搐、意识障碍逐渐好转,病程20余天意识转清,后期随访半年患儿认知反应正常,双上肢自主活动基本如常,需扶站扶走,符合ANE各期病情演变过程。
人类疱疹病毒6型在儿童早期感染时,通常会引起轻度感染,其特征是发热、易激惹、婴儿玫瑰疹(即幼儿急疹)[11],国外有儿童HHV-6感染相关的ANE没有出现皮疹的的报道[12, 13],据报道皮疹在12.5%的 HHV-6相关的急性脑病患者中不明显[14]。本例患儿病程中未出现文献报道中特异性玫瑰疹样皮疹,通过对脑脊液病原微生物高通量基因测序检测出HHV-6 DNA序列,从而证明了HHV-6和ANE之间的关联,与国外即往报道相一致[3],目前国内尚无相关病例报道。各医院实验室中的血及脑脊液病原学检测通常不包括HHV-6,这可能解释了中国报道的HHV-6感染率较低。病毒宏基因组学分析检测各种病原体较传统病毒检测方法具有优势。
ANE外周血白细胞可升高,部分血清C反应蛋白和红细胞沉降率升高,降钙素原也可以明显增高[15]。重症患者可有弥散性血管内凝血的表现。生化检查多数以血清转氨酶变化最显著、呈不同程度升高,很少出现高血氨、低血糖及电解质紊乱[1,3]。脑脊液压力可升高,细胞数目正常,大多数脑脊液蛋白水平升高,乳酸、氯化物及糖正常。本例患儿病初血常规中性粒细胞、CRP、PCT增高明显,不排除与细胞因子风暴所导致的过度免疫反应有关,具体的机制仍需要进一步探讨。病初血清转氨酶明显升高,脑脊液细胞数、糖及氯化物正常,脑脊液蛋白水平明显升高,均符合该病常见的生化及脑脊液改变。
头颅影像学的特殊改变为ANE典型特点,特征性表现为双侧对称性多灶性损害,主要累及双侧丘脑 (100%)、脑干被盖、侧脑室周围白质和小脑髓质[16, 17]。初期脑损伤表现为细胞毒性水肿, CT在脑病的早期可表现正常,一般在发病12 h后病变部位表现出对称性密度减低,MRI检查T1加权像上呈低信号、T2加权像上呈高信号,DWI和Flair呈高信号,增强后一般无强化或只有轻度强化。1周后病变内部可见亚急性出血改变,典型病变主要在双侧丘脑,由于血管外渗或淤血,CT表现为低密度区中掺杂不规则高密度影[18, 19],MRI检查T1像出现同心环状表现,即病变中心高信号、其周围呈低信号。弥散加权成像的表观弥散系数(ADC)能更好地反映病理变化,在急性期丘脑损伤的典型表现为特征性的三色版模式[18],即丘脑中央区为较正常脑组织高的ADC值,为出血坏死;其周围ADC值低,为细胞毒性脑水肿;病灶外围有比中央更高的ADC值,为血管源性脑水肿[2,18]。慢性期及恢复期病灶缩小,严重患者可出现多个囊腔(含铁血黄素沉积)、脑萎缩等[19]。本研究报道的患儿为急性起病,临床表现为病毒感染后迅速出现频繁抽搐、意识障碍、昏迷等急性脑病症状,病情演变符合ANE的进程,影像学检查提示双侧对称性多灶性损害,主要累及双侧丘脑、脑干、侧脑室周围白质和小脑髓质,尤其丘脑对称性病变在不同时间段的MRI上符合ANE典型的各期特征性改变。
综上所述,本例患者各期病情演变过程,血清转氨酶明显升高,脑脊液细胞数、糖及氯化物正常,脑脊液蛋白水平明显升高,丘脑对称性病变在不同时间段的MRI上特征性改变均符合ANE 典型特征,故诊断明确。与病毒性脑炎的区别在于脑脊液特点,脑损伤严重,但脑脊液仅有蛋白升高,细胞数和其他项目无异常改变。且病毒性脑炎发病机制为病毒直接感染所致,无血生化特征性改变,头影像学改变主要为非对称性皮层受累为主。
ANE进展快,病死率高,目前最有效的治疗包括免疫与抗细胞因子对症及支持治疗,主要包括糖皮质激素如甲泼尼龙冲击、丙种球蛋白和血浆置换治疗[20],而不是抗病毒本身。对于急性期可给予控制惊厥,降低颅内压,亚低温治疗[17],维持良好的通气和脑灌注等。对于激素治疗的时机、剂量、疗程问题尚无统一认识。本例患儿急性期给予血浆置换、丙种球蛋白[1 g/(kg·d)×2 d],甲泼尼龙琥珀酸钠[1 g/(kg·d)×2 d]抑制炎症反应,后序贯给予泼尼松[2 mg /(kg·d)]口服并逐渐减量,口服泼尼松疗程约3个月。本例患者未给予长期口服激素治疗,至近期随访2年余未见复发。
本病进展快、预后不良,幸存者大多数有不同程度的后遗症,对于病毒感染后热性疾病出现惊厥、意识改变患儿,特别是婴幼儿,应考虑到ANE可能。尽快完善颅脑影像学检查及脑脊液病原学及相关测序检查,一旦确诊可早期考虑激素、丙种球蛋白及血浆置换治疗,争取做到早期诊断、积极治疗,降低病死率及致残率。
所有作者均声明本研究不存在利益冲突



























