
患者,女,49岁,发现右侧乳房包块1年,B超示右侧乳腺实质性病灶伴多发钙化(BI-RADS 4c类),右侧腋窝实质性病灶(转移癌可能)。
患者1年前发现右侧乳房包块,1个月前包块出现疼痛,伴压痛,乳房胀痛,无乳头溢液。
外院细针穿刺细胞病理学检查结果示右侧乳腺癌及右腋下腺癌细胞。本院组织病理学检查结果诊断为乳腺混合性非特殊类型浸润癌伴棘层松解型鳞状细胞癌。
"表柔比星+环磷酰胺"2个疗程新辅助治疗后,因患者不能耐受转行"紫杉醇+曲妥珠单抗+帕妥珠单抗"6个疗程新辅助治疗,后行右乳改良根治术,术后行曲妥珠单抗+卡培他滨及放疗。
随访2个月,无复发转移
病理科;乳腺外科;肿瘤科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
乳腺棘层松解型鳞状细胞癌( Acantholytic squamous cell carcinoma, ASCC)是一种极为罕见的特殊类型乳腺癌,是化生性癌中向鳞状细胞分化的一种组织学亚型。检索PubMed数据库自1986年起仅报道12例[1,2,3,4,5,6,7,8,9],病理诊断及临床治疗经验均较为缺乏。我们报道1例经新辅助治疗的乳腺混合性非特殊类型乳腺癌(Invasive breast carcinoma of no special type, IBC-NST)伴棘层松解型鳞状细胞癌,旨在提高对这一特殊类型乳腺癌的认识,减少误诊和漏诊。
患者,女,49岁,因"发现右侧乳房包块1年"于2021年3月9日入院。患者1年前发现右侧乳房包块,1个月前包块出现疼痛,伴压痛,乳房胀痛,无乳头溢液。2021年3月3日外院B超示右侧乳腺实质性病灶伴多发钙化(BI-RADS 4c类),右侧腋窝实质性病灶(转移癌可能)。外院行右乳腺肿块及右腋下病灶细针穿刺细胞病理学检查,结果示右侧乳腺癌及右腋下腺癌细胞。既往体健。
2021年3月9日行胸部CT提示右乳包块,右腋窝增大淋巴结。钼靶提示右乳团块影伴钙化,考虑BI-RADS 4c类。腋下淋巴结超声提示右侧腋下淋巴结肿大。3月11日乳腺MRI提示右侧乳腺外上象限肿块,考虑肿瘤性病变,BI-RADS 5类;右侧腋窝淋巴结肿大。
2021年3月12日行右乳肿块粗针穿刺活检,病理结果显示:1.(右乳)乳腺浸润性癌,非特殊类型(浸润性导管癌),3级。2.免疫组化结果显示:ER(-),PR(-),HER2(2+),Ki67(+,约70%),AR(+),CK5/6(部分+),E-Cadherin(+),P120(膜+)。荧光原位杂交(Fluorescence in situ, FISH)结果显示HER2基因扩增。
新辅助治疗方案:自2021年3月16日起给予"表柔比星、环磷酰胺"2个疗程,因患者不能耐受转行"紫杉醇+曲妥珠单抗+帕妥珠单抗"6个疗程。8月16日胸部CT提示右乳包块,较前体积减小、钙化;右腋窝小淋巴结,较前明显缩小。乳腺MRI:1.右侧乳腺外上象限肿块,较前明显缩小;2.右侧乳腺及胸大肌水肿,较前大部吸收。于8月23日行右乳癌改良根治术。术后病检示:浸润性乳腺癌,化生性癌(棘层松解型鳞状细胞癌),3级。原发灶内残留最大浸润癌灶范围约1.9cm×1.2cm。右侧腋窝淋巴结19枚(0/19),其中无癌转移且伴治疗反应者1枚,无癌转移且不伴化疗反应者18枚。残留肿瘤负荷(Residual cancer burden, RCB)评估:RCB = 1.9007,RCB分级为II级(部分病灶残留)。免疫组化检测显示:ER(-),PR(-),HER2(2+),Ki67(70%),AR(-),CK5/6(+),E-Cadherin(+),P120(膜+),P63(+),P40(+),SOX10(-),GATA-3(+)。AJCCypTN分期:ypT1c ypN0。FISH提示HER2基因无扩增。治疗前、后组织病理学类型及分子分型不一致,复阅治疗前穿刺标本病理切片,复核结果为混合性癌,90%非特殊类型+10%棘层松解型鳞状细胞癌,分子分型分别为HER2阳性型及三阴性型。
术后患者因经济原因要求行单靶治疗,自2021年9月1日起行曲妥珠单抗靶向治疗3次,口服卡培他滨2片每日2次至1年,放疗1次。术后随访2个月,患者无复发转移征象。
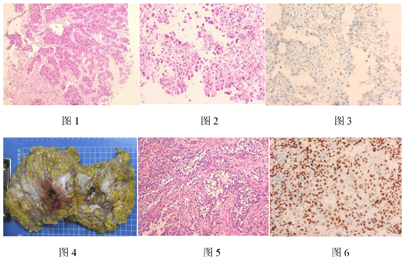

乳腺棘层松解型鳞状细胞癌是一种罕见的化生性癌。其组织学特征是由肿瘤性鳞状细胞松解、排列成不规则裂隙,形成假腺样或类似于血管肉瘤的形态。乳腺鳞状细胞癌可与其他类型的乳腺癌并存,本例穿刺标本中即为伴有IBC-NST成分的腺鳞癌模式。由于ASCC失去了鳞状细胞癌特征性的巢片状结构,形成腺管样结构,容易被误诊为真腺癌。本例穿刺组织中只诊断了NST,漏诊了ASCC成分。ASCC免疫组化显示鳞状细胞癌的标记阳性(CK5/6、P63、P40),乳腺来源标记阳性(GATA3),且多为三阴性癌(ER、PR、HER2均阴性)。本例穿刺标本经复阅可见HER2免疫组化显示出异质性表达,NST成分为2+,ASCC成分为0。由于ASCC成分较少,在穿刺组织HER2 FISH检测中亦忽略了这一异质性,将NST成分的扩增结果报告为总体结果。
本例乳腺癌新辅助治疗疗效病理评估采用了基于RCB系统的精准取材及评估方法,即结合治疗前、后影像学报告及大体所见确定瘤床方位及范围,对大体标本进行拍照绘图取材,诊断时在切片水平上进行瘤床范围还原,进而精准评估瘤床大小、细胞丰富度、原位癌与浸润癌比例、淋巴结转移等参数。在评估过程中发现治疗前、后组织学类型差异,按照科室制定的乳腺癌新辅助治疗病理评估的标准处理程序,复阅穿刺组织切片,并将剩余瘤床组织全部取材,经免疫组化证实残余肿瘤成分均为ASCC,而HER2阳性的NST成分全部退缩,提示HER2靶向治疗效果较好,但总体评价为非病理完全缓解(non-pathological complete response, non-pCR)。进而由病理科主导发起临床病理讨论,报告了这一复阅结果,乳腺外科医生调整辅助治疗方案,加用卡培他滨口服1年。
乳腺癌的异质性在新辅助治疗中的问题一直存在。本例的经验教训为在穿刺组织中应注意避免漏掉特殊的组织学类型;HER2表达的异质性应体现在诊断报告中,提醒分子病理医生结合HE及免疫组化切片进行判读;在穿刺组织诊断中可以常规联用CK5/6和p63免疫组化检测,既可以提高肌上皮标记的敏感性,又能有效筛出包括鳞状细胞癌在内的化生性癌成分。
文献报道的ASCC治疗方式主要为手术加辅助化疗,其中1例报道了具体化疗方案为蒽环联合紫杉方案[3]。5例报道了生存时间分别为4个月,5个月,6个月,16个月和38个月。
总之,乳腺ASCC是一种极为罕见的化生性癌,通常为三阴性乳腺癌,侵袭性高,预后差,明确诊断依赖组织病理学及免疫组化检测,治疗方式为手术加辅助化疗。这一组织学类型的乳腺癌发病率低、治疗经验不足,尚需更多病例的实践积累。
所有作者均声明本研究不存在利益冲突



























