
患者,女性,50岁,因"剑突下隐痛1个月余,胸痛1周"入院。患者1个月余前自觉剑突下隐痛,1周前觉胸骨柄处胀痛。于外院行超声及胸部CT检查提示:肝左叶肿物,胸骨转移瘤可能。既往有结核病史。
剑突下隐痛及胸骨柄处胀痛呈持续性。查体示剑突下轻微压痛、反跳痛,胸骨柄处肿胀伴压痛阳性。
根据MRI和PET-CT检查结果,肝肿物初步诊断为肝恶性肿瘤,肝细胞癌可能,胸骨柄处病灶考虑结核所致。最终肝肿物由术后病理确诊为肝上皮样血管平滑肌脂肪瘤。
腹腔镜复杂肝癌切除术。
术后1年患者复查腹盆腔CT及MRI,未提示肿瘤复发转移。
放射科;核医学科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
肝上皮样血管平滑肌脂肪瘤(Hepatic epithelioid angiomyolipoma, HEAML)是一类具有恶性潜能的间叶源性肿瘤,是肝血管平滑肌脂肪瘤(Hepatic angiomyolipoma, HAML)的特殊类型,通常缺乏脂肪组织。好发于年轻女性,男女比例约1:5,肿瘤指标常为阴性。由于其缺乏典型的临床症状和影像学表现,临床上对其认识不足,术前易与其他肝肿瘤混淆。本文报道肝上皮样血管平滑肌脂肪瘤误诊为肝细胞癌1例,旨在提高对本病的认识及鉴别诊断能力,减少误诊。
患者,女,50岁,因"剑突下隐痛1月余,胸痛1周"入院。患者1个月余前无明显诱因下自觉剑突下隐痛,持续性,可忍,1周前自觉胸骨柄处胀痛,无发热寒战,无腹胀腹泻。患者2周前外院查肝胆胰脾彩超提示:肝左叶低回声占位性病变,5 d前查胸部CT提示:胸骨骨质破坏,转移瘤可能。当时未进一步诊治,后我院就诊。既往有肺结核,肠结核16年余,胸骨结核切除术6年余,自诉结核已治愈,现未服抗结核药物。否认病毒性肝炎等其他传染病史。
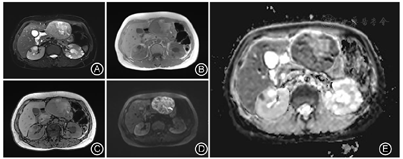
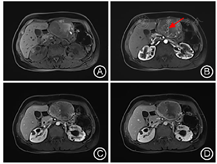
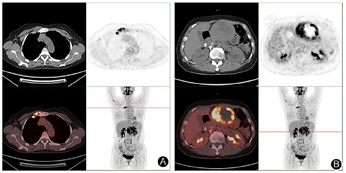
患者入院后查肝胆胰脾彩超提示:左肝混合回声团,肝癌待排。实验室检查提示:乳酸脱氢酶785 IU/L,乙肝核心抗体定量6.16S/CO,肿瘤指标无殊。查体:腹平软,剑突下轻微压痛、反跳痛。胸骨柄处肿胀明显,压痛阳性。MRI增强检查提示:肝左外叶占位,恶性肿瘤(肝细胞癌可能大)伴出血考虑(图1,图2)。为明确肿瘤转移情况,患者完善18F-FDG PET-CT检查提示:1.左肝外叶软组织肿块伴FDG代谢环形增高,首先考虑肝脏恶性病变;2.胸骨结核术后,胸骨柄右前方软组织结节伴钙化,首先考虑结核浸润(图3)。



患者术前诊断仍不明确,首先考虑肝恶性肿瘤,临床上常规需与以下三种疾病鉴别:1.肝细胞癌:早期缺乏典型临床表现,中晚期可出现肝区疼痛、腹部肿块、食欲减退、黄疸等全身或消化道症状,如患者有肝病病史,甲胎蛋白≥400 ng/ml,影像学上有"快进快出"、"延迟期假包膜"等征象即可诊断;2.肝内胆管细胞癌:CA199增高,AFP阴性,多无肝炎病史和肝硬化表现,病灶多位于肝左叶,常可发现肝内扩张胆管,增强后延迟强化。3、肝转移瘤:有肝外原发性肿瘤,影像学上可有"牛眼征",常有肿瘤指标异常。
经手术组医生讨论决定,拟施行"腹腔镜复杂肝癌切除(左肝外叶联合部分IV段)"术。术中见腹腔内无明显腹水、粘连致密,予超声刀仔细分离,肝脏质地正常,肝左叶II、III段10×10cm大小质硬肿块。门静脉未见癌栓。肝门部未见肿大淋巴结,腹腔内未见结节性转移病灶。
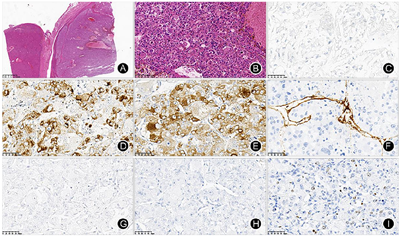
手术大体标本示:送检"左肝外叶联合部分Ⅳ段"切除标本,距烧灼面切缘2 cm见一白灰黄肿块,大小约5 cm×3.5 cm。镜下HE染色病理示:上皮样肿瘤细胞呈实性巢状生长,见大片坏死出血区,见脉管内瘤栓,肿瘤细胞胞浆丰富,细胞核大,核仁明显,部分核大畸形(图4B)。免疫组化:Hepatocyte(-)、AFP(-)、Arginase-1(-)、Glypican-3(-)、CEA-R(-)、CD34(+)、Galectin-3(-)、CK7(-)、CK19(-)、S-100(-)、Melan-A(+)、HMB45(+)、Ki-67(<3%)(图4C~I)。最终病理诊断:肝上皮样血管平滑肌脂肪瘤伴大片坏死及脉管内瘤栓。术后患者一般情况可,予带药出院。患者1年后复查腹盆腔CT及MRI,未见肿瘤复发和转移。

HAML是一种少见的间叶来源肿瘤,主要由不同比例的脂肪组织、平滑肌和异常血管组成。2000年Yamasaki等[1]首次报道了1例完全由上皮样细胞构成的HAML,其内缺乏脂肪细胞,命名为HEAML。HEAML好发于中青年女性,男女比例约1:5,中位年龄44岁[2]。发病机制尚不清楚,与肝硬化、肝炎、肿瘤家族史无特异相关性,AFP等肿瘤指标阴性[3]。临床症状与体征无特征性,多为体检发现,肿瘤较大时可因触及腹部包块、引起腹痛或肿瘤破裂等并发症就诊[4]。本例性别及年龄与文献报道基本相符,肿瘤指标无殊,仅乳酸脱氢酶升高,无特殊指向性,临床上仅表现为剑突下隐痛。
大体上观察,HEAML无包膜,但与周围组织分界清楚,在体积较大的肿瘤中常见出血、坏死和囊变,缺乏或是仅含极少的成熟脂肪成分,血管丰富。镜下主要由上皮样平滑肌细胞构成,梁索状排列,多核瘤巨细胞常见,异型性明显,但核分裂象相对罕见,常出现肿瘤细胞以血管为中心的放射性分布[2]。目前认为HEAML是血管周上皮样细胞瘤家族的一员,这类肿瘤的共同特点是表达黑色素细胞标志物HMB-45和Melan A[5]。本例表达HMB45、Melan-A,可符合HEAML的病理特点。大多数HEAML是良性的,恶性HEAML少有报道。Nguyen等[7]提出良恶性HEAML的鉴别诊断:细胞学异型性;凝固性坏死;大肿瘤(> 10 cm);CD117阴性;侵袭性临床表现[6]。CD34和Ki-67阳性表达提示HEAML的恶性行为。本例HEAML的CD34和Ki-67均为阳性,表明其潜在恶性可能。
由于HEAML内缺乏或极少含脂肪组织,MRI T1WI及同反相位上病灶内脂肪不易发现,当其增强表现与肝细胞癌(Hepatocellular carcinoma,HCC)重叠时,两者的鉴别尤为困难。本例HEAML病灶实质在反相位上未见信号减低,增强后延迟期信号低于周围肝实质,且可见环形强化的假包膜,因而容易在MRI影像表现上想到HCC的诊断。
有研究显示,HEAML富含迂曲扩张的厚壁血管,即增强后病灶内点条状血管影对两者的鉴别诊断有重要意义[8,9]。HCC的肿瘤血管主要为肝动脉,轮廓不光滑,血管不成熟、不连续,欠规则,走行僵直,门静脉期不显示,而HEAML中心血管为畸形静脉,表现为迂曲、流畅、光滑、粗细不等的强化血管,即肿瘤内"中心强化血管征",为HEAML特征性表现。因HEAML的肿瘤血管类型及含量不同,肿瘤的强化方式多样,主要分为两种:"快进快出"和"快进慢出"。在动脉期,由于HEAML富含大量血管和血窦,多数HEAML表现为在动脉期明显不均匀强化,这些血管多为静脉性血管,病理上证实为动脉期早显的静脉,影像上易误认为肿瘤供血动脉(图4A)。在门静脉及延迟期,血管网丰富、血管较细、管壁较薄、血流速度较快的病灶强化程度迅速降低,表现为"快出";少或无血管、血管较粗、管壁较厚的病灶,显像剂扩散至血管外间隙需要较长时间,表现为"慢出"[2,8]。本例病灶门静脉期肿瘤实质进一步强化,延迟期强化低于肝实质,可符合"快进快出"的强化模式,但又与门静脉期强化即低于肝实质的典型HCC影像表现有所不同。此外,当HEAML病灶足够大时,可压迫周围肝实质形成不完整的假包膜,病理上主要是由压缩的肝实质、稀疏的纤维化组织及小血管构成。虽然HEAML和HCC均可见到假包膜,但HEAML的假包膜出现的概率明显低于HCC[8]。Liu等[9]在分析比较HEAML和HCC的MRI特征研究中,发现HEAML中仅有20%出现假包膜,而HCC中则多数有假包膜征象(78.8%)。
以往文献关于使用18F-FDG PET/CT评估HEAML的报道有限。一些文献提出伴有肿瘤内出血的HEAML表现为FDG高摄取[10],坏死和FDG高摄取往往提示EAML的肿瘤生物学侵袭性[11]。本例PET-CT图像示病灶实质部分FDG代谢明显增高,内部坏死,可能提示其恶性潜能。FDG高摄取容易与其他FDG高摄取的肝恶性肿瘤相混淆,但在与HCC的鉴别诊断上有一定价值。低级别HCC由于葡萄糖转运蛋白-1表达水平较低,因此低级别HCC的FDG摄取较低。而高级别HCC具有更高的葡萄糖转运蛋白1表达和己糖激酶活性,FDG摄取有所增高,但总体仍低于其他肝原发恶性肿瘤[12]。
综上所述,HEAML与HCC的影像表现虽有交叉重叠之处,但"中心强化血管征"和强化模式的差别,以及在18F-FDG PET-CT上FDG摄取的不同,结合无肝炎、肝硬化病史,肿瘤指标阴性等临床资料,在影像上可以进行初步鉴别诊断,最终诊断仍有赖于病理。
所有作者均声明本研究不存在利益冲突



























