
患者,男,54岁,因"发现左上臂软组织肿物8个月"为主诉就诊。
患者8个月前发现左上臂出现一肿物,质软,无疼痛,不伴有关节红肿。6月前发现肿物逐渐增大,活动时有轻度不适感,2月前自觉活动过多时肿物出现疼痛。
左上臂MRI检查:左侧上臂中段内侧皮下可见不规则长T1、长T2信号结节影,大小约2.6cm×2.6cm,增强扫描呈明显均匀强化,诊断为软组织恶性肿瘤,予以"左上臂肿物切除术"。术后病理:标本切片显示瘤细胞呈梭型,大小形态一致,胞浆淡染,核仁明显,核分裂象少见,异型性程度低;免疫组织化学S-100(+)、HMB-45(+)。病理诊断为左上臂软组织透明细胞肉瘤。
入院后完善相关检查,给予"左上臂肿物切除术",术后行吡柔比星、异环磷酰胺化疗方案,给予止吐、护肝保肾、升白细胞等抗化疗副反应药物治疗。3个月后复发,再次行"左上臂肿物切除术",术后行阿霉素、异环磷酰胺化疗方案,并给予美司钠静点预防异环磷酰胺泌尿道毒性,盐酸阿扎司琼预防放射治疗。
3个月复发术后定期随访,1年后再次复发,患者于外院进行保守治疗,最终治疗无效死亡。
肿瘤科;骨科;影像科;病理科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
软组织肉瘤是一组起源于间叶组织的恶性肿瘤,其组织亚型分类较多,异型性明显和高度恶性是其主要特征。而软组织透明细胞肉瘤(clear cell sarcoma,CCS)是一种罕见的黑色素分化的软组织恶性肿瘤,约占软组织肉瘤的1%,首次于1965年由Erzinger报道[1]。肿瘤多见于中青年人,多位于四肢远端的肌腱和腱膜,尤其是足部、踝部多见。其发病率低,易误诊为良性肿瘤,但恶性程度高,易转移和复发,因此早期诊断尤为重要。本文报道一例左上臂CCS,对其临床特征、病理特点、影像表现及诊断鉴别进行了讨论,旨在提高临床对本病的认识。
患者,男,54岁,因"发现左上臂软组织肿物8个月"为主诉来院就诊。患者8个月前发现左上臂出现一肿物,质软,无疼痛,不伴有关节红肿。6月前发现肿物逐渐增大,活动时有轻度不适感,2月前自觉活动过多时肿物出现疼痛。在院进行了"左上臂肿物切除术",术后病理诊断为左上臂软组织透明细胞肉瘤,术后进行常规化疗。随访3个月后发现左上臂软组织肿物,MRI提示复发,再次入院行"左上臂肿物切除术",术后病理诊断为左上臂软组织透明细胞瘤。
体格检查:患者左上臂可见一肿物凸起,局部稍红。肿物质韧,张力可,呈球形,大小约2.5cm×2.5cm×2.0cm。肿物表面光整,无压痛,肿物不可推动。肿物周围无红肿,关节屈伸活动无异常,余肢体未见明显异常。
辅助检查:左上臂MRI提示:左侧上臂中段内侧皮下可见不规则长T1、长T2信号结节影,呈分叶状,PD抑脂高信号,与邻近血管、肱三头肌内侧头分界不清,大小约2.6cm×2.6cm。增强扫描病灶呈不均匀明显强化,其内可见低强化区(图1A,图1B,图1C,图1D)。术后3月左上臂MRI提示:左上臂中段内侧皮下可见类圆形稍长T1、长T2信号结节影,PD抑脂高信号,边界清,与邻近血管、肱三头肌内侧头分界清,大小约2.3cm×1.6cm(图2A,图2B)。余肱骨上臂肌肉内未见异常信号影。胸部CT平扫+增强未见明显异常。肝功:乙肝病毒表面抗体196.73(0~0.06IU/ml),乙肝病毒e抗体0.01(1~9999 S/CO),乙肝病毒核心抗体11.35(0~1 S/CO)。
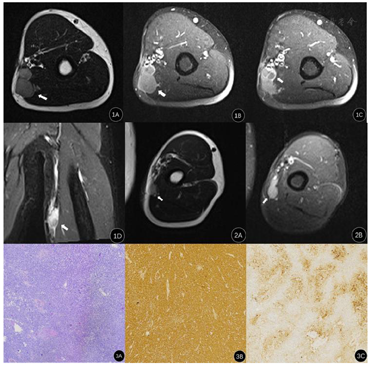

左上臂软组织透明细胞肉瘤。
患者8个月前左上臂发现一肿物,质软,无疼痛,不伴有关节红肿,未行特殊处理,近2个月发现肿物逐渐增大,活动过多后肿物出现疼痛。经MR检查诊断为软组织恶性肿瘤,入院行"左上臂肿物切除术",术中于肱二头肌及肱三头肌相邻部探及一类圆形肿物,质硬,表面不光整,大小约3cm×2.5cm,压迫肌肉,侵及深筋膜并与周围组织粘连明显。于正常组织内仔细分离后取部分肿瘤组织送检,术中快速冰冻病理检查结果:送检组织考虑恶性神经瘤。将肿瘤完全切除,并切除肿瘤周围1.5cm-2.0cm组织,术后病理及免疫组织化学诊断为左上臂软组织透明细胞肉瘤(图3A,图3B,图3C)。术后行吡柔比星、异环磷酰胺化疗方案,给予止吐、护肝保肾、升白细胞等抗化疗副反应药物治疗。3个月后随访患者又发现左上臂肿物,再次入院行"左上臂肿物切除术",并扩大范围切除肿瘤周围2cm-3cm组织,术后病理为软组织透明细胞肉瘤,考虑复发。术后更改化疗方案为阿霉素、异环磷酰胺化疗方案,并给予美司钠静点预防异环磷酰胺泌尿道毒性,盐酸阿扎司琼预防放射治疗,细胞毒性药物化疗引起的恶心呕吐。
复发术后随访1年,再次复发,患者于外院采取保守治疗,最终治疗无效死亡。
以"软组织透明细胞肉瘤""软组织肿瘤""透明细胞肉瘤"为关键词在中国期刊全文数据库CNKI、万方数据知识服务平台、PubMed建库至2021年10月进行检索国内、外文献。中文报道62篇,外文报道到21篇,选取目前较新报道的软组织透明细胞肉瘤患者的临床资料(表1)。

总结软组织透明细胞肉瘤的部分文献报道和本例患者的常见临床特征
总结软组织透明细胞肉瘤的部分文献报道和本例患者的常见临床特征
| 项目 | 文献 | ||||
|---|---|---|---|---|---|
| 2020年Vidya Rao等[2] | 2016年罗振东等[6] | 2015年冯旭琴等[4] | 2000年Beuckeleer等[15] | 本例 | |
| 起病年龄 | 18-56岁 | 15-59岁 | 13-54岁 | 14-75岁 | 53岁 |
| 性别 | 男8例,女8例 | 男2例,女3例 | 男8例、女7例 | 男11例、女10例 | 男1例 |
| 发病部位 | 足踝部5例、膝关节2例、前臂2例、腕部2例、大腿4例、胸椎旁1例 | 肩1例、足底1例、大腿1例、肘部1例、腰部1例 | 足部4例、前臂3例、大腿2例、躯干2例、膝关节2例、胫骨1例、直肠1例 | 腹股沟1例、臀部1例、大腿3例、膝关节2例、小腿3例、足6例、腋窝1例、肩1例、肘1例、手2例 | 左上臂 |
| 大小 | 1.5-6.8cm | 1-5cm | 2-6cm | 1.7-10cm | 2.6cm |
| 症状 | 缓慢性生长、轻微疼痛或压痛的肿块。 | 肿物伴疼痛,1例肺部转移,1例淋巴结转移,1例关节活动受限。 | 包块或结节,伴疼痛5例、跛行1例、腹泻1例。 | - | 无疼痛、逐渐增大,活动时有轻度不适感。 |
| 影像检查 | - | T1WI上3例信号稍高于肌肉信号、2例合并出血呈高低混杂信号、1例病灶内见液液平。T2WI上1例呈均匀高信号、4例呈混杂信号。增强扫描1例明显均匀化,4例明显不均匀强化。 | 软组织内深部结节,大小不等,呈分叶状,边界清晰不规则,T1WI上大部分高于肌肉信号,T2WI上呈高信号。5例侵犯筋膜,2例侵犯关节囊,局部见炎症反应。 | TIWI上3例呈等信号、7例呈低信号、7例轻微高信号。T2WI上3例低信号、6例等信号、9例高信号。增强T1WI,4例中度强化,10例明显强化。86%的肿块内部均匀,67%的病灶边界清晰,10%和5%的病灶出现骨破坏和瘤内坏死。 | 不规则长T1、长T2信号,PD抑脂高信号。增强扫描呈明显不均匀强化。 |
| 病理切片 | 瘤细胞呈多边形、梭形。核仁嗜酸或嗜双色性。胞质淡染或透明,富含糖原,偶见黑色素及含铁血黄素颗粒。瘤细胞无明显异型性,核分裂少见。 | 呈短梭形细胞,大部分肿瘤细胞分布均匀。胞核呈囊泡状,核仁明显,胞浆透明、淡色或嗜酸性,胞浆内可见局灶性黑色素。肿瘤内存在数量不等的巨细胞,偶见异型多形性核细胞。 | 形态基本一致,呈多角形或梭形细胞。嗜酸性透明胞质,细胞核呈空泡状,核仁明显,核分裂少见 | 13例铁血黄素沉积、4例病灶内出血、9例瘤内坏死。嗜碱性核仁,核分裂稀疏。胞质透明,多核巨细胞遍布整个肿块。 | 瘤细胞呈梭型,大小形态一致,胞浆淡染,核仁明显,核分裂象少见,异型性程度低。 |
| 免疫组化 | S-100阳性率100%、HMB-45阳性率93%、Melan-A阳性率50%- | S-100阳性率100%、HMB-45阳性率90.9%、vimentin阳性率100% | S-100阳性率93%、HMB-45阳性率84%、Melan-A阳性率53% | S-100阳性率100%,HMB-45阳性率100% | S-100(+)、HMB-45(+)、Melan-A(+) |
| FISH检测 | 2例 | - | 1例 | 4例 | - |
| 随访 | 8例局部复发,2例带瘤生存、4例无病生存、2例死亡 | 1例局部复发、1例肺转移、1例淋巴结转移 | 6例死亡、2例带瘤生存、6例无病生存、1例失访 | - | 死亡 |
注:(-)未表述
软组织透明细胞肉瘤是一种高度恶性的软组织肿瘤,临床报道较少,由于内含有黑色素成分WHO将其纳入恶性黑色素瘤的一种亚型,但其与黑色素瘤有实质性区别。目前该肿瘤主要认为起源于神经嵴的恶性肿瘤,主要依据是其免疫组化显示S-100和HMB-45阳性表达[2]。CCS多位于中青年人四肢远端,本例位于左上臂,目前还未有此处的病例报告。肿瘤早期生长缓慢,但后期可迅速增长,临床症状为逐渐增大的包块,一半的患者会有触痛感[3]。该病临床预后差,容易发生淋巴结和肺部的转移,术后局部复发率高。
CCS多为边界清晰的结节状、分叶状肿块,光镜下瘤体细胞呈梭型,常成巢状、腺泡状排列。瘤体胞浆丰富,淡染,可见黑色素颗粒。核仁大而明显,嗜酸性或嗜双性。瘤细胞核分裂少见,异型性程度低。瘤组织可见具有黑色素分化的细胞,免疫组化S-100蛋白阳性率为93%-100%,HMB-45阳性率为86%-97%[4],故一般检查难以与黑色素瘤相鉴别。分子遗传学上多数CCS存在t(12:22)(q13:q12)染色体易位导致EWS-ATF-1基因融合[5],促进黑色素转录因子的表达。
CCS的影像表现,在CT上表现为结节状或类圆形的软组织密度影,边界尚清,常误诊为良性软组织肿瘤。在MRI上,T1WI肿瘤信号与肌肉相似,呈中等偏低信号,T2WI抑脂呈高信号,PD呈高信号。瘤体较大者内部信号不均匀,部分瘤体周围可见斑片状高信号,与肿瘤侵及肌腱和腱膜有关。增强扫描呈明显强化,其内可见片状未强化的低信号,可提示瘤体内囊变、出血和坏死[6]。CCS还因内部黑色素含量的不同在MRI上有不一样的表现[7]。当黑色素含量少时,在T1WI上与肌肉信号相等或略低,在T2WI上为高信号。当黑色素含量多时,在T1WI上高于邻近肌肉信号,在T2WI上信号减弱,这与恶性黑色素瘤类似。
CCS主要应与常见的软组织肿瘤相鉴别诊断:①恶性黑色素瘤:常见于皮肤和口腔等表浅部位,而CCS位置较深,常侵及肌肉和肌腱。电镜下黑色素瘤体胞浆内可观察到黑色素小体,核分裂明显。在MRI上黑色素瘤表现为经典的短T1、短T2信号[8],而CCS的信号取决于胞质内黑色素含量多少,大多数CCS黑色素含量少表现为长T1、长T2信号。免疫组化黑色素瘤的S-100和HMB-45阳性,与CCS相同无鉴别价值。分子遗传学上染色体易位常发生于7号和8号染色体[9],BRAF基因突变常见。②滑膜肉瘤:同样好发于四肢远端的肌腱和腱膜,瘤体以梭型细胞排列的腺状结构,与CCS形态学上类似,其MRI信号与黑色素含量少的CCS相仿,但其免疫组化S-100和HMB-45表达阴性[10],可与CCS鉴别。③恶性上皮样神经鞘瘤:常包绕肌肉间神经生长,不侵犯肌腱和腱膜。MRI表现为T1WI等信号,T2WI等或稍低信号,而CCS大部分在T2WI抑脂序列呈高信号。在免疫组化上瘤细胞只表达S-100,不表达HMB-45[11]。
关于CCS的治疗。目前主要以手术切除为主,局部病变的患者因尽量扩大切除范围,术后辅以放疗、化疗和靶向治疗可以减少局部复发率。常用的放疗方案采用三维适形3D-CRT、调强IMRT照射,剂量60-70Gy,可局部控制病情。化疗方案与黑色素瘤方案类似[12],包括:AIM(阿霉素+异环磷酰胺+美司钠),MAID(阿霉素+异环磷酰胺+美司钠+达卡巴嗪),蒽环类化疗药联合异环磷酰胺、铂类药物等。靶向治疗作为治疗CCS的新领域,主要方案有:酪氨酸激酶抑制剂(安罗替尼、克唑替尼、索拉非尼)作用于血管内皮生长因子,阻止信号传导通路的级联反应。维罗非尼作用于BRAF基因突变的患者[13]。本例患者以手术治疗为主,术后辅以一线化疗方案。CCS的预后较差,由于肿瘤生长部位较深,毗邻重要血管神经,难以做大规模的切除,手术切除不彻底是导致局部复发的重要因素。患者5年和10年生存率为72%和53%[14]。
综上所述,软组织透明细胞肉瘤常见于中青年四肢深部组织,恶性程度高,早期易淋巴结和肺部转移,术后复发率高。由于本研究仅报道1例CCS,存在一定局限性,尚需较多样本病例研究,同时对于临床疑似患者可结合临床表型、影像学检查和病理生化检查,早期进行手术治疗,术后辅以放疗、化疗及靶向治疗,长期随访。
本研究所有作者均声明不存在利益冲突



























