
患者女,47岁,因"发现颅内病变20年,抽搐一次"入院。
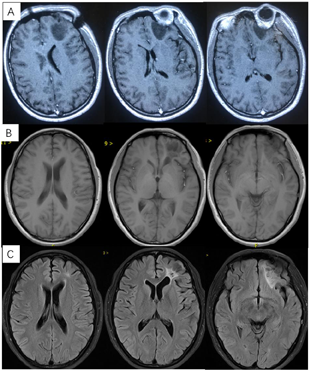
患者20年前体检时发现颅内占位性病变,行伽玛刀治疗,间断复查,病情稳定。20天前患者无明显诱因出现抽搐一次,伴意识丧失,持续约15分钟后逐渐恢复。入院查体:神志清楚,对答切题。双侧瞳孔等大等圆,直径3mm,对光反射灵敏。四肢肌力肌张力正常。生理反射存在,病理征阴性。
MR示左侧额叶占位性病变,倾向于高级别胶质瘤。术后常规病理示(左额叶)胶质母细胞瘤(WHO Ⅳ级)伴局部坏死,IDH突变型。分子病理结果显示IDH1 R132H突变,1p19q无共缺失,MGMT启动子甲基化阳性。综上诊断为继发性胶质母细胞瘤,IDH突变型。
术后MR及11C-MET PET/CT复查发现残留肿瘤病灶,给予同步放化疗。放疗结束后复查PET/CT,并对残留病灶推量放疗,后口服替莫唑胺辅助化疗半年。放疗结束后7个月余出现假性进展,安维汀治疗后缓解。8个月余后出现病情真性进展,行PD-1抗体免疫治疗,2个月后复查PET/MR提示疗效不佳,后改为口服安罗替尼靶向治疗,半年后复查PET/MR提示病变活性受抑。
受疫情影响无法按期治疗和复查,后合并肺部感染,于2020年8月去世。
神经外科;肿瘤放化疗科;放射科;核医学科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
胶质瘤是指起源于神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,WHO中枢神经系统肿瘤分类将胶质瘤分为低级别与高级别胶质瘤。近年来在组织形态学诊断的基础上,强调分子分型指导胶质瘤个体化治疗及临床预后判断。高级别胶质瘤的侵袭性强,容易复发,免疫治疗、靶向治疗等新的治疗手段逐渐涌现。治疗后如何鉴别复发与治疗后反应、评估疗效都是临床关注的重点,却也是影像学诊断的难点,传统MR存在较大局限,MR功能成像和PET分子影像具有较好的应用前景。
患者20年前患者体检时发现颅内占位性病变,行伽玛刀治疗,间断复查,病情稳定(图1)。20天前患者无明显诱因出现抽搐一次,伴意识丧失,持续约15分钟后逐渐恢复,至我院门诊行MR示"左侧额叶占位性病变",门诊以"颅内占位性病变"收治入院。

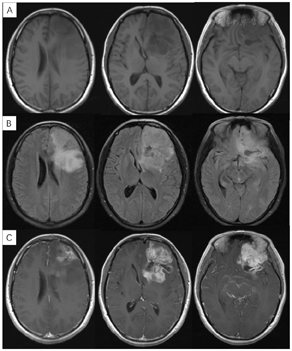
入院体格检查:T:36.8℃,P:69次/min,R:19次/min,BP:125/88 mmHg。专科体格检查:神志清楚,对答切题。双侧瞳孔等大等圆,直径约3 mm,对光反射灵敏。四肢肌力肌张力正常。生理反射存在,病理征阴性。既往无特殊病史。辅助检查:我院门诊MR示左额叶占位性病变(图2),倾向于高级别胶质瘤。

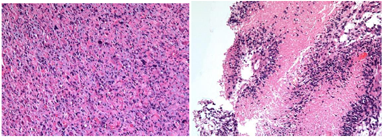
入院完善术前检查后于2017年6月7日行左额叶肿瘤切除术,术中见左侧额部约4cm×5cm大小占位,与上矢状窦、大脑镰相邻,颅底硬膜受侵犯,肿瘤质地软,呈鱼肉样外观,血供丰富,与周围脑组织分界不清。术后病理示:(左额叶)胶质母细胞瘤(WHO Ⅳ级)伴局部坏死,IDH突变型(图3)。免疫组化染色示肿瘤细胞:GFAP(部分+),S-100(+),Vimentin(+),Olig2(+),Syn(部分+),NF(灶状+),IDH(+),P53(+),ATRX(-),D2-40(-),NeuN(-),EMA(-),Ki67(热点区域Li: 15%)。分子病理结果显示:IDH1 R132H突变,TP53 R273C突变,ATRX野生型,TERT野生型,1p/19q无共缺失,MGMT启动子甲基化阳性(66%)。鉴于患者年龄相对年青,20年前有原位(额叶)脑肿瘤伽马刀治疗病史,IDH1基因突变,考虑诊断为继发性胶质母细胞瘤,IDH突变型。

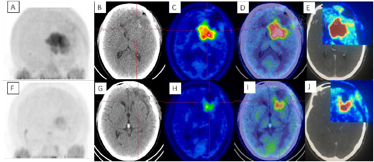
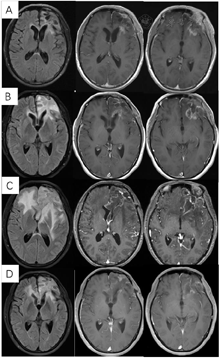
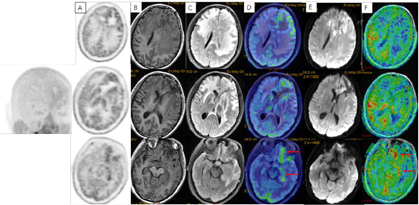
术后3周患者就诊于头颈肿瘤放化疗科,专科查体:左眼睑下垂,神清,言语清晰,伸舌居中,双侧瞳孔等大等圆,对光反射存在,四肢感觉活动可,肌力肌张力正常。2017年7月MR(图4)示左额叶术后改变伴出血,病灶内侧部分考虑肿瘤残留可能。为了更好地评估术后残留病变范围和制定放疗计划,患者行11C-MET PET/CT检查(图5A-D),结果示左侧脑室前角旁-左侧基底节区团块状稍高密度影,蛋氨酸代谢异常增高,考虑肿瘤残留。参照2016 ESTRO-ACROP指南[1],继发性胶质母细胞瘤放疗GTV靶区需包含术腔、T1增强上的强化区域及T2 FLAIR上的高信号区域,术后PET/CT显像所示的氨基酸代谢活跃病灶被包含在GTV之内(图5E)。患者于2017年7月始行左额叶病灶放疗(PTV 60Gy/30F,同步口服替莫唑胺化疗75mg/m2,qd)。结束后复查PET/CT(图5F-I)示病变范围明显缩小,代谢程度较前减低,左额叶少许病变存活,遂对残留病灶局部放疗加量(GTV如图5J,6Gy/3F)。放疗过程顺利,期间出现Ⅲ°白细胞减低,予以升白细胞治疗后好转出院。后于2017年10月起口服替莫唑胺辅助化疗(150~200mg/m2,d1-d5,q28d),期间规律复查。
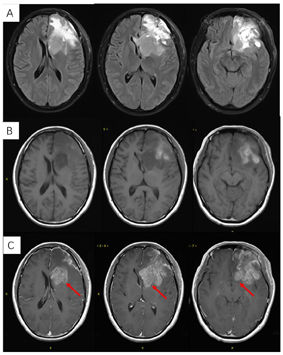


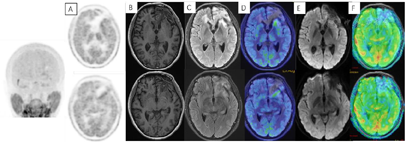
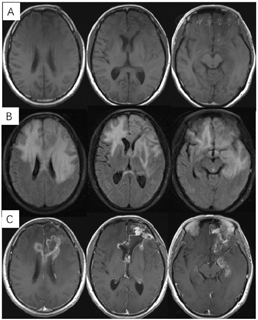
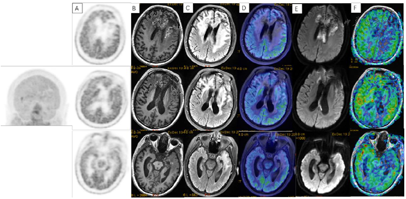
2018年3月、6月MR复查发现病灶范围逐渐增大(图6),提示不除外复发可能。患者除了轻微头痛之外并无明显不适,临床考虑假性进展,予安维汀100mg治疗后症状好转。2018年8月复查11C-MET PET/MR显像未见明显代谢增高病灶,证实为假性进展(图7)。2018年11月复查未见明显肿瘤复发,2019年3月2日MRI复查(图8)再次提示病变增大,考虑肿瘤进展。2019年3月行PD-1单抗(拓益)治疗,治疗过程中患者出现行走不稳,1月后患者不慎跌倒,外院就诊行颅脑CT未见明显出血。期间发现患者肝功能异常,给予护肝治疗后好转。2019年5月复查PET/MR(图9)提示左侧额叶前下部、左侧海马区及左侧颞叶前部蛋氨酸代谢较前次增高,其中左侧海马及左额叶直回ASL灌注相对增高,考虑复发可能,免疫治疗后存活。遂停用免疫治疗,根据患者全基因组测序结果选择靶向药物安罗替尼治疗(主要针对VEGFR、PDGFR、FGFR、c-KIT多个靶点),2019年12月复查PET/MR(图10)提示病变活性受抑。电话随访得知患者因武汉疫情影响无法按期治疗和复查,后合并肺部感染,于2020年8月去世。





本病例患者由低级别胶质瘤发展为高级别胶质瘤,结合分子分型诊断继发性胶质母细胞瘤。虽然手术后残留病灶较多,但经放化疗后效果显著。复发后尝试免疫治疗,效果不佳,后根据全基因组测序结果改用靶向治疗。整个治疗过程中依从性良好,规律复查,总生存期达3年余。回顾患者的诊治过程,可谓险象环生,几次MR复查都提示病变增大,在假性进展、复发后疗效评估和药物调整几个关键节点经PET/MR检查后得以拨云见日。
基于传统MR的RANO标准仅从FLAIR水肿范围、T1强化范围以及有无新增病灶进行评估,存在一定局限性。病情进展定义为:在激素用量不变或增加的情况下,增强病灶两垂直直径的乘积之和增加>25%;除外其他合并症因素后非增强病灶显著增大;出现任何新发病灶;非可测量病灶出现明显的进展;临床症状显著恶化;临床死亡[2]。约20%的胶质母细胞瘤患者同步放化疗后出现假性进展,多见于放化疗后3个月内,少数见于10个月内,常表现为原强化范围增大,但临床症状无进展,继续原方案治疗复查标准无变化或变小[3] 。其机制可能与放化疗后血管内皮细胞死亡、凋亡导致血管通透性增加有关,因此需要结合临床谨慎判断,4周后复查以确定为假性进展还是真性进展。放射性坏死多见于放疗6个月后,亦表现为病灶范围增大,强化程度增加,需要与肿瘤复发鉴别。对于免疫治疗、靶向治疗而言情况更为特殊,例如免疫检查点抑制剂治疗过程中肿瘤内细胞毒性T细胞浸润可导致假性进展,随后肿瘤负荷减轻,如果对假性进展认识不足,可能低估药物的疗效,导致对过早终止有效治疗的药物[4]。
近年来新的影像技术的革新弥补了传统结构MR的不足,例如以弥散加权(DWI)、灌注加权(PWI)、波谱成像(MRS)为代表的MR功能成像[5,6]和以11C-MET 、18F-FET为代表的PET氨基酸代谢显像[7,8,9]都可以从不同的角度反映脑肿瘤的生物学特征。以鉴别肿瘤进展和治疗后改变为例,文献报道传统MRI汇总灵敏度和特异度分别仅约68%和77%,DWI汇总灵敏度和特异度分别约71%和87%,动态磁敏感增强灌注显像汇总灵敏度和特异度分别约87%和86%,MRS汇总灵敏度和特异度分别约91%和95%[10]。但MR功能序列目前也面临易受治疗后伪影干扰,采集和后处理缺乏标准化等不足。氨基酸代谢显像目前已被指南推荐广泛应用于脑肿瘤的术前诊断、术后评估、疗效评价、复发监测等多个环节[7] 。肿瘤生长旺盛,蛋白质合成活跃,氨基酸摄取显著高于假性进展、放射性坏死等治疗相关反应。11C-MET是应用最为成熟的氨基酸代谢显像剂,文献报道其鉴别高级别胶质瘤复发与治疗后反应汇总灵敏度达93%,特异度82%[11],有研究推荐以T/Nmean1.58为阈值区分复发胶质瘤与治疗后反应[12];一体化11C-MET PET/MRI鉴别肿瘤进展与治疗后反应准确度达96%,高于单独11C-MET PET (88%)和MR(82%),诊断信心更足[13]。目前仅有的为数不多的关于脑肿瘤免疫检查点抑制剂的疗效评价报道均是基于氨基酸代谢显像[14,15]。
本中心开展的11C-MET PET/MR多模态显像既提供了精细的解剖结构,又融合了氨基酸代谢、弥散加权、灌注加权、波谱成像多参数成像,一站式为脑肿瘤术前诊断、术后评价、协助放疗计划制定、疗效评估、复发监测等各个环节提供更全面、准确的信息,为患者的精准诊疗保驾护航,期望未来为更多脑肿瘤患者的生存带来更大获益。
所有作者均声明本研究不存在利益冲突



























