
患者,女性,81岁,因"慢性咳嗽、咳痰30余年,加重伴呼吸困难6个月余"入院。病程长,起病缓慢,以咳嗽、咳痰、呼吸困难为主要症状,症状持续存在,逐渐加重,7d前因心前区疼痛就诊于我院心血管内科,行胸部CT示两肺多发团片状实变影,遂转入我科行进一步诊治。
咳嗽,咳少量白痰,伴活动后呼吸困难,心前区疼痛。体格检查:双肺呼吸音弱,可闻及干啰音。
胸部增强CT示转移性钙化,CT引导下经皮肺穿刺活检病理证实转移性钙化。
给予患者降低血钙为主的综合诊疗。
患者仍有活动后呼吸困难,症状稳定出院。
呼吸与危重症医学科;影像科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
转移性钙化(metastatic calcification ,MC)是由于全身性的钙、磷代谢障碍,引起机体血钙或血磷升高,导致钙盐在未受损伤的组织内沉积,随血液循环异位于肾小管、肺泡壁等软组织或血管壁。转移性肺钙化(metastatic pulmonary calcification, MPC)是钙在肺组织中沉积,继发于无肺软组织损伤史的钙代谢异常。最常见的原因为慢性肾功能衰竭,透析,器官移植术后,原发性或继发性甲状旁腺功能亢进症,破坏性骨损害等[1,2,3,4,5]。发病率低,国内外报道以个案病例为主。我们报道一例以肺部影像学快速进展为主要表现的转移性肺钙化,旨在提高对本病的认识,减少误诊和漏诊。
患者,女性,81岁,因"慢性咳嗽、咳痰30余年,加重伴呼吸困难6月余"于2021年4月22日入科。该患缘于30余年前无明显诱因出现咳嗽、咳痰,咳白色粘痰,量少,易咳出。上述症状长年反复发作,于季节交替或感冒后加重,使用抗感染药物及平喘类药物(具体药物及剂量不详)治疗后,咳嗽、咳痰可缓解。6月余前患者自诉症状加重,伴呼吸困难,活动后明显,休息后可缓解,夜间不能平躺,无夜间憋醒。7天前因心前区疼痛就诊于我院心血管内科,给予改善循环,抗感染、祛痰及对症治疗(具体药物及剂量不详),行胸部CT示两肺多发团片状实变影。为进一步明确诊治,转入我科。自发病以来,食欲欠佳,睡眠正常,大小便正常,体重无明显变化。
患者既往"慢性支气管炎"30余年,4个月前于我院肾病内科诊断为"慢性肾脏病4期、高钙血症",未行系统治疗。7天前于我院心血管内科诊断为"冠状动脉粥样硬化性心脏病、高钙血症"。否认吸烟史及工业粉尘等吸入史、烟酒史。否认家族史、冶游史及手术外伤史。体格检查:双肺呼吸音弱,闻及干啰音。心率78次/min,律齐,未闻及杂音。
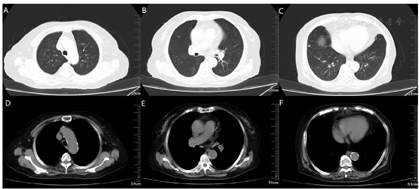
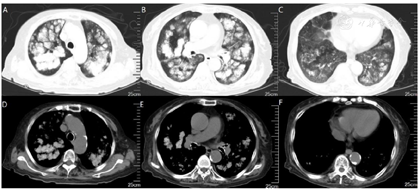
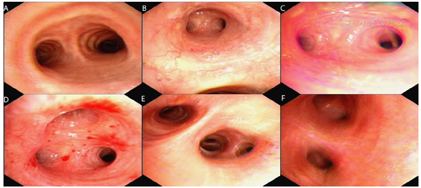
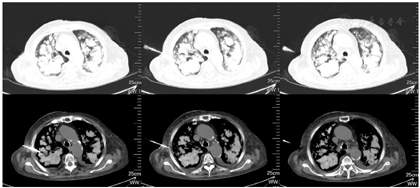
钙离子(我院2020年12月17日):3.91mmol/L。钙离子(我院2021年4月17日):3.5mmol/,多次复查钙离子明显升高。血气分析(2021年4月22日未吸氧):PH 7.48,PaCO2 37mmHg,PaO2 58mmHg,HCO3-:27.6mmol/L,BE 4.1mmol/L,Lac 1.6mmol/L,K+ 4.1mmol/L,THbc 84g/L。骨代谢六项:降钙素3.87pg/ml,甲状旁腺素46.00pg/mL,β-胶原降解产物2.480ng/mL,总I型胶原氨基端延长肽315.000ng/mL,骨钙素47.700ng/mL,25羟维生素D 4.700ng/ml;甲功八项:甲状腺过氧化物酶抗体(ATPO) 10.80U/ml,甲状腺球蛋白抗体(ATG)>4000U/mL,甲状腺球蛋白(TG) 0.20ng/ml,三碘甲腺原氨酸(TT3) 1.30nmol/L,甲状腺素(TT4) 46.80nmol/L,游离T3(FT3) 2.48pmol/L,游离T4(FT4) 6.69pmol/L,高灵敏促甲状腺素(TSH) 9.470mIu/L;肿瘤标志物全套(女):肿瘤相关抗原125(CA125) 52.70U/ml,肿瘤相关抗原153(CA15-3) 31.90U/ml,细胞角蛋白19片段(Cyfra211) 2.78ng/ml,异常凝血酶原(PIVKA-Ⅱ) 32.700mAU/ml,β2-微球蛋白(β2-MG) 3.04μg/mL,人绒毛膜促性腺激素(HCG) 7.54mlU/ml,绝经前ROMA值(Pre-ROMA) 97.19%,绝经后ROMA值(Post-ROMA) 81.68%,胃泌素释放肽前体(ProGRP) 279.0pg/ml。胸部平扫CT(我院2020年12月18日图1):右肺中叶及左肺下叶结节,右肺钙化灶。气管及主支气管管壁钙化。胸部平扫CT(我院,2021年4月19日图2):两肺见弥漫性、松散性沿支气管及血管分布的结节状及团片状高密度影,以两肺上叶为著,呈对称性改变,纵隔窗大部分病灶已实变,CT值约为100HU。胸部增强CT(我院,2021年4月25日):两肺见弥漫性、松散性沿支气管及血管分布的团絮状、棉花团样密度增高影及磨玻璃密度影,以两肺上叶为著,呈对称性改变,纵隔窗大部分病灶已实变,CT值约为100HU,增强扫描动脉期CT值约127HU,静脉期CT值约111HU。诊断提示:两肺代谢性疾病,考虑转移性肺钙化。PET/CT提示双肺改变考虑非肿瘤性病变,不除外肺泡蛋白沉积症可能,建议相关检查。电子支气管镜检查,镜下未见明显异常(图3),肺泡灌洗液色清亮。右肺上叶灌洗液送检脱落细胞回报示标本内见噬细胞、偶见上皮细胞,未见到恶性细胞。灌洗液病原微生物宏基因检测回报示白色念珠菌(序列数:4091)、光滑念珠菌(序列数:726)、EB病毒(序列数:33)。2021年5月11日行CT引导下经皮肺穿刺活检(图4),于右肺上叶穿刺获得2条约2.3cm长暗红色肺组织,送检肺组织常规病理及病原微生物宏基因检测。病理回报示(右肺上叶)肺泡结构破坏,肺间质纤维母细胞增生,有淋巴细胞、浆细胞浸润,其内见网络样钙化,局部见有机化及玻璃样变,并见有增生的肺泡上皮,细胞有异型,胞浆嗜酸,考虑为反应性增生,病变形态不能除外转移性钙化引起的弥漫性肺泡损伤性病变,请结合临床(图5)。肺组织病原微生物宏基因检测回报示白色念珠菌(序列数:1)、EB病毒(序列数:1)。全身骨显像示双肺弥漫性高密度伴放射性浓聚,考虑转移性钙化,结合临床资料,首先考虑肺泡微石症,肿瘤性疾病待排。甲状旁腺显像未见明显异常。




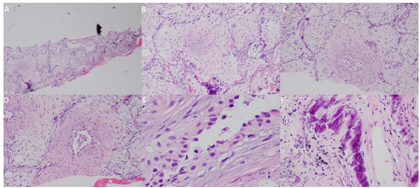

诊断:转移性肺钙化,高钙血症,I型呼吸衰竭,慢性支气管炎,慢性肾脏病4期,缺血性心脏病、心功能II级。
诊断依据:老年女性,慢性支气管炎病史30余年,6个月前出现活动后呼吸困难,加重伴心前区疼痛1周。既往"慢性支气管炎"30余年,4个月前于我院肾病内科诊断为"慢性肾脏病Ⅳ期、高钙血症",未行系统治疗。7天前于我院心血管内科诊断为"冠状动脉粥样硬化性心脏病、高钙血症"。查体:双肺呼吸音弱,闻及干啰音。心率78次/min,律齐,未闻及杂音。辅助检查:胸部增强CT诊断提示:两肺代谢性疾病,考虑转移性肺钙化。CT引导下经皮肺穿刺活检病理不能除外转移性钙化引起的弥漫性肺泡损伤性病变。全身骨显像示双肺弥漫性高密度伴放射性浓聚,考虑转移性钙化,结合临床资料,首先考虑肺泡微石症,肿瘤性疾病待排。
鉴别诊断
1.肺泡蛋白沉积症肺泡蛋白沉积症(PAP)是一种罕见的肺间质性疾病,起病隐匿、临床表现缺乏特异性。病理特征是肺泡腔及终末细支气管内有过碘酸-希夫(PAS)染色阳性的蛋白质样沉积物;胸部高分辨CT(HRCT)检查表现为弥漫性磨玻璃影、"不规则铺路石"样图案。诊断的金标准是组织学检查发现肺泡内有PAS染色阳性的蛋白质样沉积物,并结合阿辛蓝染色阴性及HE染色等排外其他能引起PAS染色阳性的疾病。
2.绒癌肺转移瘤绒癌是一种恶化程度高的妊娠滋养细胞疾病,最常见的转移部位是肺。胸部影像学典型表现为片状、结节状、棉絮状、团块状阴影。
3.肺泡微石症肺泡微石症( pulmonary alveolar microlithiasis,PAM)是一种以双肺肺泡内存在弥漫性分布的含钙、磷酸盐的微结石为特征的临床罕见疾病。胸部影像学典型表现为双肺野支气管血管束不规则增粗,显示小叶间隔、小叶内间质、叶间胸膜的高密度串珠状增厚和磨砂玻璃样改变。病变早期仍需要与肺结核、尘肺等疾病相鉴别,肺活检可明确该疾病的早期诊断。
给予患者补液、利尿降低血钙,辅以化痰止咳、平喘、改善循环等对症治疗。
纠正I型呼吸衰竭,咳嗽、咳痰及活动后呼吸困难较前好转出院。电话随访,患者4个月来间断咳嗽,较前无明显加重。
转移性肺钙化(MPC)是一种代谢性肺病,其特征是钙在肺实质中沉积。发病机制仍不完全清楚,涉及磷钙平衡、肾功能和pH值。它最常与直接或间接导致高钙血症的疾病有关[6]。发病率无详细的数据统计,发病年龄与性别无明显差异。早期可无症状,但可逐渐进展为呼吸衰竭。有文献报道接受器官移植手术后患者出现急性呼吸衰竭,最终证实为转移性肺钙化所致[7,8]。本病影像改变需要与营养不良性钙化、结节病、肺泡微石症、矽肺、含铁血黄素沉着症等鉴别。胸部CT可有多个弥漫性钙化结节,磨玻璃影或实变,或融合的高密度实质实变。在肺的上部区域最为显着,这是因为肺尖部的碱度增加,这会促进钙盐的沉积。可以通过顶点处较高的通气/灌注比来解释,这会在动脉血中产生较低的二氧化碳分压(PaCO2)和较高的血液PH。最近有报道利用双能CT通过钙抑制胸部成像来诊断和确认转移性肺钙化[9]。此外也有利用骨显像(99m Tc-MDP)或PET/CT诊断转移性肺钙化的报道[10,11]。最近有报道利用气管镜冷冻肺活检获取病理来诊断转移性肺钙化[12],也有基于探针的共聚焦激光内镜在转移性肺钙化中的应用[13]。
本病例存在以下两个特点:1.肺部影像学表现重,双肺多发高密度影,沿支气管及血管分布,以两肺上叶为著,小叶中心分布为主,部分存在实变。具有且弥漫性、对称性的特点。2.对比2020年12月17日及2021年4月19日两次胸部平扫CT,可见肺部影像学快速进展,但咳嗽、咳痰及活动后呼吸困难症状较前未见明显加重。入院后高度怀疑原发肺癌或转移性肺癌,考虑到患者81岁,心肺功能差,建议患者完善PET/CT密切病变性质,结果回报示双肺改变考虑非肿瘤性病变,不除外肺泡蛋白沉积症可能。胸部增强CT及全身骨扫描考虑转移性肺钙化。笔者认为病理是诊断转移性肺钙化的金标准,遂利用呼吸介入手段尽早行肺活检。患者81岁,存在I型呼吸衰竭,心功能欠佳,对气管镜操作医生要求极高。我中心呼吸内镜医生完成气管镜常规检查及肺泡灌洗后,患者出现血氧降低,未能通过气管镜获得肺活检标本。气管镜灌洗液病原微生物高通量测序提示白色念珠菌、光滑念珠菌、EB病毒感染,但不考虑引发此影像学改变。后续通过CT引导下经皮肺穿刺活检获得病理,病理结果不除外转移性钙化。综合患者病史,胸部增强CT、全身骨显像及病理结果,可明确诊断为转移性肺钙化,但病因尚不明确。患者无透析、器官移植病史,甲状旁腺功能及甲状旁腺显像未见明显异常,可除外原发性或继发性甲状旁腺功能亢进。患者既往因肌酐升高,4个月前于我院诊断为慢性肾脏病,但本次入院多次复查肾功能均为正常。根据骨代谢六项结果,及血钙、血磷趋势,不支持为慢性肾脏病所致转移性钙化。因患者年龄较大,给予降低血钙后,血钙维持在正常范围内,症状较前缓解,建议患者出院观察,定期复查胸部CT及钙离子。
通过对一例不明原因肺部影像学改变快速进展的转移性肺钙化患者的临床表现、实验室检查、胸部影像学特点及病理学表现进行总结,结合有关文献进行回顾性分析,提高呼吸科医生对转移性肺钙化的认识。对于不明原因肺部影像学改变,可早期通过呼吸介入方法获取病理,明确诊断后行早期治疗。
所有作者均声明本研究不存在利益冲突



























