
患者,男性,26岁,因"近3 d晕厥1次"就诊。晕厥发作无明显诱因,持续2 min后自行恢复意识,发作前后无头晕和胸痛,睡眠尚可。入院初步诊断为Brugada综合征。既往否认心脏病、高血压、糖尿病病史。
心率70次/分,血压110/70 mmHg,双肺呼吸音清,无干湿性啰音,心律齐,各瓣膜未闻及杂音。腹平,未闻及腹部血管杂音,双下肢无浮肿。
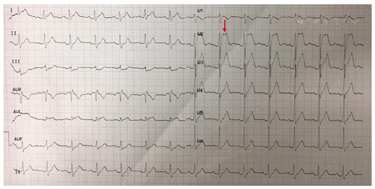
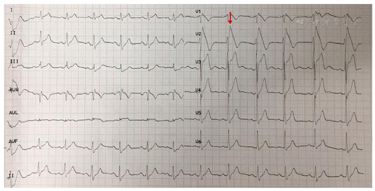
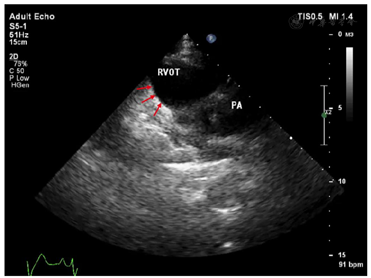
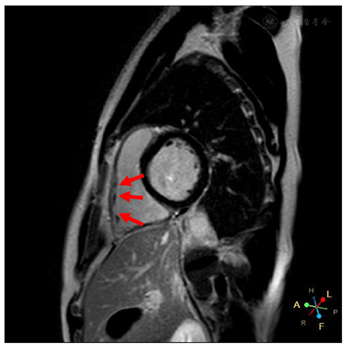
心电图示窦性心律,Ⅱ型Brugada波,完全性右束支传导阻滞,胸导V1、V2上移至第二肋间时出现Ⅰ型Brugada波。心脏超声示右室流出道远端稍增宽,心脏核磁示右室心肌延迟强化。基因检测示KCNH2基因杂合突变。
为患者实施植入式心律转复除颤器(ICD)植入术,密切随访。
患者出院后第23个月再次发作晕厥,ICD检测到室颤并放电后恢复窦性心律,目前患者病情稳定。
心血管内科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
Brugada综合征(Brugada syndrome, BrS)于20世纪90年代首次被Brugada兄弟描述,是一种早期复极异常的遗传性心律失常综合征,能导致恶性心律失常,心源性猝死发生率为4%[1]。传统认为BrS是不伴有心脏结构异常的离子通道病,是由编码心脏Na+通道的基因(SCN5A)突变引起内向Na+电流减少,导致右心室膜区域不均匀复极化产生2相折返,触发室速和室颤。目前对导致BrS表现的其他离子通道报道较少。我们报道存在右心室结构异常和新型KCNH2基因突变的Brugada综合征1例,旨在提高对本病的认识和诊治能力。
患者,男性,26岁,因"晕厥3 d"于2019年1月12日入院。患者3 d前无明显诱因下在上课时突发意识丧失,无四肢抽搐,无口吐白沫,无二便失禁,约2 min后意识自行恢复。发作前后无胸闷胸痛,无恶心呕吐,无头晕头痛。既往史:否认高血压、冠心病、心律失常、糖尿病和脑血管疾病病史。否认吸烟史,否认心血管病和猝死家族史。
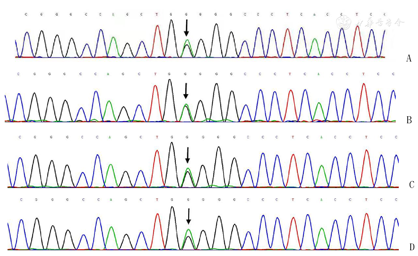
入院体格检查:体温36.4℃,脉搏70次/min,呼吸16次/min,血压110/70 mmHg(1 mmHg=0.133 kPa),神清、精神可,双侧瞳孔等大等圆,光反射灵敏,双肺呼吸音清,未及干湿啰音,心律齐,各瓣膜听诊区未闻及杂音,双下肢无水肿。心电图提示窦性心律,Brugada波Ⅱ型(图1),将V1、V2上移两个肋间复查心电图出现Brugada波穹窿型Ⅰ型(图2)。心脏超声右心室流出道远端稍增宽,右心室流出道近端内径27mm,远端内径31mm,左室功能和结构未见异常(图3)。心脏核磁显示右室心肌延迟增强,提示纤维化(图4)。冠状动脉CT血管成像(CTA)未见异常,直立倾斜试验阴性。




诊断为Brugada综合征,晕厥原因待查,心源性晕厥可能性大。患者家属的心电图检查未见异常;于2019年1月17日行植入式心律转复除颤器(implantable cardioverter defibrillator,ICD;美国美敦力公司)植入术。
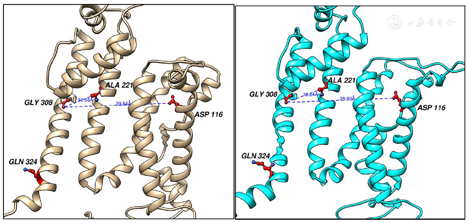
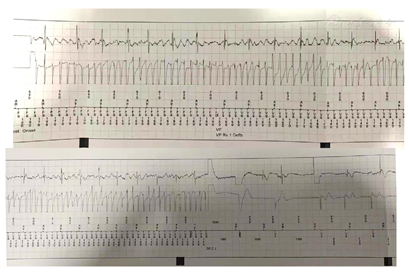
基因检测发现患者KCNH2基因存在c.2407G>A杂合突变,第2407号核苷酸由鸟嘌呤变异为腺嘌呤(图5A),该突变为剪接位点突变,位于20号内含子。患者父亲无该位点变异,患者母亲,舅舅,大姨均存在该位点变异(图5B~D)。该变异在HGMD,Clinvar专业版数据库中未见报道,为新的致病性突变。对正常KCNH2蛋白(图6A)和突变后的KCNH2蛋白(图6B)进行了计算机三维重建,发现KCNH2基因803位置的突变使离子通道跨膜螺旋间的距离稍微变大,会挤压离子通道中心。患者在ICD植入后第23个月(2020年11月16日)再次出现晕厥两次,ICD程控记录到2次室颤,放电2次(30J),均成功复律(图7)。随访至今(2021年10月12日)未再发作室速或室颤。



这是一例以不明原因晕厥为首发症状的年轻男性患者,心电图表现为可疑Brugada改变(Ⅱ型),将V1和V2导联上移至第2肋间后出现Ⅰ型Brugada波形,根据2015年ESC室性心律失常处理和心脏性猝死预防指南[2],如出现自发性Ⅰ型Brugada波即可确诊为Brugada综合征(Ⅰ类推荐,证据等级A)。本病例有不明原因晕厥史,未记录到发作时心电图,2018 ESC晕厥诊断和管理指南[3]指出存在自发性Ⅰ型BrS心电图的情况下,如有晕厥史,将来发生因室性心律失常导致的猝死概率较高,推荐植入ICD(Ⅱa类推荐,证据等级B)。
目前公认Brugada综合征是一种无明显心脏结构改变的离子通道病,而新近研究发现Brugada综合征常合并右室(主要为右室流出道)结构和功能异常[4],也有观点认为Brugada综合征常和致心律失常性右室心肌病(ARVC)共存[5]。
ARVC是由编码桥粒蛋白的基因突变引起心肌细胞间连接中断,心肌细胞坏死并被纤维脂肪组织替代。ARVC早期可单纯表现为起源于右心室的室性心律失常,晚期右心结构改变较突出,表现为右心室整体和局部扩张及功能障碍,伴明显的局部运动障碍。因此Brugada综合征与ARVC在突变基因型、有无明显的心肌病改变、心律失常的发生机制及预后方面均存在显著差异。本例患者心脏超声提示右室流出道增宽,核磁显示右室心肌纤维化,而基因检测无桥粒基因突变,心电图未发现Epsilon波,根据ARVC诊断标准(2010)专家共识的评分标准[6],本例患者尚不能诊断ARVC,但研究显示对于Brugada综合征伴有右心室结构异常的患者,发生室性心动过速风险更高,因此对于这类高危人群进一步随访尤为重要。
Brugada综合征最常见的基因改变是编码心脏钠通道的SCN5A基因功能缺失突变,但对于其他导致Brugada综合征的离子通道报道较少。KCNH2基因编码心肌细胞膜上快速延迟整流钾电流(Ikr)通道的α亚基,Ikr是心肌复极化的主要外向钾电流,KCNH2是一个包含有819个氨基酸的蛋白,本病例KCNH2蛋白在803位发生了错义突变,氨基酸由甘氨酸变为精氨酸。为探究该错义突变是功能获得性还是功能缺失性突变,应用计算机三维建模,发现本病例KCNH2基因803位置的突变使离子通道跨膜螺旋间的距离稍微变大,会挤压离子通道中心,降低Ikr离子通道的活性,可能导致其功能缺失,延长QT间期。KCNH2是造成Brugada综合征较少见的潜在致病基因,目前国外仅有KCNH2蛋白功能获得突变致Brugada综合征的少数病案报道[7],尚无KCNH2功能缺失致BrS报道。本例患者虽QT间期正常,如果反复发作恶性心律失常和ICD正常放电,在考虑使用奎尼丁常规治疗BrS时,应加强重视QT延长问题,射频消融RVOT外膜可能是应该考虑的治疗方法。
因此,有不明原因晕厥史的BrS患者,属于猝死高危人群,推荐植入ICD。心脏核磁能早期发现Brugada综合征是否合并右室结构和功能改变,基因检测能探究心脏基础病变,但临床实践中很难首先从基因检测开始进行诊断,医生更应重视临床表现、体征或辅助检查,对于KCNH2突变的Brugada综合征患者,药物治疗时应注意QT延长问题。
所有作者均声明本研究不存在利益冲突



























