
患者,男,28岁,主因"尿中泡沫增多1年,乏力3个月,发现血肌酐升高2个月"入院。尿检提示以白蛋白为主的大量蛋白尿、血尿,伴高血压、中度贫血。肾穿病理提示"轻链沉积性肾病",结合骨穿考虑为"多发性骨髓瘤"。既往体健,病来体重增加11 kg。
入院时乏力,气促,血压升高。查体见贫血貌,舌体肥大,结膜苍白,全身重度可凹性水肿。
骨髓浆细胞占24.5%,且流式证实为异常单克隆浆细胞;影像学检查见多发骨质破坏,符合多发性骨髓瘤诊断标准;肾脏病理示肾小球缺血皱缩、系膜增生,刚果红染色阴性;免疫荧光κ轻链线样分布,符合肾脏轻链沉积病;故诊断为多发性骨髓瘤合并轻链沉积病。
患者于外院行PDD方案化疗2疗程后来我院,更换为PCD方案继续化疗3个疗程后行自体造血干细胞移植。
患者治疗后,乏力、水肿、高血压等症状较前明显好转。移植后骨髓瘤评效为完全缓解,微小残留病阴性;肾脏方面:尿蛋白明显减少,尿红细胞消失,血压恢复正常。
血液科;肾内科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
具有肾脏意义的单克隆免疫球蛋白病(monoclonal gammopathy of renal significance, MGRS),是一类由异常单克隆免疫球蛋白引起的肾脏损害的血液学疾病的总称[1],包括轻链型淀粉样变性、轻链沉积病(light chain deposition disease, LCDD),C3肾小球肾病等[2]。MGRS的肾损害各有特点。肾脏活检病理对于MGRS的准确诊断、预后评估和治疗选择至关重要。现报道一例以肾脏LCDD为首发表现的多发性骨髓瘤(multiple myeloma, MM),希望以此提升临床医生对MGRS的认识,减少误诊。
患者,男性,28岁,主因"尿中泡沫增多1年,乏力3个月,发现血肌酐升高2个月"入院。患者于1年前(2019年11月)无明显诱因出现尿中泡沫增多,无尿量及尿色改变,无双下肢水肿,间断在多家医院以"肾炎"不规律治疗未见好转。2020年8月无明显诱因出现乏力,活动耐力下降,伴四肢麻木乏力,无骨痛及肢体疼痛,未特殊诊治。2020年9月出现腹胀、嗳气、呕吐,进行性加重。就诊于当地医院,检查示:血红蛋白76 g/L,血肌酐390 μmol/L,血钾6.73 mmol/L,脑钠肽(BNP) 880 pg/ml,肾穿病理提示"轻链沉积性肾病可能",骨穿示浆细胞占24.5%,考虑为"多发性骨髓瘤",转入当地医院血液科,行PDD方案(硼替佐米、脂质体多柔比星、地塞米松)化疗2疗程,期间出现急性心功能不全,经对症治疗后好转。为进一步诊治收我科。自发病以来一般情况尚可,精神可,饮食可,小便增多,夜尿增多,大便正常,睡眠差,体重增加11 kg。既往体健,个人史及家族史无殊。
入院体格检查:体温36.6℃,脉搏84次/分,呼吸18次/分,血压172/96 mmHg。神清,贫血貌,舌体肥大,浅表淋巴结无异常,全身重度可凹性水肿。结膜苍白,巩膜无黄染,眼睑水肿。心律齐,无杂音,双肺呼吸音粗,肝脾未及。
骨髓涂片:浆细胞占24.5%;流式细胞学:异常细胞占有核细胞的10%,表达CD38,CD138,cKappa,不表达cLamabda,考虑为异常单克隆浆细胞;染色体荧光原位杂交:RB1缺失阳性(95%),t(11;14)阳性(80%);骨髓染色体为正常核型。骨髓活检:浆细胞明显增多,胞体大,胞浆量多,刚果红染色阴性。
血免疫球蛋白定量:IgG 490 mg/dl,IgA 50 mg/dl,IgM 4 mg/dl,血免疫固定电泳阴性;24小时尿总蛋白3.89 g,其中κ轻链0.39 g,λ轻链0.12 g;尿免疫固定电泳可见M成分κ轻链。血清游离轻链:Fκ 522.5 mg/L,Fλ 12.6 mg/L,Fκ/λ=41.47。其余包括自身免疫病、甲状腺及甲状旁腺激素、肿瘤标记物等检查均未见明显异常,骨骼影像学检查未做。
肾脏病理:符合肾脏轻链沉积病(LCDD,κ型)(图1,图2)。
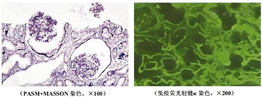



血红蛋白67 g/L,血肌酐577.2 μmol/L,BNP 223 pg/ml。尿常规:尿蛋白(++++),红细胞(++),镜检尿红细胞6~9个/高倍视野,以异常形态红细胞为主。24小时尿总蛋白17.05 g,尿微量白蛋白14.2 g,24小时尿κ轻链0.5 g,尿λ轻链0.3 g,尿免疫固定电泳阴性。
心脏相关检查:心电图:肢导低电压。心脏彩超:室间隔厚度12 mm,射血分数62%。心脏增强核磁共振(MRI):左房增大,左室基底段、中间段室间隔相对略增厚,厚约13.9 mm,心房心室运动不协调。
骨质相关检查:颈、胸、腰椎和盆腔MRI检查结果显示骶椎、双侧髂骨、耻骨等处多发局灶性骨质破坏。
该患者以肾病为首发表现,同时有骨髓单克隆浆细胞增多及单克隆免疫球蛋白,因此需针对MGRS行进一步鉴别诊断:
典型的MM肾病表现为管型肾病,是因轻链浓度过高,超过近端肾小管上皮细胞的重吸收能力时,在远端肾小管结合并沉淀形成管型、堵塞肾小管所致的肾损害。尿蛋白以轻链为主,通常不伴血尿、高血压。本患者虽MM诊断成立,但尿蛋白特点与本病不符,且肾脏活检以肾小球及间质病变为主,未见管型,不考虑本病。
是除管型肾病外MM最常合并的肾损害类型,为轻链型淀粉样物质沉积于肾脏等组织器官而致其功能受累。轻链类型多为λ型。尿蛋白同样以白蛋白为主,但少有血尿、高血压;可合并心脏病变,表现为心电图肢导低电压、室间隔增厚、BNP升高、舒张功能受限;病理特征为光镜下均质粉染的物质,刚果红染色阳性。本患者肾脏、心脏均受累,与本病相似,但为κ轻链型,本病少见;且同时存在血尿、高血压,刚果红染色阴性,以上均不支持本病。
常表现为大量蛋白尿、镜下血尿、高血压和肾功能不全。特征性病理学特点包括光镜下结节性肾小球硬化、免疫荧光下肾小球系膜和肾小管基底膜弥漫性单一轻链染色,以κ轻链型为主,刚果红染色阴性。本病亦可累及心脏,在心电图、超声和影像学表现方面与心脏淀粉样变性类似。由此,本例患者轻链类型、脏器损害特点及肾脏病理特征均与本病相符,支持本病诊断。
包括C3肾小球病(以肾小球内C3沉积为病理特点)、冷球蛋白血症肾小球肾炎(单克隆冷球蛋白成分在血液中检出并在肾组织沉积),可通过不同病理表现以进一步鉴别;另可有继发于淋巴瘤、POEMS综合征等疾病的MGRS,本例患者无以上原发疾病的临床证据,相关影像学、实验室等检查结果不支持以上疾病诊断。
综上,该患者明确诊断为多发性骨髓瘤κ轻链型(DS ⅢB期,ISS Ⅲ期,RISSⅡ期);合并轻链沉积病(累及肾脏、心脏)。
入院后患者MM评效为完全缓解(CR),但尿蛋白、肌酐水平均较前明显进展,且同时存在心脏病变;考虑到轻链沉积病方面疗效欠佳,以及蒽环类药物的心脏毒性,为其更换为PCD方案(硼替佐米、环磷酰胺、地塞米松)化疗3个疗程,同时予血液透析治疗。2疗程后肌酐稳定于280 µmol/L左右,成功脱离透析。后在环磷酰胺2.0 g/m2动员后,于2021-4-7、4-8两天行自体造血干细胞采集,共采集CD34+细胞5.3×106/kg;并于2021-4-27应用马法兰180 mg/m2预处理后行自体造血干细胞移植(autologous stem cell transplantation, ASCT)。
患者经治疗,乏力、水肿、高血压等症状较前明显好转。PCD化疗3疗程后,MM评效为严格意义的完全缓解(sCR),微小残留病(minimal residual disease, MRD)阳性(0.009 7%);BNP 213 pg/ml,肌酐289 μmol/L,24小时尿微量总蛋白2.4 g,尿微量白蛋白2.1 g。移植后3个月复查:MM评效为CR,MRD阴性;BNP 78 pg/ml,肌酐211 μmol/L,24小时尿蛋白降至0.5 g,尿微量白蛋白0.4 g。目前门诊持续规律随访中。
MGRS的诊断基于两个要素:单克隆免疫球蛋白的存在,以及由其引起的肾脏损害;其中最常见以白蛋白尿为主要表现的肾小球损害[2]。而MM肾病为管型肾病,表现为轻链为主的蛋白尿[3]。国际骨髓瘤工作组(IMWG)指出,除管型肾病以外,其他类型肾损害均不属于MM相关肾损害,如无其他MM相关事件证据,则不能诊断MM[4]。
本患者青年男性,以肾功能不全起病,继而骨髓检查发现浆细胞比例升高(>10%),流式证实为单克隆来源;在首诊医院诊断为"多发性骨髓瘤"。骨髓浆细胞比例的高低并非鉴别MM与其他MGRS的要点,关键需明确是否存在骨髓瘤相关的"CRAB"症状(高钙血症、肾功能不全、贫血、骨病)。当时MM诊断存在如下疑点:(1)患者肾损害表现为以白蛋白尿为主,伴镜下血尿,与MM管型肾病表现不符,肾穿病理亦不相符;(2)患者一年前即出现泡沫尿,贫血时间不明,不除外肾性贫血可能性;(3)由于初诊时未行骨质评估,无法明确是否存在MM骨病。由此,该患者诊断MM所必需的"CRAB"症状目前均不支持或存疑。后续来我院就诊时,完善了骨质MRI评估,明确存在多发溶骨性骨质破坏。因而MM诊断最终成立。
LCDD是以单克隆免疫球蛋白沉积于组织器官为特征的一类疾病。约10%-30%的LCDD患者可合并MM[5,6,7]。LCDD最常累及肾脏,临床特点呈肾病综合征合并肾炎表现,即白蛋白尿、镜下血尿、高血压;肾脏病理是确诊的金标准。LCDD也常累及其他脏器。约三分之一的LCDD患者存在心脏受累[8],这类患者总生存期较短,移植相关死亡率也更高[9],需早期识别并积极治疗。本患者心脏病变表现为BNP升高、室间隔增厚、心电图肢导低电压,以及治疗中出现的心功能不全,均提示心脏受累。理论上,根据患者为κ轻链类型,以及肾脏的病理特征,该患者心脏病变为LCDD心脏受累可能性大;但亦不能除外其他类型浆细胞疾病,如心脏淀粉样变性的可能性。此二者具有相似的临床表现及影像学特征,除心肌活检外无法明确区分[9]。但由于心肌活检风险过高,且二者治疗方案与预后基本一致,出于对患者获益风险比的考虑,我们未对患者行心肌活检。
在治疗方面,无论是MM或是LCDD,均以清除单克隆浆细胞为主,以硼替佐米为基础的化疗方案可作为一线治疗选择,其目的为快速获得深度血液学缓解;ASCT也应作为适合移植患者的一线治疗选择[10]。同时可针对肾脏行相应的肾脏替代治疗或肾移植。对于本例青年患者,更应早期积极进行抗浆细胞治疗。由于患者存在脏器功能受限,因而在用药方面需考虑到药物的心肾毒性问题,减少不良反应风险。
总之,对于伴肾损害的单克隆免疫球蛋白病,正确诊断和及时治疗是改善预后的关键,肾脏穿刺对于肾损害类型的鉴别至关重要,有助于早期作出正确治疗抉择,改善患者生存预后。
所有作者均声明本研究不存在利益冲突



























