
患者,女,24岁,因发现左乳腺肿物2个月就诊。
查体发现左乳腺外上象限孤立性肿物,直径约1.5 cm,境界不清。
超声检查,左乳1B见一低回声结节,大小约1.64 cm ×1.58 cm ×0.88 cm,边界欠清,形态欠规则,内回声均匀,其内见点状血流信号。术中冰冻病理诊断结合常规病理检查及免疫组化确诊为乳腺交界性叶状肿瘤内浸润性小管癌。
乳腺肿物切除术,病理确诊后行二次手术,术中前哨淋巴结冰冻切片未见转移癌,遂行左侧乳腺单纯切除术。
随访10个月,未进行化疗及放疗,肿瘤无复发转移。
病理科;乳腺外科;肿瘤科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
乳腺叶状肿瘤(phyllodes tumor,PT)是一组具有双向分化特点的肿瘤,同时存在上皮和间质成份的增生,但本质特点在于间质成份富于细胞或过度生长。尽管上皮成份经常增生,有时甚至是旺炽性增生,但发生恶性转变却相当罕见。乳腺浸润性小管癌(tubular carcinoma, TC)是一种少见的特殊类型乳腺癌,因其肿瘤性小管与正常小导管形似而得名。在工作中,我们遇到1例小管癌发生于交界性叶状肿瘤内。
患者,女,24岁,因发现左乳腺肿物2个月就诊。查体发现左乳腺外上象限孤立性肿物,直径约1.5 cm,境界不清。超声检查,左乳1B见一低回声结节,大小约1.64 cm ×1.58 cm ×0.88 cm,边界欠清,形态欠规则,内回声均匀,其内见点状血流信号。临床行乳腺肿瘤切除术。病理确诊为乳腺交界性叶状肿瘤内浸润性小管癌后行二次手术,术中前哨淋巴结冰冻切片未见转移癌,遂行左侧乳腺单纯切除术。
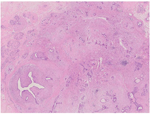
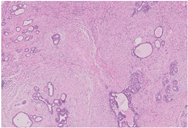
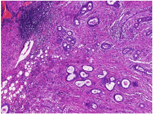
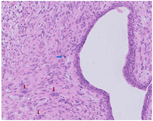
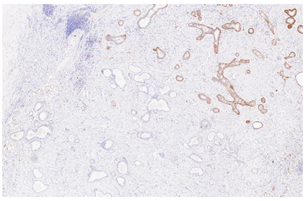
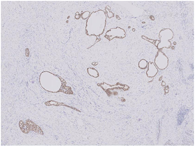
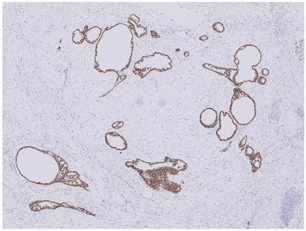
大体检查:切除乳腺肿瘤及周围少许乳腺组织,大小共2 cm ×1.5 cm ×1.5 cm,肿瘤直径约1.5 cm,切面灰白色,质地较硬,与周围组织分界不清。镜下检查:肿瘤缺乏包膜,境界不清、浸润周围乳腺组织。肿瘤内有密集增生的梭形细胞,但缺乏过度增生。梭形细胞有中度异型性,核分裂约1~2个/10 HPF,可见病理性核分裂像。肿瘤内有导管增生,少部分扩张、呈裂隙状,无分叶状结构。肿瘤内靠近边缘可见扩张的小管,呈浸润性分布,周围肌上皮缺失,细胞形态温和、有顶浆分泌,无核分裂。免疫组织化学检查:梭形细胞CD10与SMA有不同程度的阳性表达,Ki-67阳性指数约30%~40%,其余所染标志物均阴性。小管周围CD10、Calponin、P63、CK5/6均阴性,显示肌上皮缺失,Ki-67阳性指数约3%,ER与PR弥漫强阳性,Her-2(0)。
诊断:(左侧)乳腺交界性叶状肿瘤,其内有浸润性小管癌。鉴别诊断:(1)乳腺叶状肿瘤并发浸润性小管癌确实极易漏诊,主要原因是浸润性小管癌形态温和,恶性特征不明显,因此,需与并发于叶状肿瘤内的放射状硬化性病变、盲管性腺病等鉴别。与这些良性病变鉴别的主要特点是肿瘤性小管呈浸润性分布。此时,判断肌上皮缺失与否在鉴别中具有十分重要的价值,需要辅以免疫组化P63、Calponin等染色明确。(2)另外小管癌也需与非特殊型1级浸润性乳腺癌鉴别,因为前者预后更好。小管癌腺体呈卵圆形、尖角状末端以及顶泌胞质突起,一般情况下,非特殊型1级浸润性乳腺癌不具备这些特征。
后行二次手术,术中前哨淋巴结冰冻切片未见转移癌,遂行左侧乳腺单纯切除术。未见肿瘤性病变。
随访10个月,未进行化疗及放疗,肿瘤无复发转移。
乳腺叶状肿瘤内并发癌非常罕见,在Tan报道的有关叶状肿瘤的最大宗病例研究中,不足1%(2/335)的叶状肿瘤并发导管或小叶原位癌[1]。目前散见于文献报道的叶状肿瘤内癌仅约30例[2]。
乳腺叶状肿瘤内癌,可发生于良性、交界性及恶性叶状肿瘤,其中以交界性最为少见。一般情况下,叶状肿瘤中的上皮和间质同时增生,以间质增生为主。根据间质细胞的丰富程度、非典型性、核分裂像数、肿瘤边缘情况及间质过度生长(定义为在至少一个低倍视野下仅见到间质而无伴随的上皮成分),将叶状肿瘤分为良性、交界性及恶性三种类型。就本例而言,虽然缺乏间质过度增生,核分裂也并非多见,但是细胞异型性相对突出,肿瘤呈现浸润性边缘。综合以上特点,我们认为,诊断交界性叶状肿瘤较为合适。
尽管叶状肿瘤的上皮成分常可出现增生、大汗腺及鳞状细胞化生等,但发生恶性转化却非常罕见。位于叶状肿瘤内的乳腺癌,大多数体积并不大,因此,临床或影像学检查,甚至大体检查,都很少怀疑癌,一般只有经过切除活检才能明确诊断。
叶状肿瘤内并发的乳腺癌,组织学类型为小叶原位癌、导管原位癌、浸润性导管癌或浸润性小叶癌,也有报道小叶原位癌与导管原位癌并存[3],罕见报道为鳞癌、浸润性导管癌伴鳞状分化或浸润性小管癌[4,5]。并发于叶状肿瘤内的乳腺癌,形态学、免疫组化及病理诊断与普通乳腺癌并无不同,主要应与导管上皮增生等鉴别。导管上皮增生具有普通型增生的特点,细胞杂乱,缺乏一致性,必要时进行免疫组化CK5/6、ER、PR染色,可助鉴别。
叶状肿瘤内出现导管原位癌或浸润癌,间质梭形细胞明显增生,尤其是交界性或恶性叶状肿瘤还伴有间质细胞不典型性;此外,恶性叶状肿瘤也还可出现脂肪肉瘤、骨肉瘤、软骨肉瘤和横纹肌肉瘤等异源性分化,因此要注意与梭形细胞化生性癌鉴别。叶状肿瘤内癌,癌组织成分通常只占据整个肿瘤的一部分,叶状肿瘤的背景依然存在。广泛取材,找到良性的上皮成分也有助于诊断叶状肿瘤。免疫组化对鉴别也很有帮助,关键点在于明确梭形细胞并非上皮来源。各种上皮标志物,尤其是基底细胞型细胞角蛋白(CK5/6、CK14、34bE12等)和P63等,化生性癌总会或多或少出现阳性,而叶状肿瘤则为阴性。
由两个独立的原发肿瘤相互碰撞或相互浸润而形成的肿瘤,称为碰撞瘤(collision tumor)。按照该定义,叶状肿瘤内癌属于叶状肿瘤与乳腺癌的碰撞瘤,值得一提的是,此种碰撞瘤还可能出现的形式包括癌发生于叶状肿瘤的附近或叶状肿瘤内外均出现癌,文献也曾有少数报道[6]。理论上认为,恶性叶状肿瘤内癌是真正的癌肉瘤。Macher-Goeppinger等报道1例70岁女性右乳腺高级别恶性叶状肿瘤及其内高级别导管原位癌与浸润性导管癌,通过11个微卫星位点分析,发现叶状肿瘤的间质在16q23、17q12、17q25、22q13位点发生杂合子缺失,上皮显示16q23位点的杂合子缺失,而浸润性癌则显示16q23、17q12、17q25位点的杂合子缺失[7],虽然突变位点有重叠,但并不完全一致,据此认为癌与叶状肿瘤来自不同的克隆。
由于病例有限,对叶状肿瘤内癌的预后判断及治疗经验尚需积累。不同类型的叶状肿瘤和癌,预后及治疗也不尽相同。叶状肿瘤具有复发或转移的潜能,Sugie等报道54岁女性左乳腺恶性叶状肿瘤内浸润性导管癌,出现了肺和骨的肉瘤成分转移[5]。有报道叶状肿瘤内癌病例,浸润性癌成分转移至腋窝淋巴结[8,9];或孤立性癌细胞团前哨淋巴结转移[10]。
本例叶状肿瘤为交界性,癌组织为小管癌,在病理确诊后补行了单纯乳腺切除术,无肿瘤残余,前哨淋巴结没有转移,因此未进行后续化疗,而进行长期随访。因此综合来看,对叶状肿瘤,需要保证切除足够的边缘组织,而对其内的癌组织视情况进行相应的治疗。







所有作者均声明本研究不存在利益冲突



























