
孕妇,年龄37岁,孕7产3,汉族,因"停经5个月余,发现胎儿宫内贫血13天"于2020年9月8日就诊于本院。患者为罕见血型:Rh缺失型D--,回顾患者妊娠史,第一次妊娠孕20周难免流产,第二次妊娠于孕40周死胎引产(病因不详),第三次妊娠足月顺娩,发生新生儿溶血,现体健,第四次妊娠于孕6个月余发现胎儿腹水,行胎儿宫内输血4次,孕7个月余死胎引产,第五次及第六次妊娠均因个人原因行人流术。本次妊娠考虑患者为母儿血型不合导致的胎儿溶血性贫血。
胎动较前减少、减弱,余无明显不适。
本次妊娠孕19周于上海某医院查大脑中动脉峰值流速1.43Mom,查血型为A型Rh阳性,Rh表型:C-c-E-e-,不规则抗体:阳性,抗D效价:1:128。胎儿医学会诊考虑孕妇稀有血型、胎儿溶血病。孕25+2周于本院复查彩超:胎儿大脑中动脉峰值血流增快(位于1.5Mom)。
胎儿宫内输血4次。
于孕35周剖娩一女活婴,Apgar评分1分钟10分,5分钟10分,体重2780g,转新生儿科治疗15天,一般情况良好出院。新生儿随访至生后9个月,生长发育良好。
妇产科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
胎儿贫血指胎儿红细胞异常或减少,导致胎儿生长发育所必需氧及营养物质缺乏从而继发一系列相关病理性变化的疾病过程。最常见于Rh(D)/非Rh(D)抗原相关红细胞同种异体免疫反应导致的胎儿红细胞破坏。临床血型检查只查A、B抗原及D抗原,只要D阳性就称Rh阳性血型,无D抗原的统称为Rh阴性血型,其他几种抗原很少常规筛查,包括Rh血型系统的其他抗原(c,C,e,E)及其他非典型抗体的抗原。本案例Rh缺失型D--是Rh血型系统一种极为罕见的变异体,血清学特征表现为红细胞上Rh C/c、E/e抗原的完全缺乏和(或) D抗原的过量表达。Rh缺失型D--血型最早由Race和Sanger于1950年发现[12]。因该变异体罕见,目前为止,这种变异体的发生率还缺乏准确的统计学资料[11]。Rh缺失型D--极易引起严重的胎儿或新生儿溶血病,导致胎儿贫血、胎儿水肿和胎儿死亡。宫内输血目前被认为是胎儿贫血的标准治疗方式[1]。本文报告1例因母为罕见血型:Rh缺失型D--,导致胎儿贫血病例的多次宫内输血治疗过程和妊娠结局。旨在提高对本病的认识,规范治疗。
孕妇年龄37岁,孕7产3,汉族,因"停经5月余,发现胎儿宫内贫血13天"于2020年9月8日就诊于本院。回顾患者生育史:患者于2005年孕20周因难免流产行清宫术,2008年宫内孕40周因胎死宫内引娩一女死婴(病因不详),2010年足月顺娩一活女婴(出生后诊断新生儿溶血病),现体健,2014年于孕6月余发现胎儿腹水,曾行胎儿宫内输血4次,孕7月余因胎死宫内引娩一男死婴,2016年、2018年分别因个人原因人工流产各1次。本次妊娠后因既往不良孕产史于2020年8月至上海市某医院就诊,进一步完善血型检查,查血型为A型Rh阳性,Rh表型:C-c-E-e,不规则抗体:阳性,抗D效价:1:128,会诊结果示:1、孕妇稀有血型,多次死胎史,考虑为溶血性疾病可能性大,本次妊娠再次发生溶血性疾病的风险高。2、胎儿生长与孕周相符,羊水量正常,脐动脉未及明显异常,胎儿大脑中动脉PSV1.43MoM。遂就诊于本院。否认高血压、糖尿病等慢性病史。入院查体:一般情况可,生命体征平稳,血压128/65mmHg,腹部膨隆与孕月相符,腹软,双下肢无水肿。产科检查:骨盆外测量S:23.0cm IC:26.0cmE:19.0cmT:9.0cm宫高22.0cm腹围97.0cm未衔接,胎心140次/分。无宫缩。
于2020年9月9日孕20+6周查彩超提示:宫内单活胎,超声孕周20周4天,胎儿大脑中动脉峰值流速增快(Mom约1.47),胎儿静脉导管血流频谱未及明显异常。患者血型:A型Rh阳性,Rh表型:C-c-E-e-,不规则抗体:阳性,抗D效价:1:128,考虑稀有血型Rh缺失型D--。TORCH定量监测无异常发现。甲状腺功能正常。于2020年10月8日孕25+2周于本院复查彩超:胎儿大脑中动脉峰值血流增快(位于1.5Mom),于2020年10月12日孕25+6周行超声监测下胎儿脐静脉穿刺术,抽取胎儿脐血4ml分别行血常规及胎儿血型、RH表型、CMA检测,结果回示:胎儿血型:AB型RH阳性。RH表型D+/C+/c+/E-/e+,抗D效价:1:64,胎儿血红蛋白:52.00g/L;红细胞压积16.10%。CMA结果正常。超声筛查胎儿系统性结构未及异常。患者丈夫血型为B型,Rh阳性,RH表型D+/C+/c+/E-/e+。
诊断:1.胎儿溶血性贫血2.母儿RH血型不合3.宫内孕20+6周4.孕7产3 5.不良孕产史
鉴别诊断:非免疫性胎儿贫血:胎儿非免疫性贫血常见病因有胎母输血、胎儿骶尾部畸胎瘤、胎盘绒毛膜血管瘤等造成的胎儿失血,遗传性疾病、胎儿宫内感染(如梅毒、细小病毒、巨细胞病毒、弓形虫等)等造成的胎儿贫血,本病例依据母体传染病、TORCH筛查、父母血型检测及胎儿超声结构筛查、脐血血型/血常规/遗传学检查,基本排除胎儿非免疫性贫血可能。
依据上述检查结果,结合患者既往多次不良孕产史,此次妊娠因母体内含有抗C、c、e抗体,对胎儿红细胞产生破坏,造成溶血性贫血。本次胎儿宫内输血的Rh表型尽量与孕妇Rh表型相同。ABO血型系统中因胎儿血型为AB型,可考虑输入AB型、O型、A型或者B型。随即调配可用血源,同时查找患者家属有无匹配血型。于2020年10月15日找到血型相符血源,于本院再次检测表型:A型阳性;RH表型D+/C-/c-/E-/e-。符合本例孕妇宫内输血血型要求。同日复查彩超:胎儿大脑中动脉血流频谱峰值流速增快相当于1.8Mom值。2020年10月19日行首次超声引导下胎儿肝内静脉输血,术中于胎儿肝内静脉缓慢注入浓缩红细胞80ml。后续又进行3次宫内输血治疗(表1),手术过程均顺利,术中、术后均未发生相关并发症。末次输血孕周32周5天,输血后复查胎儿头颅MRI,提示胎儿双侧脑室前角室管膜下囊肿,余未及异常,建议定期复查。复查彩超:宫内妊娠,单活胎,超声孕周:33周6天,臀位,胎儿大脑中动脉PI值稍偏低,PI值1.53。查胎儿血常规:血红蛋白149.00g/L;红细胞压积45%。
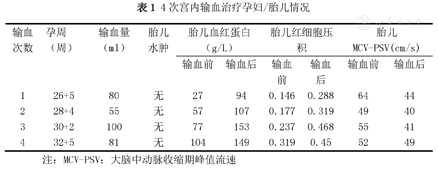
4次宫内输血治疗孕妇/胎儿情况
4次宫内输血治疗孕妇/胎儿情况
| 输血次数 | 孕周(周) | 输血量(ml) | 胎儿水肿 | 胎儿血红蛋白(g/L) | 胎儿红细胞压积 | 胎儿MCV-PSV(cm/s) | |||
|---|---|---|---|---|---|---|---|---|---|
| 输血前 | 输血后 | 输血前 | 输血后 | 输血前 | 输血后 | ||||
| 1 | 26+5 | 80 | 无 | 27 | 94 | 0.146 | 0.288 | 64 | 44 |
| 2 | 28+4 | 55 | 无 | 57 | 107 | 0.177 | 0.319 | 49 | 40 |
| 3 | 30+2 | 100 | 无 | 77 | 153 | 0.237 | 0.468 | 55 | 41 |
| 4 | 32+5 | 81 | 无 | 104 | 149 | 0.319 | 0.45 | 52 | 49 |
注:MCV-PSV:大脑中动脉收缩期峰值流速
经过4次宫内输血治疗、患者于孕35周出现Ⅱ类胎心监护、自觉胎动减少、权衡继续妊娠及早产风险,于孕35周促胎肺成熟后行子宫下段剖宫产术,剖娩一女活婴,Apgar评分1分钟10分,5分钟10分,称体重2780g,身长47cm。因早产转儿科。术中晚断脐(2min),并通过自体血回收装置收集脐血80ml送省中心血站做预处理后作为新生儿输血储备。新生儿溶血试验:直接抗人球蛋白弱阳性抗体释放阳性;游离抗体弱阳性;不规则抗体:阳性;不规则抗体Ⅱ:弱阳性;不规则抗体Ⅲ:弱阳性。血常规(12.16g/L):白细胞10.71*10^9/L,中性粒细胞百分比60.8%,淋巴细胞百分比33.8%;血红蛋白143.00g/;血小板272.0*10^9/lc;C反应蛋白<0.20mg/,新生儿头颅超声:双侧室管膜下出血(吸收期),双侧脑室旁白质回声增强(考虑脑白质损伤);双侧脑室前角囊肿。新生儿头颅MRI:1.早产儿脑改变;2.左侧室管膜下囊肿;3.双侧额颞部蛛网膜下腔轻度增宽、双侧顶部脑质外间隙稍增宽。心脏超声示:卵圆孔未闭(3.5mm)动脉导管未闭(1.3mm)。新生儿科住院期间给予人免疫球蛋白针应用抑制溶血,光疗退黄、输血纠正贫血(应用脐血储备血)、抗感染等治疗后,复查感染指标正常,黄疸逐渐消退,病情好转,患儿住院15天出院,随访患儿生后1个月、3个月、6个月、9个月生长及神经系统发育情况,生长及神经系统发育良好,患儿现9个月龄继续随访中。
胎儿溶血性贫血是妊娠期严重并发症,最常见于Rh(D)/非Rh(D)抗原相关红细胞同种异体免疫反应导致的胎儿红细胞破坏。胎儿贫血可用血红蛋白浓度和红细胞比容来定义。血红蛋白浓度低于平均值2个或以上标准差时诊断为胎儿贫血;临床常将胎儿红细胞比容小于30%作为临界值。宫内输血是最有效的治疗方法[20],国内外对Rh血型不合导致胎儿贫血行宫内输血治疗的报道较多,但对于RhD--缺失型引起的胎儿溶血性贫血病,国外仅存在极少数成功治愈的案例[18],有6例需要多次宫内输血和新生儿换血,在Deitenbeck的报道中换血治疗后还给予400mg/kg的丙种球蛋白[19]。本病例为RhD--缺失型引起的胎儿溶血性贫血病,本文根据本病例结合文献对Rh缺失型D--溶血导致胎儿贫血病例的多次宫内输血治疗进行总结。
血型是指血液成分(包括红细胞、白细胞、血小板)表面的抗原类型。通常所说的血型是指红细胞膜上特异性抗原类型,与临床关系最密切,人们所熟知的是红细胞ABO血型系统及Rh血型系统。临床血型检查只查A、B抗原及D抗原,只要D阳性就称Rh阳性血型,无D抗原的统称为Rh阴性血型,其他几种抗原很少常规筛查,包括Rh血型系统的其他抗原(c,C,e,E)及其他非典型抗体的抗原。Rh缺失型D--是Rh血型系统一种极为罕见的变异体,血清学特征表现为红细胞上Rh C/c、E/e抗原的完全缺乏和(或) D抗原的过量表达。Rh缺失型D--血型是最早由Race和Sanger于1950年发现[12]。目前为止,这种变异体的发生率还缺乏准确的统计学资料。Rh缺失型D--个体极易由输血、分娩相关胎母输血综合征、创伤、自然或人工流产、异位妊娠等致敏而产生高效价的抗C/c、E/e的联合抗体,该抗体可以通过胎盘进入胎儿体内致敏胎儿红细胞,引起严重的胎儿或新生儿溶血病,导致胎儿贫血、胎儿水肿和胎儿死亡。本例中患者血型为A型,Rh阳性,RH表型D+/C-/c-/E-/e-,Rh缺失型D--稀有血型,患者既往多次不良孕产史,此次怀孕体内含有抗C、c、e抗体,从而对胎儿红细胞产生破坏,造成贫血[13]。
母体体内对外来红细胞表面抗原致敏时会发生母体红细胞同种免疫反应,刺激母体产生IgG抗体,这些IgG抗体可以穿过胎盘并导致胎儿溶血性贫血[9]。胎儿贫血筛查可通过超声多普勒测量MCA-PSV,MCA-PSV > 1.5MoM作为筛查严重胎儿贫血的标准,确诊的方法是脐血穿刺查胎儿血红蛋白浓度[10]。本例孕妇为Rh缺失型D--稀有血型,孕20+6周监测MCA-PSV<1.5 MoM,定期监测MCA-PSV,孕25周时MCA-PSV>1.5 MoM,考虑胎儿重度贫血可能性大,遂行脐静脉穿刺以明确胎儿贫血程度,抽取胎儿脐血4ml分别行血常规及胎儿血型、RH表型、CMA检测,结果回示:胎儿血型:AB型RH阳性。RH表型D+/C+/c+/E-/e+,抗D效价:1:64,胎儿血红蛋白:52.00g/L;红细胞压积16.10%。进一步明确该孕妇为Rh缺失型D--血型不合引起的溶血性贫血,胎儿为重度贫血,遂行宫内输血治疗。
在产前检查中过程中应仔细询问输血史和妊娠史,并常规进行红细胞Rh系统5个抗原的检测及以外抗体筛查[13]。对于未致敏的RhD--缺失型个体,我们应履行告知义务,让他们尽量避免输血、流产。对于有意外免疫史的RhD--缺失型孕妇,应对其妊娠过程进行监测,如动态监测母体血清中抗体滴度,检查宫内胎儿生长发育情况等。母体血清抗体效价检测可以较为客观地评估母儿同种免疫反应和溶血性贫血严重程度[14],母体血清抗体效价升高常提示病情加重。MCA-PSV可预测胎儿贫血和需要宫内输血的风险。2000年,有研究首次提出MCA-PSV>1.5 MoM提示胎儿中重度贫血,敏感性可达100%,假阳性率为12%[15]。尽管MCA-PSV存在局限性,但仍被广泛使用。对于高危孕妇自孕17~18周开始监测,每隔1~2周进行复查。MCA-PSV>1.5 MoM提示胎儿中重度贫血,行脐静脉穿刺进一步明确中重度贫血诊断。胎儿脐血HCT<30%即可进行IUT[16]。本例孕妇孕20+6周监测MCA-PSV<1.5 MoM,定期监测MCA-PSV,孕25+2周时MCA-PSV:1.5 MoM,考虑胎儿中重度贫血可能性大,遂行脐静脉穿刺以明确胎儿贫血程度。
宫内输血(intrauterine transfusion, IUT)目前被认为是胎儿贫血的标准治疗方式,可以明显提高严重贫血胎儿的生存率。目前宫内输血方式包括腹膜腔内输注(intraperitoneal transfusion,IPT)和胎儿血管内输注(intravascular transfusion, IVT),后者包括经脐带近胎盘附着部位脐静脉穿刺和肝内血管穿刺输血两种方式。在操作技术可行的前提下,宫内输血方式首选IVT。宫内输血适用于妊娠18-35周,若胎儿大脑中动脉收缩期峰值流速(MCA-PSV)≥1.50中位数倍数(multiples of the median, MoM),通过经皮脐血取样获取胎儿血以测定血细胞比容/血红蛋白,胎儿血红蛋白值低于胎龄相应平均值2个标准差,胎儿血细胞比容小于30%.如出现以上任一情况,考虑行第一次IVT。本例患者首次输血前查脐血:胎儿血红蛋白:52.00g/L;红细胞压积16.10%,考虑重度贫血。因为罕见血型,积极备血,在联系到血源后于孕26+5周行第一次宫内输血,输血量根据超声估计的胎儿体重和目前胎儿HCT、预期HCT计算。孕24周后,目标HCT应在0.40~0.50之间[5]。输血速度维持在2~5 ml/min。因为后壁胎盘,手术方式为超声引导下胎儿肝内静脉输血。再次宫内输血仍需定期监测MCA-PSV,MCA-PSV预测胎儿贫血的敏感性随宫内输血次数增多而相应下降[1],因此监测MCA-PSV作为再次宫内输血的指征存在争议。输血后因同种免疫仍存在且继续,胎儿血红蛋白及HCT逐渐下降,估计血红蛋白平均每天下降4 g/L,HCT每天下降0.01[5]。有研究表明,在第2次宫内输血之后,估算红细胞破坏的公式比MCA-PSV更能准确反映病情[7]。再次宫内输血时机应个体化,根据胎儿状况、首次输血后胎儿HCT、预计HCT下降水平综合决定[17],而不能仅依靠胎儿MCA-PSV阈值决定。随着宫内输血次数的增加,供血者的红细胞逐渐取代胎儿红细胞,胎儿的造血功能被抑制。故宫内输血的间隔应随输血次数的增加而相应延长。本病例以胎儿宫内状况和输血后胎儿HCT、预计HCT下降水平作为再次宫内输血时机参考。
对于终止妊娠的最佳时机,目前尚无定论,应权衡孕周、胎儿预后、早产风险、再次宫内输血风险及胎死宫内风险等综合决定。大多数研究将宫内输血进行到孕32~34周[11],但也有报道宫内输血进行到孕35周,直至孕37~38周后分娩[12]。本例孕妇在4次宫内输血后定期监测MCA-PSV,根据末次输血后胎儿HCT0.45、预计孕35周HCT下降至0.29,患者于孕35周出现Ⅱ类胎心监护、自觉胎动减少、权衡继续妊娠及早产风险,于孕35周促胎肺成熟后行子宫下段剖宫产术终止妊娠,并获得了良好的结局。但因国内处理该类疾病的经验较少,能否继续期待治疗,有待进一步研究。
对于所有经过IUT治疗的病例,出生后都应该进行随访,而目前的研究显示,总体的远期结局是好的[5,6]。但这些儿童认知功能、社会功能、积极情绪等方面出现评分偏低的风险明显高于一般人群,行为困难亦较一般人群常见,尤其在伴发水肿的贫血胎儿出生群体中[7]。同时,这些接受IUT得以存活的贫血胎儿,成年后心血管疾病风险可能亦增加[8],因此,术前咨询时,应充分与孕妇及其家庭做好关于远期神经系统结局及心血管系统风险的告知。本病例新生儿生后颅脑超声提示存在脑室管膜下出血,头颅磁共振轻度异常,生后1、3、6、9个月由专业儿科医师评估生长和智力发育均正常。考虑到患者孕期未出现胎儿水肿,不良结局风险较水肿胎儿低,新生儿近期复查生长发育指标正常,暂时无需干预治疗,远期结局需严密随访。
所有作者均声明本研究不存在利益冲突



























