
例1,男,83岁,反复右侧鼻塞流涕涕中带血2月余,近感症状加重;例2,女,61岁,左侧鼻腔出血10余天。
例1患者2月余前无明显诱因下出现右侧鼻塞、流清涕、涕中带血伴嗅觉减退。查体见鼻粘膜肿胀,右侧鼻腔内暗红色新生物;例2患者10 d前及9 d前均出现左侧鼻腔出血,自行压迫可止,查体示无鼻塞,有副鼻窦压痛。
2例患者均在手术标本的病理学诊断下确诊。病理形态显示肿瘤细胞呈小蓝圆样,巢片状分布,核浆比高,核分裂像易见。免疫组化标记肿瘤细胞的结果显示:SMARCA4/BRG1(-)、SMARCB1/INI1(+),另外还不同程度表达上皮性和神经内分泌标记。其他鉴别诊断指标阴性。
2例患者均行手术治疗。
病理科;耳鼻咽喉科;头颈外科;放疗科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
SMARCA4属于SWI/SNF (SWIth Sucrose Nonfermentable)染色质重塑复合体,SMARCA4缺陷被视为一系列高度侵袭性未分化/去分化恶性肿瘤的驱动分子事件[1,2]。常见的SMARCA4缺失的肿瘤包括卵巢高钙血症型小细胞癌[3,4]、胸部未分化肉瘤[5,6]、以及胃肠道[7]和子宫内膜未分化癌[8]等。鼻腔鼻窦内SMARCA4缺失的癌罕见,目前仅有13例报道[9,10,11,12]。诊断主要依靠病理学形态结合SMARCA4免疫组化染色。该肿瘤侵袭性强,临床分期高,预后差。本文的2例丰富了鼻腔鼻窦SMARCA4缺失的癌疾病谱,旨在提升对本病的认识和鉴别能力。
收集浙江省人民医院2020—2021年诊断的鼻腔鼻窦SMARCA4缺失的未分化癌2例。两位患者在手术前均未接受过任何治疗。例1,83岁,男,由于反复的右侧鼻塞、流涕和涕中带血2月余就诊。患者无明显诱因下出现右侧鼻塞、流清涕、涕中带血伴嗅觉减退。左侧鼻腔无异常症状。两月来症状反复,未予治疗。近来感右侧鼻腔鼻塞流涕,涕中带血等症状加重,遂来就诊。该患者有吸烟史50年,每日10支,现未戒烟;饮酒史50年,每日200 ml,现未戒酒。例2,61岁,女,10 d前及9 d前均在无明显诱因下出现左侧鼻腔出血,自行压迫止住,无鼻塞,无左鼻疼痛。
两位患者均行MRI检查。例1,MRI报告提示右侧鼻腔、筛窦内可见一大小约44 mm×26 mm×44 mm的软组织肿块,伴邻近多发骨质吸收破坏,考虑交界性或偏恶性肿瘤性病变。例2,MRI报告提示左侧鼻腔、筛窦内见团块状异常信号,大小约44 mm×36 mm×21 mm,病灶边界清,考虑内翻性乳头状瘤或鼻息肉,纤维血管瘤和淋巴瘤待排。两位患者手术指征明确,遂行内镜下肿瘤切除术。
术后标本进行病理检查。标本经3.7%中性甲醛固定,常规脱水,石蜡包埋,4μm切片及HE染色。免疫组化采用EnVision两步法,所用抗体:SMARCA4 (anti-BRG1 antibody, clone EPNCIR111A, 1:100; Abcam, Cambridge, UK);SMARCB1/INI1)、AE1/AE3、CgA、Syn、HMB45、Desmin、Ki67、P40、P63、Calretinin和S-100均购自北京中杉金桥生物技术有限公司。染色过程按照抗体说明书操作并设立阳性和阴性对照。判读标准为SMARCA4/BRG1、SMARCB1/INI1、INSM1、Ki67、P40和P63阳性定位于细胞核,Calretinin和S-100蛋白阳性定位于细胞核/质,AE1/AE3、CgA、Syn、HMB45和Desmin阳性定位于细胞质,CD99和LCA阳性定位于细胞膜。
明确诊断主要依靠病理检查。两病例病理形态及免疫组化表达相近。大体观察:由于2例肿瘤均经腔镜辅助下切除,因此送检标本较破碎,组织切面呈灰白色,实性质中。镜下观察:低倍镜下见肿瘤无包膜,例2可以观察到肿瘤侵犯黏膜固有层,伴有表面糜烂。肿瘤细胞呈巢片状分布,纤维性间隔将肿瘤细胞分成大小不等的巢团。巢团内细胞弥漫片状分布,例1局灶可见假菊形团样结构形成,例2部分肿瘤巢团中央可见坏死。高倍镜下,肿瘤细胞核浆比高,核卵圆形或多角形,核的大小约为淋巴细胞核的2~3倍,染色质呈粗颗粒样,有一个或多个嗜碱性核仁,胞浆稀少呈弱嗜碱性,细胞之间边界不清。例2局灶可见胞浆空泡。核分裂像可达11个/HPF。肿瘤间质主要由纤维构成,小血管散在分布,管腔开放。肿瘤细胞间有淋巴细胞散在分布。未观察到明确的腺样和鳞状结构(图1,图2)。肿瘤细胞的免疫组化染色结果显示(图3,图4):SMARCA4/BRG1(-,表达丢失)、SMARCB1/INI1(+,表达保留)、AE1/AE3 (点灶状+)、INSM1 (部分+)、CgA (部分+)、Syn (部分+)、ki67(热点区约85%)、CD99 (-)、S-100 (-)、calretinin (-)、HMB45 (-)、Desmin (-)和LCA (-)。另外,例2的肿瘤细胞呈现少数散在的P40和P63阳性。
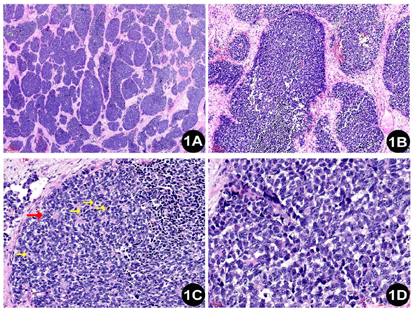

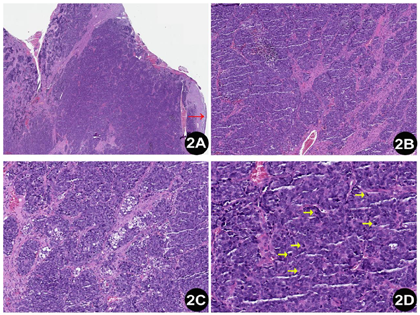

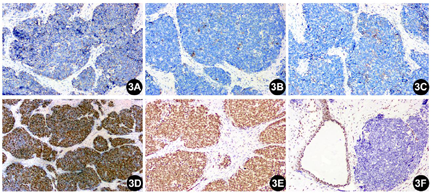

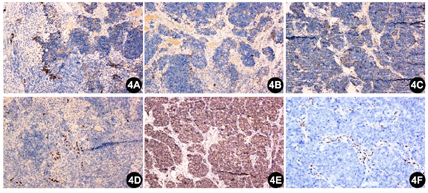

这2例的病理形态学表现为高级别"蓝细胞"呈巢片状分布,核浆比高,核分裂像活跃;免疫组化染色提示肿瘤细胞SMARCA4/BRG1表达缺失,而SMARCB1/INI1表达保留,另外肿瘤还不同程度表达上皮性标记和神经内分泌标记,例2还少量表达鳞状分化的标记。结合形态学和免疫组化染色结果,本例最终诊断为鼻腔鼻窦SMARCA4缺失的未分化癌。
鼻腔鼻窦差分化"蓝细胞"肿瘤的鉴别诊断种类繁多,主要包括:上皮源性肿瘤(非角化鳞状细胞癌)、神经外胚层肿瘤(嗅神经母细胞瘤、骨外Ewing肉瘤)、间叶性肿瘤(恶性黑色素瘤、横纹肌肉瘤)和淋巴造血系统肿瘤(结外NK/T细胞淋巴瘤)等。根据本例的形态学和免疫组化染色结果,这些鉴别诊断可以逐一排除。
两位患者均行手术治疗。
本文展示了2例发生于鼻腔鼻窦内的SMARCA4缺失的未分化癌。一位患者是老年男性,因鼻塞流涕入院,MRI提示为侵袭性的肿瘤性病变,另一位是中老年女性患者,因鼻出血入院,MRI报告考虑为良性病变。术后组织学检查发现该肿瘤由高级别"蓝细胞"构成巢片状结构,表达广谱上皮标记,SMARCA4缺失而SMARCB1保留,还局灶表达神经内分泌标记,其中一例还散在表达鳞状上皮的标记。
SMARCA4和SMARCB1同属于SWI/SNF复合体,参与染色体结构的重塑[1]。SMARCA4缺陷的恶性肿瘤主要由一致的基底样小细胞或上皮样大细胞组成,伴或不伴有横纹肌样特征[1,2]。免疫组化是检测SMARCA4状态的便捷方法。这类肿瘤都有SMARCA4的缺失,但SMARCB1往往保留,伴或不伴SMARCA2的缺失[1,11]。Agaimy等[11]总结了10例鼻腔鼻窦SMARCA4缺失的癌,肿瘤细胞呈基底样小细胞或上皮样大细胞,形成弥漫实性巢片状结构,伴凝固性坏死。所有肿瘤均AE1/AE3阳性,局灶或弱表达神经内分泌的标记,最重要的是每例都有SMARCA4的表达缺失和SMARCB1表达保留[11]。治疗主要是采取手术结合放疗和/或化疗的方法,随访中该肿瘤的病死率高达66%(中位生存期3个月)[11]。其余3例都是个案报道。值得一提的是,Mibayashi等[12]报道了一位带瘤生存的治疗病例。患者治疗前通过组织活检确诊为SMARCA4缺失的癌,随后进行了化疗、放疗以及免疫治疗(免疫检查点抑制剂nivolumab),7个月后MRI提示肿瘤缩小,再次活检组织的病理检查发现肿瘤细胞形态变温和、分化更成熟,该患者在确诊后带瘤生存达1年余[12]。这也为该肿瘤的治疗提供了新的思路以期延长患者的生存期。
由于该肿瘤的病理形态缺乏特异性,且在使用常见免疫组化标记初筛时仅表达上皮标记和神经内分泌的标记,有可能会被诊断为鼻腔鼻窦未分化癌或神经内分泌癌。日常工作中,未分化癌往往被视为上皮源性恶性肿瘤缺乏明确分化方向时的一种排除性诊断。然而,随着对这些差分化恶性肿瘤的不断认识和检测方法的进步,一些伴有明确的新型分子表型改变的肿瘤逐渐被认识和命名,如NUT癌、SMARCB1/INI1缺失的未分化癌和SMARCA4/BRG1缺失的未分化癌。这三者的形态学及免疫组化染色常有交叉,也应纳入鼻腔鼻窦差分化癌的鉴别诊断考虑中。相较于鼻腔鼻窦未分化癌好发于老年人,NUT癌更倾向于年轻人和儿童发病[13]。形态学上,肿瘤由未分化的细胞排列成片巢状构成,染色质粗糙,常常有坏死,部分可见突然角化的现象。除了广谱上皮标记阳性,NUT癌还弥漫核表达NUT和P63,伴有NUT基因重排[14],可以帮助诊断。SMARCB1/INI1缺失的未分化癌也是高度侵袭性的肿瘤,病死率高达56%,中位生存期15个月[15]。虽然肿瘤也可具有基底样细胞的形态,但常常出现浆细胞样/横纹肌样的细胞,表现为核偏位伴有丰富的嗜酸性胞质,具有鉴别诊断的提示作用[15,16]。其免疫组化染色显示SMARCB1/INI1的缺失,而SMARCA4/BRG1表达保留,伴或不伴有SMARCA2缺失,另外还有超过一半的病例表达CK5和P63[15]。另一方面,尽管这些肿瘤在形态学上都可表现为未分化肿瘤,但鼻腔鼻窦未分化癌中检测到频繁的IDH2突变(约80%)[10,17],与SMARCB1/INI1失活和SMARCA4/BRG1失活可能是互斥的驱动性分子事件[11],提示它们可能是单独的肿瘤实体,但这仍需更大样本量的研究以进一步丰富对该肿瘤的认识。
再者,鉴别SMARCA4缺失的未分化癌与神经内分泌癌也颇具挑战性。虽然低分化神经内分泌癌常失去"器官样"结构而弥漫生长,但其肿瘤间质富于血窦,细胞核呈"盐+胡椒样",且神经内分泌标记的表达较其他肿瘤强而弥漫,常伴有P53突变,这些特征提示神经内分泌癌的诊断。而SMARCA4缺失的未分化癌表达神经内分泌免疫组化标记往往是局灶的弱阳性。此外,本文例2的肿瘤细胞还表达鳞状上皮分化的标记P40和P63,提示肿瘤可能有多向分化的特点,但这种表达也是少数的点灶状阳性,并不能成为诊断相关肿瘤的依据。
鼻腔鼻窦SMARCA4缺失的未分化癌往往临床分期高,病理分化差,表现出高度侵袭性的生物学行为。明确的诊断有助于临床医生采取更加积极的治疗措施和有效的评估预后。但是由于目前病理医生对SMARCA4缺失的未分化癌认识有限,且很多病理科并没有常规配备SMARCA4/BRG1免疫组化抗体,这在一定程度上限制了这一类肿瘤的诊断。
综上所述,我们描述了2例鼻腔鼻窦SMARCA4/BRG1缺失的未分化癌,由弥漫的高级别"蓝细胞"构成巢片状结构,增殖活跃,无明确腺样和鳞状分化。该肿瘤表达广谱上皮标记,SMARCA4/BRG1缺失而SMARCB1/INI1保留,还局灶表达神经内分泌标记。本文两个病例扩大了鼻腔鼻窦SMARCA4/BRG1缺失的未分化癌的疾病谱,旨在提高对本病的认识,减少漏诊和误诊。
所有作者均声明本研究不存在利益冲突



























