
患者女性,58岁,阴道不规则出血2个月余。于外院行B超检查示:子宫内膜增厚约1 cm,宫腔积液。患者平素月经规则,无痛经。
2个月前月经来潮后间断阴道流血,无腹痛。
盆腔核磁共振发现宫体及下部左侧壁内膜不均匀增厚并异常信号小结节,考虑子宫内膜癌可能。行"宫腔镜检查及诊断性刮宫术",活检标本病理诊断(宫腔组织)考虑子宫内膜样腺癌。
行"腹腔镜下广泛子宫切除+盆腔淋巴结清扫+双侧附件切除术"。术后手术标本病理诊断:(子宫底近左宫角)子宫内膜未分化癌。分子分型:微卫星高度不稳定型(MSI-H)。(右侧)输卵管高级别浆液性癌,SET(solid,endometrial-like,transitional,实体状、假子宫内膜样及移行细胞样)亚型。术后行TP方案(力朴素240 mg+卡铂600 mg)化疗6个周期。
患者目前一般情况良好,定期复查。
病理科;妇科;肿瘤科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
子宫内膜未分化癌是一类无明确分化方向的恶性上皮性肿瘤,伴有分化型癌时归入去分化癌。此类肿瘤少见,具有高度侵袭性,病程进展迅速且预后差。临床工作中极易误诊为实性生长的子宫内膜样癌,导致诊断不足[1,2]。子宫及附件同时发现肿瘤时,准确鉴别双原发或转移至关重要。我们报道1例罕见的子宫内膜未分化癌同时合并输卵管高级别浆液性癌,期望提高对去分化癌的认识,并熟悉鉴别肿瘤原发与转移的诊断要点,为临床治疗方案的选择及预后评估提供可靠依据。
患者,女性,58岁。阴道不规则出血2个月余。外院妇科B超示子宫内膜增厚约1 cm,宫腔积液。外院行子宫内膜诊刮考虑子宫内膜样癌。患者平素月经规则,无痛经。既往行双侧输卵管结扎术。
实验室检查:血肿瘤标志物未见异常。
临床诊断:子宫内膜恶性肿瘤。
完善术前检查后,于2021年2月7日行"腹腔镜下广泛子宫切除+盆腔淋巴结清扫+双侧附件切除术"。
送检广泛子宫+双侧附件切除标本。
肉眼所见:宫腔底部近左宫角见1.2 cm×0.6 cm粗糙区(病灶一),切面灰白,层次欠清,其余内膜光滑。右侧输卵管8 cm×0.8 cm,壶腹部管径增粗至2.5 cm,切开管腔内见黏膜部分区域灰白粗糙,分布范围约1.3 cm×1 cm(病灶二)。余部位外观及切面无明显异常。
镜下见:
病灶一:子宫内膜层内局部腺体密集排列,相互融合形成筛孔结构,细胞轻-中度异型。紧邻腺体密集区见实性片状生长的肿瘤组织,并浸润子宫肌壁浅层;该区域肿瘤细胞弥漫成片,无明显巢状或腺样结构,细胞形态单一,中等大小,泡状核伴有小核仁;核分裂活跃(>30个/10 HPF)(图1)。
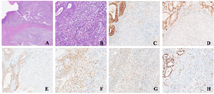

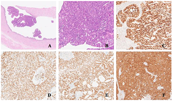
病灶二:肿瘤组织主向输卵管腔内外生性生长,实性成片及圆钝的粗乳头样,局部形成筛孔结构;细胞明显异型,核分裂多见(图2)。

初步考虑:
病灶一:腺体融合区域为低级别子宫内膜样癌;实性片状生长区域无明确分化方向,需鉴别多种疾病,包括子宫内膜样癌的实性生长区域、实性生长的浆液性癌、神经内分泌癌、未分化癌、未分化肉瘤或高级别子宫内膜间质肉瘤等。
病灶二:输卵管高级别癌,组织学类型以及原发与转移均不能明确。
本病例宫腔及右侧输卵管肿瘤免疫组化染色结果分别列于表1、表2及图1、图2。同时对宫腔肿瘤两种不同形态区域及右侧输卵管肿瘤分别行二代测序(next-generation sequencing,NGS)检测,结果见表3。
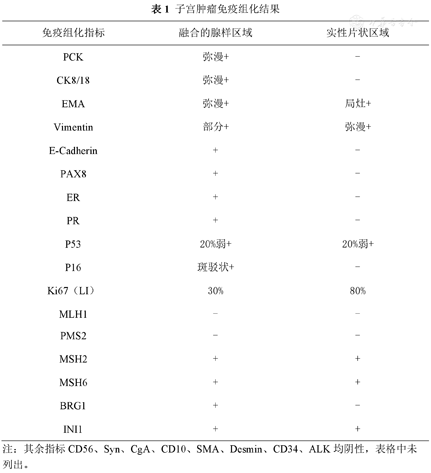
子宫肿瘤免疫组化结果
子宫肿瘤免疫组化结果
| 免疫组化指标 | 融合的腺样区域 | 实性片状区域 |
|---|---|---|
| PCK | 弥漫+ | - |
| CK8/18 | 弥漫+ | - |
| EMA | 弥漫+ | 局灶+ |
| Vimentin | 部分+ | 弥漫+ |
| E-Cadherin | + | - |
| PAX8 | + | - |
| ER | + | - |
| PR | + | - |
| P53 | 20%弱+ | 20%弱+ |
| P16 | 斑驳状+ | - |
| Ki67(LI) | 30% | 80% |
| MLH1 | - | - |
| PMS2 | - | - |
| MSH2 | + | + |
| MSH6 | + | + |
| BRG1 | + | - |
| INI1 | + | + |
注:其余指标CD56、Syn、CgA、CD10、SMA、Desmin、CD34、ALK均阴性,表格中未列出。

右侧输卵管肿瘤免疫组化结果
右侧输卵管肿瘤免疫组化结果
| 免疫组化指标 | 右侧输卵管肿瘤 |
|---|---|
| PAX8 | + |
| ER | + |
| WT1 | + |
| P53 | 弥漫强+ |
| P16 | + |
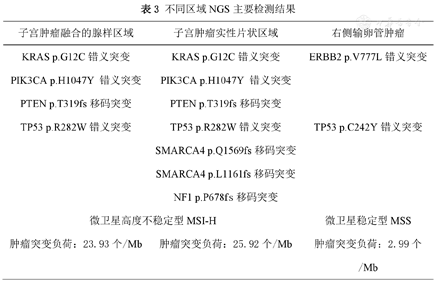
不同区域NGS主要检测结果
不同区域NGS主要检测结果
| 子宫肿瘤融合的腺样区域 | 子宫肿瘤实性片状区域 | 右侧输卵管肿瘤 |
|---|---|---|
| KRAS p.G12C错义突变 | KRAS p.G12C错义突变 | ERBB2 p.V777L错义突变 |
| PIK3CA p.H1047Y错义突变 | PIK3CA p.H1047Y错义突变 | |
| PTEN p.T319fs移码突变 | PTEN p.T319fs移码突变 | |
| TP53 p.R282W错义突变 | TP53 p.R282W错义突变 | TP53 p.C242Y错义突变 |
| SMARCA4 p.Q1569fs移码突变 | ||
| SMARCA4 p.L1161fs移码突变 | ||
| NF1 p.P678fs移码突变 | ||
| 微卫星高度不稳定型MSI-H | 微卫星稳定型MSS | |
| 肿瘤突变负荷:23.93个/Mb | 肿瘤突变负荷:25.92个/Mb | 肿瘤突变负荷:2.99个/Mb |
最终病理诊断:子宫内膜未分化癌,分子分型:微卫星高度不稳定型(MSI-H);合并右侧输卵管原发高级别浆液性癌,SET亚型。
鉴于宫腔及输卵管肿瘤诊断为双原发,FIGO分期均归入IA期;术后行TP方案(力朴素240 mg+卡铂600 mg)化疗6个周期。
术后完成6个周期化疗,定期复查中;最近一次复查时间为2021年10月4日,目前患者一般情况良好。
本病例同时检出宫腔及右侧输卵管肿瘤,组织学类型及肿瘤的原发与转移均需明确。宫腔肿瘤呈现两种截然不同的生长方式,免疫表型也不尽相同。腺体融合区域为经典型低级别子宫内膜样癌表型伴有错配修复蛋白表达缺失。而实性生长区域除EMA局灶阳性,不表达其他上皮标记、E-cadherin及神经内分泌标记,排除实性生长的子宫内膜样癌、浆液性癌及神经内分泌癌;子宫间叶肿瘤(CD10、CyclinD1 、SMA、desmin)标记均不表达,且此区域亦伴有错配修复缺陷,基本排除子宫肉瘤可能;恶性中胚叶混合瘤中癌的成分多为高级别癌,与本病例不符。目前免疫表型提示实性区域肿瘤无特异性分化方向,伴有错配修复缺陷及染色体重塑复合体亚单位BRG1表达缺失,支持其为未分化癌;结合伴随的低级别子宫内膜样癌,诊断为子宫内膜未分化癌依据充分。
右侧输卵管肿瘤镜下呈实性、腺样及移行细胞样生长方式,形态与子宫内膜肿瘤有部分重叠,肿瘤弥漫表达PAX8、ER、WT-1、P53及P16,为经典的高级别浆液性癌的免疫表型。
当子宫及附件同时发现高级别肿瘤时,首选一元论解释[3]。本病例宫腔及右侧输卵管同时出现高级别癌,免疫表型与一元论不符,我们对两处3种不同形态的肿瘤成分分别进行NGS检测。结果显示低级别子宫内膜样癌中检测出的主要突变均可在未分化癌成分中检出,且两种形态均为MSI-H,伴有较高的肿瘤突变负荷,证明宫腔内两种不同形态的肿瘤具有相同的克隆起源;除此之外,未分化癌还检出SMARCA4基因25号及33号外显子移码突变,与BRG1表达缺失一致。而右侧输卵管肿瘤基因突变与子宫肿瘤截然不同,主要为ERBB2及TP53基因错义突变,同时微卫星稳定伴有较低水平的肿瘤突变负荷;NGS检测从分子水平证实本病例为罕见的宫腔与右侧输卵管双原发肿瘤。
研究表明,SMARCA4(编码蛋白BRG1)、SMARCB1(编码蛋白INI1)这两种互斥性SWI/SNF核心催化亚单位基因失活,参与子宫内膜未分化癌的形成,其中SMARCA4基因失活更常见[4,5]。推荐在日常工作中,对子宫内膜未分化癌常规检测BRG1或INI1表达情况,可反映SMARCA4或SMARCB1基因失活状态。另外,MSI-H型子宫内膜癌肿瘤突变负荷较高,导致新抗原的数量显著增多,利于诱发机体的抗肿瘤免疫应答,可能从免疫治疗中获益[6,7,8]。
盆腔高级别浆液性癌SET亚型伴有更高比例的BRCA基因突变,且与同源重组缺陷(homologous recombination-deficient,HRD)相关[9]。伴有HRD的肿瘤通常HE形态都不是经典的高级别浆液性癌,因此对SET亚型在内的非经典组织学形态的高级别浆液性癌,应积极推荐患者做HRD相关分子检测,为临床筛选出可能的PARP抑制剂的获益人群。
我们着重阐述了子宫内膜未分化癌的诊断与鉴别诊断及分子表型。子宫内膜未分化癌/去分化癌具有高度侵袭性,预后差,尤其需与分化差的子宫内膜样癌鉴别。伴有SWI/SNF复合体功能缺陷者预后更差[5],推荐常规行免疫组化检测INI1及BGR1。另外对于子宫及附件同时出现肿瘤时,应尽可能多平台检测明确为双原发或转移。重视免疫组化、分子病理检测在诊断中的应用,准确的病理诊断,才能为临床后续治疗方式的选择及预后评估提供依据。
所有作者均声明本研究不存在利益冲突



























