
患者血清PSA异常伴持续性上升3年。
患者无明显不适,无尿频、尿痛、尿急及排尿困难,无肉眼血尿。直肠指检:前列腺右叶质地略硬。
经直肠引导下可疑目标穿刺联合系统穿刺,病理诊断前列腺腺癌,Gleason评分3+3。
全麻下行冷冻联合激光前列腺右叶消融术,在经直肠超声引导下对前列腺右侧移行区、右侧周缘区中部和外侧行冷冻消融治疗,对右侧周缘区旁正中行局部激光消融治疗。
患者术后恢复良好,血清PSA 5年随访中均未达肿瘤复发水平。
超声科;泌尿外科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
随着血清前列腺特异性抗原(prostate specific antigen, PSA)、直肠指检及系统穿刺作为前列腺癌筛查及确诊方法的广泛应用,前列腺癌检出率在提高的同时其肿瘤分期有着下降的趋势,约75%的前列腺癌在确诊时为局限性前列腺癌,为提高治愈率创造了条件[1]。前列腺癌的病理特点为多灶性,故理论上应采用前列腺根治术和放射治疗等全腺体治疗方案。然而在临床实际应用中,由于前列腺根治术根治手术创伤大,而前列腺癌患者又是以老年男性为主,伴随疾病多,故相当一部分患者在发现前列腺癌时已失去手术的机会[2]。对于前列腺癌放射治疗来讲存在40%放射性肠炎的并发症发生率[3],其中严重的放射性肠炎可导致肠梗阻或肠穿孔而威胁生命。2002年,Onik等[4]首先报道了前列腺癌局部治疗,该方法在消融肿瘤病灶的同时,保留部分正常的前列腺组织。与前列腺全腺体治疗相比,局部治疗能在控制肿瘤发展的同时明显降低治疗的并发症发生,因而为年老体弱的前列腺癌患者提供了安全有效的治疗方法。
本病例已获得患者本人的知情同意,并经上海交通大学医学院附属新华医院伦理委员会审查后批准(XHEC-D-2022-050)。
患者,男性,70岁,主诉:穿刺确诊前列腺癌7 d。
现病史:患者3年体检时发现血清PSA 4.12 ng/ml,以后常规复查,结果呈持续上升,入院前检测PSA为6.04 ng/ml,fPSA 0.7 ng/ml。患者无血尿、无尿频尿急尿痛、无排尿困难。入院前7 d因经直肠超声提示前列腺发现右侧周缘区前列腺癌可疑病灶,且血清PSA升高而行超声引导下前列腺穿刺活检术,病理诊断为前列腺腺癌,Gleason评分3+3,门诊拟"前列腺癌"收治入院。
既往史:高血压病史6年,冠状动脉粥样硬化病史5年,目前心功能Ⅱ级,否认前列腺癌家族史,否认手术史及冶游史。
前列腺直肠指检:2F+,右叶质地略硬。
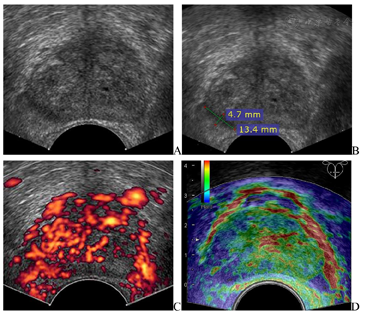
(1)经直肠超声(图1):前列腺右侧周缘区低回声结节,大小约13 mm×5 mm,无明显向前列腺包膜外隆起;结节内部血流信号丰富;弹性成像该低回声质地硬,评分4分。超声诊断:前列腺右侧周缘区实质性结节,前列腺癌可能,建议超声引导下穿刺活检。

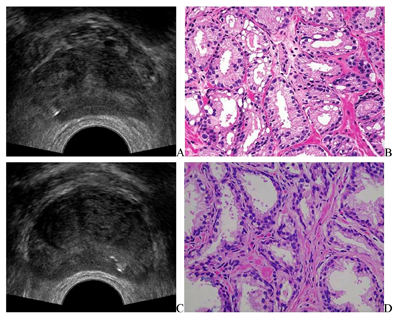
(2)前列腺穿刺活检(图2):采用经直肠引导下经会阴穿刺活检术,穿刺方案为目标穿刺联合12点系统穿刺,共穿刺15针。穿刺病理诊断:右侧周缘区外侧、右侧周缘区中部、右侧周缘区旁正中为前列腺腺癌,Gleason评分3+3。

(3)全身骨显像未见明显骨转移征象。
(4)肺部CT检查未见明显异常。
前列腺腺癌,Gleason评分3+3,cT2a期。
患者年龄70岁,PSA 6.04 ng/ml,前列腺穿刺病理为前列腺腺癌,Gleason评分3+3,肿瘤局限于右侧叶,临床分期为cT2a期,符合前列腺癌根治手术指征,但患者患有高血压及冠心病,并结合患者本人及家属的意愿,暂不考虑前列腺癌根治手术。根据专家共识对于临床分期在cT2a期或以下的前列腺癌可采用前列腺癌局部治疗[5],给予右侧前列腺腺体消融治疗方案。
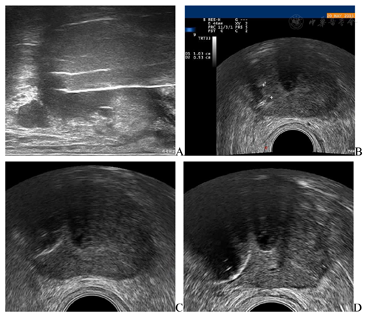
冷冻消融治疗(图3):患者全麻后取膀胱截石位,充分暴露会阴部,置入尿道保温装置。在经直肠超声引导下下先行前列腺右叶冷冻消融,超声仪器为Mylab Twice超声诊断仪(Esaote, Florence, Italy),TRT33双平面探头;冷冻仪器采用Endocare CryoCare CS冷冻仪(Varian Medical Systems, USA),3.0 cm V-Probe冷冻刀。经直肠超声引导下经会阴将冷冻刀分别穿刺置入前列腺右叶后外侧和前内侧,二根冷冻刀前后相距1 cm,左右相距0.5 cm;后外侧冷冻刀距直肠1.7 cm,前内侧冷冻刀距尿道1.6 cm。完成冷冻刀置入后,先开启前内侧冷冻刀按钮进行冷冻,待冰球出现后再开启后外侧冷冻刀按钮进行前列腺右叶冷冻消融术。先用80%冷冻功率冷冻4 min,温度降至-80 ℃,当冰球覆盖大部分右侧腺体,且与直肠距离为0.5 cm时,功率调低至60%,作为冷冻维持至10 min。然后进入复温模式,12 min后复温至4 ℃;然后再按上述操作流程进行第二循环冷冻治疗。

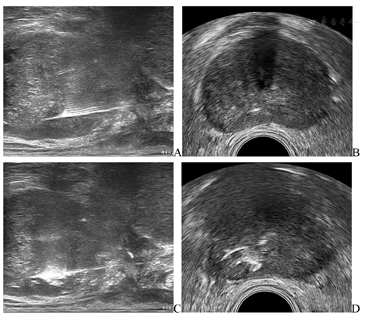
激光消融治疗(图4):由于形成的冰球在前列腺与直肠之间呈弧形,为避免直肠冻伤,在消融时会有部分前列腺组织未能完全冷冻,故本例在完成冷冻消融后,采用激光对前列腺右侧周缘区旁正中进行局部消融,仪器使用Elesta Echolaser (Esaote, Florence, Italy)激光诊疗仪,使用21G PTC针在经直肠超声引导下置于前列腺右侧周缘区旁正中,拔出针芯导入激光光纤进行激光消融,在经直肠超声监测下完成该部位消融,总能量2700 J,消融范围12 mm×8 mm。治疗完成后,会阴部加压包扎,撤出尿道保护装置,置入Foley留置导尿管,并于2周后拔管。

尿道和直肠保护:治疗过程中采用经直肠超声严密监测冰球的覆盖范围以保持冰球与尿道或直肠之间有0.5 cm安全距离。此外,为保证消融彻底的同时避免直肠冻伤,将心内注射针在超声引导下置于Denonvillier筋膜内,随后通过注射针筒注入生理盐水在前列腺和直肠之间形成隔离。同时在尿道保护装置内注入温水(冷冻消融时)或冷水(激光消融时)以避免尿道受伤。
术后患者无发热、无会阴部疼痛、无明显全身不适症状。拔去留置导尿管后患者无排尿困难,无尿失禁。
患者于术后1个月、3个月、6个月及12个月进行血清PSA随访,其测值分别为5.67 ng/ml、3.42 ng/ml、2.29 ng/ml及1.83 ng/ml,之后改为6个月一次血清PSA检查至术后5年,测值在1.96~3.12 ng/ml之间。此外,在术后每6个月进行MRI随访,均未发现前列腺内复燃病灶。该患者在术后第5年行前列腺特异性膜抗原(prostate specific membrane antigen, PSMA) PET/CT,结果显示全身未发现前列腺癌复发,未见转移病灶。
前列腺癌局部治疗是指针对前列腺癌病灶进行消融治疗,与前列腺根治手术、放射治疗等全腺体治疗方法相比,该治疗方法能在控制肿瘤的同时,更好地保全患者的排尿功能及性功能,亦能最大限度地减少治疗并发症发生。前列腺癌局部治疗的指征,目前达成地共识为同时满足血清PSA≤20 ng/ml、前列腺穿刺病理Gleason评分≤7及临床分期≤cT2a期[6]。本例患者PSA 6.04 ng/ml、前列腺穿刺病理Gleason评分6分、临床分期为cT2a期,符合前列腺癌局部治疗的指征。
前列腺癌局部治疗方案包括针对病灶的靶向消融治疗、1/2腺体治疗和3/4腺体治疗,选择何种方案取决于术前前列腺癌的位置范围和患者的全身情况。然而,病理研究发现约80%的前列腺癌具有多发病灶及其异质性特点,这对精准评估前列腺癌病灶带来障碍,似乎对前列腺癌局部治疗方案的选择带来困难[7]。直至2009年Liu等[8]通过对前列腺癌原发病灶及其转移灶的基因比对分析,发现前列腺癌转移灶是起源于前列腺内病理分级最高的病灶,并称其为前列腺指示癌病灶,即前列腺指示癌是决定其发生发展的最重要病灶,这一发现为前列腺癌局部治疗提供了理论依据。目前的专家共识主张采用影像学与系统穿刺结合的方法来评估指示癌的位置及范围,并据此制定局部治疗的方案[6]。本例患者的超声检查及其目标穿刺、系统穿刺的结果显示右侧周缘区前列腺癌病灶为其指示癌,因而制订了针对前列腺右侧叶的1/2腺体消融治疗方案。
目前应用于临床的前列腺癌局部治疗方法主要为冷冻消融、高强度聚焦超声、激光消融,现有研究结果表明这些治疗方式均可获得满意的肿瘤控制效果,术后无生化复发生存率为76%~100%[9]。然而,上述这些消融方法在具体应用中有着各自的优势和不足,其中冷冻治疗方法其消融面积较大、消融时间相对较短,但因产生的冰球在覆盖面上易造成不完整,尤其是前列腺周缘区,因该处与直肠毗邻,冰球与其呈弧形接触,有时为避免直肠冻伤减小冰球体积,导致有些部位消融不全。激光消融治疗其治疗精准性好、安全性高,但存在单根光纤消融范围小致总体消融时间长,而多光纤消融成本高的缺陷。而高强度聚焦超声,虽然该法的安全性和有效性亦得到证实,但其设备及治疗程序相对复杂、专业性高,影响临床普及应用。本病例采用的是冷冻联合激光消融方法,此方案结合了冷冻的消融范围大和消融时间短以及激光的小范围内精准可控消融的优势,顺利完成前列腺右叶(1/2腺体)的消融治疗,经术后5年随访,无肿瘤复发,无肿瘤转移发生。同时,在治疗中应用经直肠超声进行实时监测、Denonvillier筋膜注射生理盐水形成隔离带以及尿道保护装置的温水/冷水注入,有效地保护了尿道及尿道括约肌、直肠和血管神经丛,术后无并发症发生。
依据Muller BG等专家制订的专家共识,前列腺癌局部治疗术后1个月、3个月、6个月、12个月随访血清PSA,术后6个月、12个月MRI复查;1年后每6个月随访血清PSA和MRI评估[10]。本例患者依据上述方法经5年随访,无复发、无转移发生。
随着影像技术的发展,前列腺癌病灶尤其是指示癌病灶的检出率越来越高,为前列腺癌局部治疗方案制定提供精确信息。而前列腺癌消融技术设备的不断发展及其联合应用的优势,前列腺癌治疗从创伤大的全腺体治疗逐渐向微创的局部治疗发展,实现在灭活肿瘤、控制肿瘤发生发展的同时保全患者的正常生理功能,提高患者生命质量的同时提高生活质量。
所有作者均声明本研究不存在利益冲突



























