
患者,男性,59岁,曾因心房颤动于当地医院就诊,血清游离三碘甲腺原氨酸、游离甲状腺素升高,促甲状腺激素水平正常,诊断为甲状腺功能亢进症。长期应用抗甲状腺药物治疗,甲状腺功能始终未达标。自幼记忆力差,计算能力及数学成绩差。
自诉怕热、多汗,体重下降等症状。甲状腺触诊,双叶均可触及约2 cm结节,活动度良好。
生长抑素试验和碘塞罗宁(LT3)抑制试验提示患者垂体、肝脏和肌肉组织均存在不同程度甲状腺激素抵抗。垂体MRI未见异常。TRβ基因全外显子测序结果显示:患者TRβ基因第11外显子存在杂合突变,c.C1357T,p.(Pro453Ser)。
酒石酸美托洛尔、华法林、钙尔奇D和罗盖全骨化三醇胶丸治疗。
患者心脏超声结构基本正常。国际标准化比值(INR)控制在2.0~3.0之间。髋关节和腰椎骨密度正常。甲状腺超声复查不提示甲状腺癌征象。
内分泌与代谢病科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
甲状腺激素抵抗综合征(resistance to thyroid hormone,RTH)是由于甲状腺激素受体(thyroid hormone receptor,TR)基因突变,引起靶器官对甲状腺激素(thyroid hormone,TH)的敏感性降低,导致TH对全身组织器官作用障碍的一种罕见综合征[1]。根据突变受体亚型不同,可分为TRα基因突变致RTH( RTHα)和TRβ基因突变致RTH( RTHβ)[2]。RTHβ主要特点是循环血中甲状腺素(T4)和三碘甲腺原氨酸(T3)水平升高、促甲状腺激素(thyroid-stimulating hormone,TSH)水平正常或升高[3]。临床医师容易将RTHβ误诊为甲状腺功能亢进症,予以抗甲状腺药物、放射性碘治疗或手术治疗,进而导致TH抵抗加重[4,5],因此对该病的正确诊断非常重要。
患者,汉族,男性,59岁。2014年发现心房颤动,怕热、多汗,体重下降,于辽宁省葫芦岛市中心医院心内科住院治疗。入院后完善相关检查,甲状腺功能示:FT3、FT4升高,TSH水平正常。心电图示:心房颤动。给予酒石酸美托洛尔、华法林抗凝治疗。
之后患者于解放军第三一三医院复查甲状腺功能,FT3、FT4升高,TSH水平正常,诊断为"甲状腺功能亢进症",给与丙基硫氧嘧啶(PTU)治疗,FT3、FT4正常,TSH升高,更换为甲巯咪唑治疗甲状腺功能亢进症,之后多次调整剂量,甲状腺功能始终未达标。
2016年,患者于中国医科大学附属第一医院门诊就诊,查甲状腺功能示FT3、FT4升高,TSH水平正常,考虑RTHβ可能性大。嘱患者停用甲巯咪唑。
既往史:自幼记忆力差,计算能力及数学成绩差。
体格检查:身高170 cm,体重70 kg。体重指数(BMI)24.22 kg/m2。血压143/105 mmHg(1 mmHg=0.133 kPa)。双侧眼球无突出,眼征阴性。甲状腺大,质软,无压痛。甲状腺左、右叶均可触及2 cm左右结节,双叶未触及细震颤,未闻及血管杂音。颈部及锁骨上未触及肿大的淋巴结。心率66次/min,心律不齐,各瓣膜未闻及病理性杂音。
患者实验室检验结果见表1。
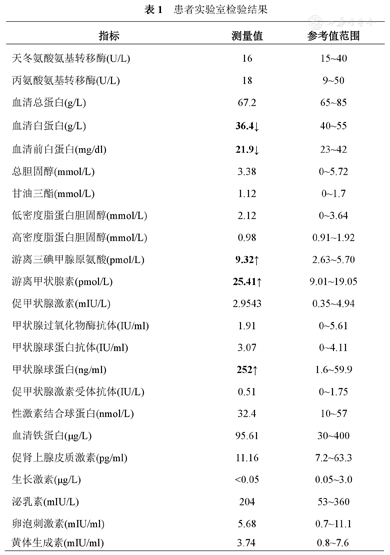
患者实验室检验结果
患者实验室检验结果
| 指标 | 测量值 | 参考值范围 |
|---|---|---|
| 天冬氨酸氨基转移酶(U/L) | 16 | 15~40 |
| 丙氨酸氨基转移酶(U/L) | 18 | 9~50 |
| 血清总蛋白(g/L) | 67.2 | 65~85 |
| 血清白蛋白(g/L) | 36.4↓ | 40~55 |
| 血清前白蛋白(mg/dl) | 21.9↓ | 23~42 |
| 总胆固醇( mmol/L) | 3.38 | 0~5.72 |
| 甘油三酯(mmol/L) | 1.12 | 0~1.7 |
| 低密度脂蛋白胆固醇(mmol/L) | 2.12 | 0~3.64 |
| 高密度脂蛋白胆固醇(mmol/L) | 0.98 | 0.91~1.92 |
| 游离三碘甲腺原氨酸( pmol/L) | 9.32↑ | 2.63~5.70 |
| 游离甲状腺素( pmol/L) | 25.41↑ | 9.01~19.05 |
| 促甲状腺激素( mIU/L) | 2.9543 | 0.35~4.94 |
| 甲状腺过氧化物酶抗体(IU/ml) | 1.91 | 0~5.61 |
| 甲状腺球蛋白抗体(IU/ml) | 3.07 | 0~4.11 |
| 甲状腺球蛋白(ng/ml) | 252↑ | 1.6~59.9 |
| 促甲状腺激素受体抗体(IU/L) | 0.51 | 0~1.75 |
| 性激素结合球蛋白(nmol/L) | 32.4 | 10~57 |
| 血清铁蛋白(μg/L) | 95.61 | 30~400 |
| 促肾上腺皮质激素(pg/ml) | 11.16 | 7.2~63.3 |
| 生长激素(μg/L) | <0.05 | 0.05~3.0 |
| 泌乳素(mIU/L) | 204 | 53~360 |
| 卵泡刺激素( mIU/ml) | 5.68 | 0.7~11.1 |
| 黄体生成素( mIU/ml) | 3.74 | 0.8~7.6 |
辅助检查:甲状腺超声示甲状腺内可见多个大小不等的结节,左叶大者位于下极,大小约31.0 mm×32.6 mm,呈囊实混合性,内见强光条、彗尾状强光点,未见明显血流(TI-RADS4a级),右叶大者位于中部,大小约21.9 mm×19.9 mm,呈囊实混合性,边缘见点状血流。甲状腺结节细针穿刺未见癌细胞。发射计算体层摄影(ECT)示甲状腺左叶"冷结节",甲状腺双叶外形增大,摄取功能增强。心电图示心房颤动。电测听(纯音听阈)提示双感音神经性聋,声阻抗(声导抗测听,多频率):双A。垂体MRI(平扫+增强)未见异常。腰椎整体骨量减少(T值为-1.6),髋关节整体骨量减少(T值为-1.3)。
生长抑素试验:每8小时皮下注射奥曲肽0.1 mg,共3次。注射前和注射后8、16、24 h测定血清FT3、FT4、TSH(表2)。本例患者TSH抑制率为52.77%。
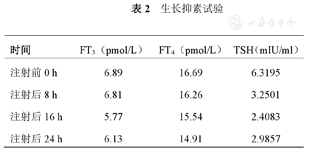
生长抑素试验
生长抑素试验
| 时间 | FT3(pmol/L) | FT4(pmol/L) | TSH(mIU/ml) |
|---|---|---|---|
| 注射前0 h | 6.89 | 16.69 | 6.3195 |
| 注射后8 h | 6.81 | 16.26 | 3.2501 |
| 注射后16 h | 5.77 | 15.54 | 2.4083 |
| 注射后24 h | 6.13 | 14.91 | 2.9857 |
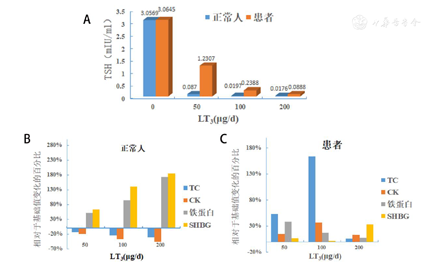
碘塞罗宁(LT3)抑制试验:给予患者剂量逐渐递增的LT3,50、100、200 μg/d,每个剂量组用药3 d,每日剂量分两次服用(早晚8点),试验共持续9 d。给药前及每个剂量试验结束后采集血样,检测血清TSH、总胆固醇(total cholesterol,TC)、肌酸激酶(creatine kinase,CK)、铁蛋白(ferritin ,Fer)及性激素结合球蛋白(sex hormone binding globulin,SHBG)。结果示:正常人50 μg剂量后TSH被抑制到0.087 mIU/ml,200 μg后降至0.0176 mIU/ml,而患者50 μg剂量后TSH被抑制到1.230 7 mIU/ml,200 μg后降至0.088 8 mIU/ml,提示患者垂体存在TH抵抗(图1A)。随着LT3用药剂量增加,正常人Fer和SHBG水平逐渐升高,TC和CK水平逐渐下降,且剂量越大,变化越明显;与正常人相比,患者用药后Fer、SHBG未显示出逐渐升高;TC和CK水平未显示出下降(图1B、1C)。提示患者肝脏和肌肉组织均存在不同程度的TH抵抗。

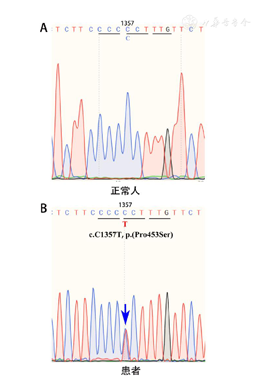
基因检测:与患者及其家属沟通,获得知情同意后,留取患者及其父母、兄弟、儿子的外周静脉血各5 ml,委托北京宏微特斯检测公司进行TRβ基因全外显子测序。测序结果示:患者TRβ基因第11外显子存在点突变,c.C1357T,p.(Pro453Ser),且为杂合突变(图2)。参考基因组序列:NM_001128176.3, THRβ基因CDS(Coding sequence),起始密码子ATG为密码子1,其第1个核苷酸为cDNA序列的第1个核苷酸;蛋白质参考序列:NP_001121648.1,蛋白质氨基酸参考序列从信号肽第1个氨基酸起始。患者其他家系成员中未发现TRβ基因的该位点突变,提示本患者为RTH β散发病例。

诊断:β型甲状腺激素抵抗综合征(RTH β)
鉴别诊断:
1.甲状腺功能亢进症:具有甲状腺功能亢进的临床症状,如心悸、多汗、食欲增加、体重下降。甲状腺功能表现为FT3、FT4水平升高,而TSH水平被显著抑制,多伴有促甲状腺激素受体抗体(TRAb)升高。RTH β患者,具有甲状腺功能亢进高代谢临床表现。但血清TSH水平不受抑制,一般在正常范围内。
2、TSH瘤:包括垂体TSH瘤和异位TSH瘤。垂体TSH瘤患者垂体MRI可发现占位性改变。异位TSH瘤是指在垂体窝之外发现的TSH瘤。鉴别方法有4种,第1种是TRH兴奋实验。TSH瘤患者TSH不能被TRH兴奋;RTH β患者垂体对TRH的刺激,表现为反应正常或过度反应,峰值提前,峰值增高。第2种是碘塞罗宁抑制试验。TSH瘤患者TSH不被抑制,RTH β患者被部分抑制。但目前国内尚无TRH和碘塞罗宁。第3种是测定血清TSH的α亚单位(α-GSU)。TSH瘤患者的α-GSU往往升高,但是TSH小腺瘤也可以正常。第4种是生长抑素实验。叶蕾等[13]通过对比分析61例垂体TSH瘤和RTHβ患者的临床资料发现,垂体TSH瘤患者对生长抑素反应显著,TSH抑制率为(77.02±13.43)%,且显著高于RTHβ患者的(52.33±15.02)%,但是两者重合较多,目前尚不能明确鉴别二者的TSH抑制率的切点值。
本例患者给予酒石酸美托洛尔25 mg、2次/d口服。针对心房颤动,给予华法林2.5 mg、2次/d口服。钙尔奇D 600 mg、1次/d口服,罗盖全骨化三醇胶丸0.25 μg、1次/2 d口服。
患者诊断为RTH β后,一直在密切随访,由于患者TRα没有突变,所以患者TH增多导致以表达TRα为主的组织可能出现组织水平的甲状腺功能亢进,比如骨骼和心脏,容易导致心律失常和骨质疏松,因此患者每年都进行心脏超声和心电图随访,患者心脏超声结构基本正常。控制心房颤动,给予华法林2.5 mg,每日2次口服,国际标准化比值(INR)控制在2.0~3.0之间。骨密度:髋关节和腰椎骨密度正常。RTH β患者由于甲状腺受到TSH的刺激,容易发生甲状腺癌,患者需每年进行甲状腺超声检查,监测甲状腺结节的变化。目前复查结果不提示甲状腺癌征象。
本例患者的主要症状是心房颤动、怕热、多汗,体重下降等甲状腺毒症的高代谢症候群,结合患者最初的甲状腺功能结果:FT3、FT4升高,很容易被临床医生诊断为甲状腺功能亢进症,予以抗甲状腺药物治疗。本例患者就被给予PTU和甲巯咪唑治疗后,甲状腺功能一直不能恢复正常,表现为FT3、FT4正常时,TSH升高;而当TSH正常时,FT3、FT4又升高,这也提示其甲状腺功能亢进症诊断可能有误。典型的甲状腺功能亢进症血清TSH往往是最早发生变化的指标,被明显抑制,应用第3代TSH检测试剂盒测得的TSH值<0.01 mIU/ml,随后才出现血清FT3、FT4升高。甲亢患者如果FT3、FT4升高,而TSH不被抑制,就要考虑是不是其他原因导致了FT3、FT4升高[5,6]。排除诊断包括:遗传性甲状腺激素结合球蛋白(TBG)增多症[7]、家族性白蛋白异常高甲状腺素血症[8]、THRα基因突变导致的甲状腺激素抵抗综合征(RTHα)[9]、TSH瘤[6,10]。其中遗传性TBG增多症、家族性白蛋白异常高甲状腺素血症患者没有甲状腺功能亢进症的高代谢症候群。而RTH β和TSH瘤患者往往有高代谢症候群[4,10,11]。本例患者有明显的高代谢症候群、垂体未发现占位性病变,排除了遗传性TBG增多症、家族性白蛋白异常高甲状腺素血症、垂体TSH瘤的可能,而最重要的是患者的基因测序结果提示THRβ基因突变,这是确诊RTH β的金标准。本例患者THRβ基因第11号外显子存在P453S突变,为杂合突变,该位点国际上已有报道[12],因此患者RTHβ诊断明确。
大部分的RTH β患者是不需要治疗的,因为其循环血中的高TH水平往往可以代偿全身的TH抵抗[13]。手术、放射性碘或抗甲状腺药物治疗可降低TH水平,升高血清TSH水平,从而刺激甲状腺增生肿大,也可增加垂体促甲状腺细胞增生的风险,甚至加重TH抵抗,因此应当避免在RTH β患者中应用[4,11,14]。RTH β尚无根治疗法,目前多为对症治疗。对于心率增快者,可以加用β受体阻滞剂。对于高代谢状态明显者,可使用多巴胺能药物或生长抑素类药物,两者都可以抑制垂体促甲状腺激素的分泌,较少导致外周拟甲状腺素效应,用药后可降低TH水平[15]。甲状腺毒症明显者,可以选择三碘甲状腺乙酸(TRIAC)[16]。对于外周组织存在明显TH抵抗的患者(如成人的异常高胆固醇血症和儿童的生长发育迟缓),需要应用超生理剂量的LT3[17],或左旋甲状腺素(LT4)来克服某些组织严重的激素抵抗[15],但需要仔细监测TH作用的指标(如性激素结合球蛋白、心率、基础代谢率)。
综上所述,RTH β作为内分泌科罕见的疾病,多数临床医生对其认识不足,常将其误诊为甲状腺功能亢进症,甚至很多患者接受了放射性碘或手术治疗,导致其TH抵抗症状加重,需要应用超大剂量的甲状腺激素,导致心脏和骨代谢障碍,严重影响患者的生活质量和预期寿命。因此加强对RTH β的认识,有利于避免将其误诊为甲状腺功能亢进症,从而改善患者预后。
所有作者均声明本研究不存在利益冲突



























