
患者,男性,75岁,"乙肝"病史30年。因"复发性肝癌切除术后9个月余,发现肿瘤复发1 d"入院。2010年11月检查发现肝癌,行肝癌切除术,术后于2012年、2016年、2020年多次发现肿瘤复发,并行肝癌综合性治疗。2021年9月15日复查影像学检查提示肝内肿瘤复发,为求进一步治疗入院。
体温36.3℃,脉搏81次/min,呼吸20次/min,血压142/78 mmHg(1 mmHg=0.133 kPa)。神志清楚,正常面容,皮肤巩膜无黄染,腹壁可见手术瘢痕,未触及包块。
有肝炎病史。肿瘤标志物:甲胎蛋白(AFP)12.15 ng/ml,异常凝血酶原(DCP) 2.96 ng/mL,糖类抗原199(CA199) 8.32 U/ml。超声造影、MR(普美显)检查发现肝内病灶符合"快进快退"表现,经过MDT讨论,考虑肝癌复发。
肝脏超声/MR虚拟融合成像导航下联合人工胸腹水、球囊隔离技术对肝肿瘤微波消融治疗。
术后患者无不适主诉,超声造影复查提示肿瘤消融完全。
超声科;消化科;肿瘤科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
热消融是当今发展最为迅速的新兴治疗手段之一,在实体肿瘤方面具有广泛的应用。其中局部消融技术,包括射频消融(radiofrequency ablation, RFA)、微波消融(microwave ablation, MWA)以及激光消融(laser ablation)等,为十分有效的微创治疗手段[1],被广泛应用于早期肝癌的治疗,对小肝癌(特别是<3 cm),热消融的疗效可与外科手术相媲美[2]。凭借其微创性,消融治疗对于复发及具有外科手术禁忌的患者具有独特优势[3]。大部分小肝癌能在实时超声引导下进行消融治疗,然而对于高危部位(如邻近心脏、大血管、胆囊、胃肠道、膈面)的肿瘤,则需要联合辅助技术(如融合导航、人工胸腹水、球囊隔离技术)进行定位及治疗。本院通过超声/MR虚拟融合成像导航下联合人工胸腹水、球囊隔离技术对1例高危部位肝肿瘤微波消融治疗,现报道如下。
患者,男性,75岁,因"复发性肝癌切除术后9个月余,发现肿瘤复发1 d"入院。
患者于2010年11月检查发现肝癌,行肝癌切除术,病理为肝细胞肝癌(hepatocellular carcinoma,HCC)。术后于2012年、2016年、2020年多次发现肿瘤复发,并行肝癌综合性治疗(血管介入、消融、手术切除等)。2021年9月15日复查影像学检查提示肝内肿瘤复发,为求进一步治疗入院。既往有乙肝病史30年,自2010年开始至今规律服抗病毒药,否认结核或其他传染病史。否认冠心病、糖尿病史。发病以来精神、睡眠、食欲尚可,大小便正常,体重无明显变化。
入院查体:体温36.3℃,脉搏81次/min,呼吸20次/min,血压142/78 mmHg(1 mmHg=0.133 kPa)。神志清楚,正常面容,皮肤巩膜无黄染。腹壁可见手术瘢痕,腹部软,未触及肿块。
入院后检查感染性疾病综合性检查提示"小三阳":HBsAg:559.53 IU/ml,HBeAb>4.40 PEIu/ml,HBcAb>12.60 PEIu/ml,丙肝(-),HBV-DNA:<5.00×102IU/ml。肝吸虫酶标:肝吸虫抗体弱阳性(±)。肝肿瘤三项:甲胎蛋白(AFP)11.51 ng/ml,甲胎蛋白异质体(AFP-L3)1.24 ng/ml,甲胎蛋白异质体比率(AFP-L3%)10.78%,异常凝血酶原(DCP)4.72 ng/ml。其余肿瘤标志物CA153、CA125、CA199、CEA未见异常。血常规、肝肾功能、凝血功能、D-二聚体、血气分析未见异常。
肝脏超声造影与增强MRI检查:S5、S8肿瘤呈"快进快退"表现,提示肿瘤复发。
患者达到临床诊断HCC标准:有肝炎病史,超声造影与增强MRI共两种增强影像学均为HCC的表现。消融前行S5、S8病灶穿刺活检,病理提示HCC。
根据患者的实际情况,MDT讨论一致同意行超声引导下微波消融治疗。超声-MR融合成像提示共4个病灶复发。S8有2个邻近膈面病灶,为保护膈肌及保证视野清晰,行人工胸水、人工腹水辅助,因腹腔粘连较严重,膈下腹水操作失败,仅行人工胸水减少肺气对视野的影响,从而进行超声引导下消融、超声造影-MR融合成像评估效果(图1);S5小病灶邻近门脉且灰阶超声显示不清,应用超声-MR融合成像定位引导消融,并使用超声造影复查效果(图2);S5大病灶邻近胃肠道,因腹腔粘连行人工腹水操作较困难,改为使用球囊隔离技术将肝肿瘤与肠道分离,在保证肠道安全的情况下行超声引导下消融,并行超声造影-MR融合成像评估效果(图3)。
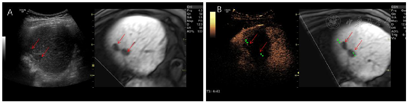

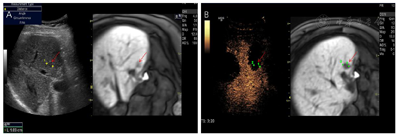

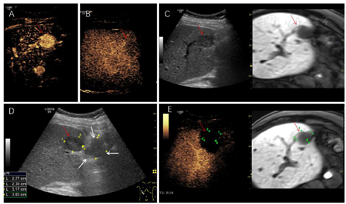

患者成功施行超声联合人工胸腹水、球囊隔离技术行微波消融治疗,术后复查超声造影肿瘤消融完全。术后无发热,无腹痛,生命征平稳,治愈出院。
肝癌是全球范围最常见的一种恶性肿瘤,其中HCC约占所有原发性肝癌病例的90%,具有极高的死亡率[4]。临床上HCC的治疗手段有手术切除、消融、介入、放化疗等。而热消融凭借微创、可重复多次、并发症少、恢复快的优势,成为小肝癌的一线治疗方式[5]。
热消融技术通过精准局部加热,使肿瘤组织发生凝固性坏死,从而达到肿瘤原位灭活的目的[6]。大部分小肝癌能在实时超声引导下进行消融治疗,然而对于处于高危部位的肝肿瘤(比如邻近心脏、大血管、胆囊、胃肠道、膈面等),部分病灶存在视野不清晰、穿刺路径有困难、容易损伤周围脏器等困难。随着现代科技的发展,医疗技术及应用不断创新,多种辅助技术(如融合导航、人工胸/腹水、球囊隔离等)被联合应用于超声引导下消融治疗,给高危部位肝癌的热消融治疗带来了新的希望[7,8,9]。
本例患者75岁,乙肝病史30年,自2010年检出HCC并手术切除后,近十年来多次复发,行血管介入、消融、手术切除等综合治疗,再次外科手术困难。2021年9月影像学发现肿瘤复发,其中,S5大病灶邻近胃肠道,S5小病灶邻近门脉,S8两个病灶邻近膈面。MDT讨论考虑患者曾行多次腹部手术,腹腔粘连严重,结合患者年龄较大等因素,一致决定行微创治疗—超声引导下微波消融。而该患者复发病灶均位于高危部位,行超声引导下人工胸腹水操作,并通过超声-MR融合成像导航定位、引导消融、超声造影复查效果,特别是使用球囊隔离技术将肝脏与肠道分离,以避免消融过程中产生的热量损伤胃肠道。术后复查超声造影提示4个病灶均消融完全。
热消融治疗时,高危部位病灶在进行治疗时极易使毗邻器官组织造成热损伤。多数研究表明,胃肠道是最常见的受累器官,受器官本身的易损伤程度、蠕动、位置影响,除此之外,膈肌、支气管等邻近器官亦可受到损伤。胃肠道热损伤可缓慢发生,病情隐匿,病人和医生不能在短时间内发觉而造成严重不良影响,损伤后的预后和结果均不佳,为预防高危部位消融的热损伤,病灶消融治疗时可选择非经皮路径(腹腔镜或术中)或采取人工腹水、球囊隔离技术等措施[10,11]。在癌症病灶的治疗过程中,应多方面考察病灶情况进行全面评估。本例是典型多发高危部位的病例,为避免出现不必要的并发症和损伤,我们通过超声引导下人工胸腹水、球囊隔离技术联合微波消融治疗,为未来此类高危部位的消融治疗提供了宝贵经验。
所有作者均声明本研究不存在利益冲突



























