
患者,男,72岁,2021年6月21日因"上腹部疼痛1周,加剧2 h"入院,患者伴有呕吐宿食、腹胀等胃潴留症状,体重下降1~2 kg。
幽门梗阻,胃潴留,肺部感染,脑梗死后遗症。
胃镜证实胃恶性肿瘤(腺癌cT4bN+M0)。腹腔镜下探查术,肿瘤位于胃窦部环周,6 cm×8 cm大小,侵出浆膜,侵犯胆囊、横结肠、十二指肠韧带、胰头和横结肠系膜,灶区旁多发淋巴结肿大,肝、脾、腹膜未见转移及种植癌结节。
腔镜下行胃空肠吻合改流术,术后22天行新辅助化疗,3疗程后肿瘤经新辅助化疗后完全退缩(TRG分级0级),再行腹腔镜下远端胃癌根治术。
术后大标本病理:糜烂性胃炎,灶区腺体不典型增生,无肿瘤细胞残留。术后患者1周出院恢复良好。
肿瘤科;消化科;消化内镜中心;普外科;消化外科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
胃癌在我国恶性肿瘤排行榜仍高居第3位,其特点仍以进展期为主。随着对恶性肿瘤的深入研究,治疗手段多样化,明显改善进展期胃癌的预后:传统的单纯手术治疗已不是惟一选择,腹腔镜和机器人手术的发展,为肿瘤的治疗锦上添花;放化疗开展了肿瘤治疗的新方向;靶向和免疫治疗是肿瘤治疗的新宠。如何组合运用达到最佳疗效是目前研究争论的焦点。在此结合实际案例介绍新辅助化疗联合腹腔镜手术根治性治疗进展期胃癌的成功经验。
患者,男,72岁,2021年6月21日因"上腹部疼痛1周,加剧2 h"入院,患者伴有呕吐宿食、腹胀等胃潴留症状,既往2013年、2019年分别确诊脑梗死病史,否认"高血压"、"糖尿病"、"冠心病"、"慢阻肺"病史,无"输血"、"手术"及外伤史,无药物过敏史,体重下降1~2 kg。
胃镜诊断胃恶性肿瘤(腺癌cT4bN+M0),幽门梗阻,胃潴留。入院完善检查,存在肺部感染,脑梗死后遗症,余无异常。
积极术前准备,胃温盐水灌洗,于2021年6月28日在全麻下行腹腔镜下探查术,术中证实肿瘤位于胃窦部环周,6 cm×8 cm大小,侵出浆膜,侵犯胆囊、横结肠、十二指肠韧带、胰头和横结肠系膜,灶区旁多发淋巴结肿大,肝、脾、腹膜未见转移及种植癌结节。
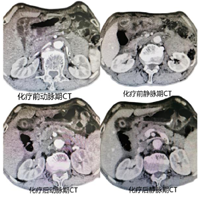
腔镜下行胃空肠吻合改流术,术后患者恢复良好,术后5 d出院。术后22 d返院行新辅助化疗,选择化疗方案为SOX,奥沙利铂130 mg/m2每21 d静脉滴注1次,同时口服替吉奥60 mg,2次/d,连续服用2周,间歇1周,连续化疗3程后,复查胃镜及全腹部CT平扫+增强,内镜下肉眼未见明显肿瘤样组织,CT提示胃窦部胃壁略增厚,与胆囊、横结肠、胰头间隙清晰,原灶区旁未见明显肿大淋巴,活检病理提示胃炎并糜烂,灶区腺体不典型增生。综合考虑肿瘤经新辅助化疗后完全退缩(TRG分级0级,图1,图2,图3,图4)。于9月29日在全麻下行腹腔镜下远端胃癌根治术,拆除原吻合口,行腹腔镜下远端胃D2清扫,近端残胃与空肠吻合,再行近端空肠与距离胃肠吻合口约40 cm空肠吻合,术中发现原腹腔镜探查肿瘤侵犯胆囊、横结肠、横结肠系膜、胰头十二指肠韧带间隙清晰,切取粘连组织术中冰冻均未发现癌细胞,手术选择未联合脏器切除。
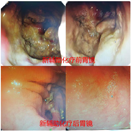

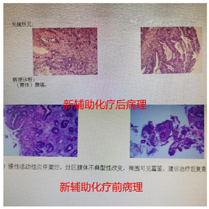



术后大标本病理:糜烂性胃炎,灶区腺体不典型增生,无肿瘤细胞残留。病理表现完全退缩。术后患者1周出院恢复良好。
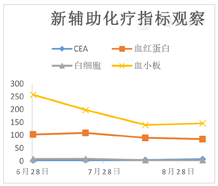
此病例在新辅助化疗前诊断(腺癌cT4bN+M0),根据中国抗癌协会胃癌专业委员会发布的《局部进展期胃癌围手术期治疗中国专家共识》(2021版)[1]推荐新辅助化疗或联合放疗,4程新辅助治疗后复查等待肿瘤降期或退缩后抓住时间窗再行根治手术治疗。首次住院完善检查评估经过MDT讨论后考虑肿瘤分型为BorrmannⅢ型,需先行新辅助化疗,但患者有幽门梗阻症状,决定先行腹腔镜探查及全腔镜下胃空肠吻合改流手术,同时也是遵循对于BorrmannⅢ型、大于8 cm的肿瘤建议行腹腔镜探查了解腹膜、网膜、系膜是否存在转移,获得腹腔镜探查肿瘤分期及可切除性评估,探查证实肿瘤位于胃窦部环周,6 cm×8 cm大小,侵出浆膜,侵犯胆囊、横结肠、十二指肠韧带、胰头和横结肠系膜,灶区旁多发淋巴结肿大,肝、脾、腹膜未见转移及种植癌结节。初步判断为不可切除局部进展期胃癌,术后给予SOX方案行新辅助化疗[2],经过三程新辅助化疗后复查胃镜前后对比,内镜下发现肿瘤完全退缩,活检病理同样支持病理完全退缩(图1、图2),复查全腹部CT+增强扫描可以了解原灶区明显降期,胃窦部胃壁稍增厚,与胆囊、横结肠、胰腺的界限清晰,灶区周围未见明显肿大淋巴结(图3),从影像学角度分析肿瘤退缩明显,转化至可切除范畴。指南推荐术前新辅助化疗4程到6程后评估效果,此病例在术前新辅助化疗3程后全面评估后无论从影像学及内镜检查还是病理学上均获得良好退缩改变,在术前新辅助化疗期间注意观察患者血红蛋白、白细胞、血小板及癌胚抗原,随着化疗的进行患者还是出现了轻度骨髓抑制,白细胞、血红蛋白均有不同程度的下降[3],血小板仍在正常范围内,暂不制约新辅助化疗的进行,但随访癌胚抗原的结果在第1次、第2次新辅助化疗时虽较前均有升高,但仍在正常范围内,且升高幅度均低于30%,而第3次化疗时复查癌胚抗原高于正常值,且升高幅度大于60%(图4),在影像学、内镜及病理检查均获得完全退缩情况下[4],CEA反而升高,此时我们认为新辅助化疗的再评估时间不是机械的固定在4~6个疗程,需综合参考血红蛋白、白细胞、血小板变化情况,特别需要关注CEA的变化情况[5],在新辅助化疗可能出现耐药或者可能出现复发转移的时间窗口及时评估肿瘤退缩评分,及时评估肿瘤的可切除或不可切除性,积极引入外科手术干预,不至于错过最好的手术时机[6]。
另外肿瘤完全退缩后的治疗措施是现在争论的热点课题,胃肠外科医生多数主张外科手术及时参与治疗,肿瘤内科医生则有主张继续化疗或者等待观察,目前对于新辅助化疗肿瘤完全退缩后的治疗方案大致有如下4种:①继续化疗;②手术+术后新辅助化疗;③手术+watch;④wait+watch。我们认为外科手术及时干预是更好的选择,理由有:①临床化疗药物及各种方案的选择均是根据临床指南Ⅰ类推荐,临床经验及循证医学证实化疗存在一定的时效性,大都会出现耐药结果,导致肿瘤复发转移,从而影响患者无瘤生存期及总生存期;②在判断肿瘤退缩评估方法上存在理想化,目前均是通过影像学检查、内镜或联合超声内镜+活检病理,首先影像学检查的准确性存在一定的不准确性,对于胃壁厚度的测量以及胃黏膜的病变的强化表现,特别是经过新辅助治疗后肿瘤退缩明显的诊断更是增加了不少难度,还有对新辅助化疗灶区淋巴结的判断尚没有准确的标准,其次内镜活检病理存在假阴性可能,以及取材的片面性,始终不如手术大标本来的准确,当然也有手术后大标本病理提示肿瘤完全退缩的病理报道,但病例数少,且在接受新辅助化疗的病例中的占比很低,以此主张选择wait+watch的后续诊疗方案比较大胆;③对于腹腔内微转移灶的诊断无法明确,在临床上肿瘤经过新辅助治疗后有退缩的手术探查仍发现存在腹膜微转移可能,在切除转移灶后给予热关注治疗可改善预后,目前还没有关于新辅助化疗后肿瘤完全退缩后常规行腹腔镜探查的数据。
总之,进展期胃癌行新辅助化疗的疗效是乐观的,对于此列病例常规行腹腔镜探查是有必要的,在通过新辅助化疗取得肿瘤退缩疗效后外科手术治疗是必须的,即使临床评估肿瘤完全退缩仍需外科手术根治治疗,在患者无瘤生存期及总生存期上有获益。对于经过新辅助化疗取得肿瘤完全退缩的良好疗效下腹腔镜探查仍可作为临床准确分期的辅助手段。
所有作者均声明本研究不存在利益冲突



























