
患儿,女,41天,因"发现血糖高1小时"入院,患儿G1P1,胎龄37+1周,剖宫产娩出,羊水清,Apgar评分10-10分,出生体重2070克,生后曾因"足月小样儿、新生儿高血糖症"住院治疗,住院第2天发现血糖高,静脉输液时血糖13mmol/L,停止补液吃奶后血糖控制在7-9mmol/L,住院1周后出院,嘱家属门诊定期监测血糖,家属未遵嘱。
体格检查:体温36.6℃,脉搏135次/分,呼吸35次/分,血压68/36mmHg,体重3.15千克,神清,反应可,前囟1.5cm×1.5cm,平软,皮肤轻度黄染,两肺呼吸音清,心音有力,腹软,肠鸣音正常,肝脾无明显肿大,四肢肌张力正常。
实验室检查,基因测序
入院后给予短效胰岛素(生物合成人胰岛素),治疗一天余,血糖控制不佳,改予中效胰岛素(精蛋白生物合成胰岛素注射液N)治疗,并适时调整剂量,血糖逐步控制,住院治疗7天胰岛素逐渐减量,加用格列本脲口服(0.25mg,Bid,0.1mg/kg.d),住院11天停用胰岛素,口服格列本脲剂量(0.2mg,q6h,0.2mg/kg.d),餐前血糖控制在4-10mmol/L,餐后血糖控制在7.5-13mmol/L,病程中根据血糖适当调整格列本脲剂量;住院期间曾输血一次。患儿住院治疗共20天,出院时体重上升至4.2千克,吃奶好,格列本脲每次0.2mg,q6h口服,餐前血糖控制在5.6-7.8mmol/L,餐后血糖控制在7~10mmol/L。
出院后内分泌专科随访,生后6个月随访,每天测微量血糖2-3次,餐前或餐后2小时,餐前血糖基本维持在4-6mmol/L,餐后2小时血糖维持在8-10mmol/L左右,平均血糖在7-8mmol/L,口服格列本脲,一天三次,每次0.5mg,目前体重9千克,相当于P65,头围44cm,相当于P47,身长65cm,相当于P50。患儿3个月会抬高,6个月会坐,生长发育基本正常,神经发育方面评估未做。
儿科;内分泌科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
新生儿糖尿病(NDM)定义为生后六个月以内出现的持续性高血糖。它通常是由单个基因突变引起的,突变影响胰腺细胞的发育和功能,导致胰岛素分泌或功能下降。NDM主要发生在生后6个月以内,很少发生在6个月到1岁之间,根据表征可分为短暂性新生儿糖尿病(TNDM)、永久性新生儿糖尿病(PNDM)和临床综合征(DEND或iDEND)。永久性新生儿糖尿病在生后数天至数月发病,需长期治疗。KCNJ11和ABCC8基因突变是引起永久性新生儿糖尿病的主要原因,KCNJ11基因编码Kir6.2,它是形成ATP依赖性钾通道(KATP通道)的细胞内膜或孔隙的主要蛋白,另一个亚基是由SUR1蛋白形成的外部调节复合物,由ABCC8基因编码。KATP通道对胰岛β细胞中的胰岛素释放起关键作用,KCNJ11中的杂合子激活突变使通道保持开放,从而降低通道对抑制的敏感性,使胰岛素释放减少,引起新生儿糖尿病。
本研究回顾我院一例KCNJ11基因杂合突变引起的永久性新生儿糖尿病的临床资料并进行文献复习,以提高对KCNJ11基因致新生儿糖尿病的认识。
患儿,女,41天,因"发现血糖高1小时"入院,患儿G1P1,胎龄37+1周,剖宫产娩出,羊水清,Apgar评分10-10分,出生体重2070克,生后曾因"足月小样儿、新生儿高血糖症"住院治疗,住院第2天发现血糖高,静脉输液时血糖13mmol/L,停止补液吃奶后血糖控制在7-9mmol/L,住院1周后出院,嘱家属门诊定期监测血糖,家属未遵嘱。生后41天,患儿因黄疸未退至我院门诊就诊,测微量血糖24.4mmol/L,患儿生后混合喂养,吃奶吸吮好,无呕吐,大小便家属自述正常。查体:体温36.6℃,脉搏135次/分,呼吸35次/分,血压68/36mmHg,体重3.15千克,神清,反应可,前囟1.5cm×1.5cm,平软,皮肤轻度黄染,两肺呼吸音清,心音有力,腹软,肠鸣音正常,肝脾无明显肿大,四肢肌张力正常。父母亲非近亲婚配,表型正常。
实验室检查 监测血糖26.9mmol/L,最高时血糖30.6mmol/L;血常规:白细胞8.95×10^9/L,血红蛋白97g/L,血小板470×10^9/L,中性粒细胞比例23.7%,淋巴细胞比例59.2%,提示贫血;生化:肝肾功能无明显异常,总胆红素157.3umol/L,直接胆红素3.3umol/L;尿常规:葡萄糖+++,酮体-;血气分析无明显异常;胰岛素水平餐前、餐后、餐后2小时分别是45.94、35.09、5.18uIU/ml;糖尿病五项:血清C肽0.04ng/ml,抗胰岛素抗体0.47%,血清抗谷氨酸脱羧酶抗体<0.2IU/ml,胰岛细胞自身抗体0.02,血清胰高血糖素147.25pg/ml,胰岛细胞自身抗体、血清谷氨酸脱羧酶抗体、胰高血糖素均正常;糖化血红蛋白5.9%。
基因测序 患儿父母签署知情同意书,采集患儿及父母外周静脉血2-3ml,EDTA抗凝,进行高精度临床外显子基因测序。
患儿1月余发病,血糖明显升高,C肽低,尿糖阳性,糖尿病相关抗体均阴性,排除自身免疫性糖尿病可能,具有新生儿糖尿病典型临床表现,生后1月余体重增长欠佳,血气分析无明显代谢性酸中毒表现,血红蛋白提示贫血,血清总胆红素偏高。其父母监测血糖均正常。诊断:新生儿糖尿病;高胆红素血症;轻度贫血。
入院后给予短效胰岛素(生物合成人胰岛素),治疗一天余,血糖控制不佳,改予中效胰岛素(精蛋白生物合成胰岛素注射液N)治疗,并适时调整剂量,血糖逐步控制,住院治疗7天胰岛素逐渐减量,加用格列本脲口服(0.25mg,Bid,0.1mg/kg.d),住院11天停用胰岛素,口服格列本脲剂量(0.2mg,q6h,0.2mg/kg.d),餐前血糖控制在4-10mmol/L,餐后血糖控制在7.5-13mmol/L,病程中根据血糖适当调整格列本脲剂量;住院期间曾输血一次。患儿住院治疗共20天,出院时体重上升至4.2千克,吃奶好,格列本脲每次0.2mg,q6h口服,餐前血糖控制在5.6-7.8mmol/L,餐后血糖控制在7-10mmol/L。
出院后内分泌专科随访,生后6个月随访,每天测微量血糖2-3次,餐前或餐后2小时,餐前血糖基本维持在4-6mmol/L,餐后2小时血糖维持在8-10mmol/L左右,平均血糖在7-8mmol/L,口服格列本脲,一天三次,每次0.5mg,目前体重9千克,相当于P65,头围44cm,相当于P47,身长65cm,相当于P50。患儿3个月会抬高,6个月会坐,生长发育基本正常,神经发育方面评估未做。
送检者进行了高精度临床外显检测和分析,发现KCNJ11基因在C.175G>A(P.V59M)位点出现杂合变异,同时验证实验结果显示送检者父母没有携带这个变异,这个变异可能是新发的。同时通过拷贝数和SNP分析,没有检测到与临床表现可能相关的拷贝数变异。详见图1,图2,图3。搜索文献发现,这个基因突变位点在2004年在国外初次被报道,国内也有报道过。
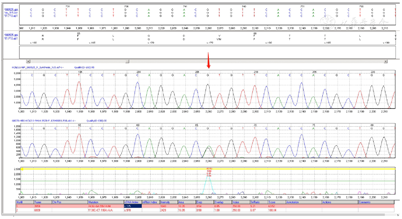

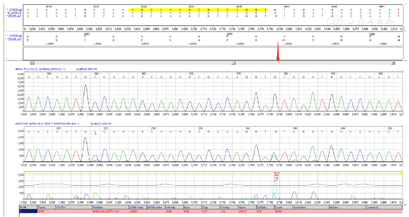

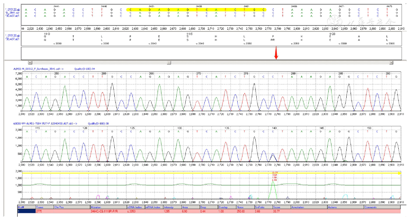

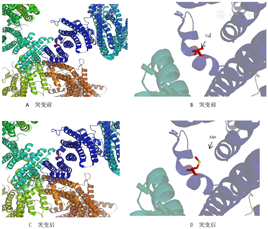
KCNJ11基因编码长度为390,该突变位点在第59处,其蛋白质二级结构发生α-螺旋,氨基酸变化为缬氨酸(Val)转变为蛋氨酸(Met),从而引起致病突变。见图4。

以"新生儿""糖尿病""KCNJ11"为关键词,在"PubMed"上进行检索,其中筛选病例报道、综述所涉及的位点,排除重复报道的,共筛选出22篇。目前发现的突变位点有30种以上,且不断有新的突变位点被发现。今就文献中所涉及的27个致病位点进行文献复习(见表1)。
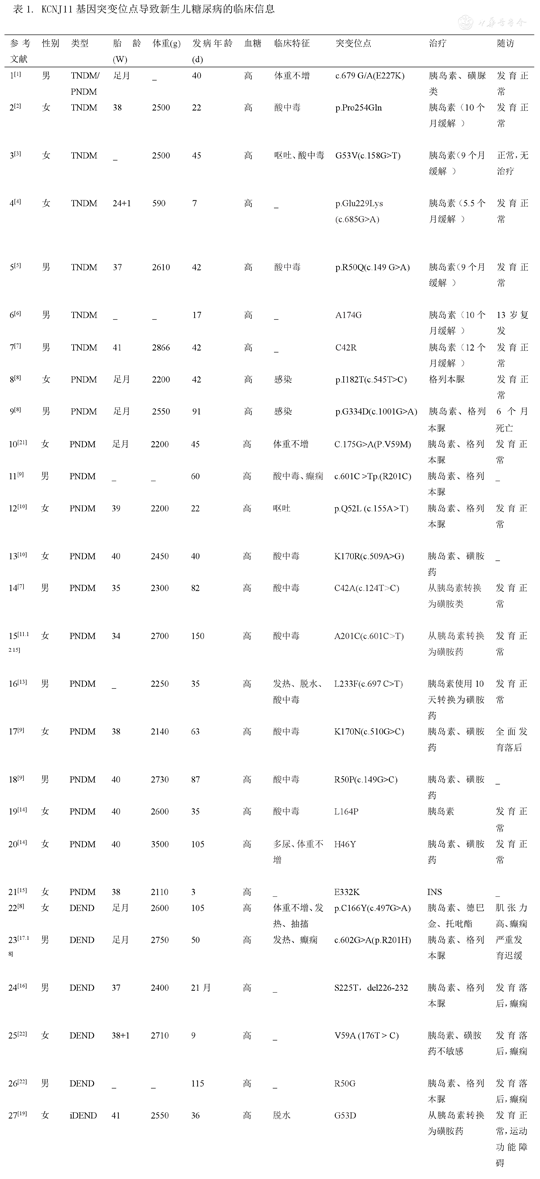
KCNJ11基因突变位点导致新生儿糖尿病的临床信息
KCNJ11基因突变位点导致新生儿糖尿病的临床信息
| 参考文献 | 性别 | 类型 | 胎龄(W) | 体重(g) | 发病年龄(d) | 血糖 | 临床特征 | 突变位点 | 治疗 | 随访 |
|---|---|---|---|---|---|---|---|---|---|---|
| 1[1] | 男 | TNDM/PNDM | 足月 | _ | 40 | 高 | 体重不增 | c.679 G/A(E227K) | 胰岛素、磺脲类 | 发育正常 |
| 2[2] | 女 | TNDM | 38 | 2500 | 22 | 高 | 酸中毒 | p.Pro254Gln | 胰岛素(10个月缓解) | 发育正常 |
| 3[3] | 女 | TNDM | _ | 2500 | 45 | 高 | 呕吐、酸中毒 | G53V(c.158G>T) | 胰岛素(9个月缓解) | 正常,无治疗 |
| 4[4] | 女 | TNDM | 24+1 | 590 | 7 | 高 | _ | p.Glu229Lys (c.685G>A) | 胰岛素(5.5个月缓解) | 发育正常 |
| 5[5] | 男 | TNDM | 37 | 2610 | 42 | 高 | 酸中毒 | p.R50Q(c.149 G>A) | 胰岛素(9个月缓解) | 发育正常 |
| 6[6] | 男 | TNDM | _ | _ | 17 | 高 | _ | A174G | 胰岛素(10个月缓解) | 13岁复发 |
| 7[7] | 男 | TNDM | 41 | 2866 | 42 | 高 | _ | C42R | 胰岛素(12个月缓解) | 发育正常 |
| 8[8] | 女 | PNDM | 足月 | 2200 | 42 | 高 | 感染 | p.I182T(c.545T>C) | 格列本脲 | 发育正常 |
| 9[8] | 男 | PNDM | 足月 | 2550 | 91 | 高 | 感染 | p.G334D(c.1001G>A) | 胰岛素、格列本脲 | 6个月死亡 |
| 10[21] | 女 | PNDM | 足月 | 2200 | 45 | 高 | 体重不增 | C.175G>A(P.V59M) | 胰岛素、格列本脲 | 发育正常 |
| 11[9] | 男 | PNDM | _ | _ | 60 | 高 | 酸中毒、癫痫 | c.601C >Tp.(R201C) | 胰岛素、格列本脲 | _ |
| 12[10] | 女 | PNDM | 39 | 2200 | 22 | 高 | 呕吐 | p.Q52L (c.155A>T) | 胰岛素、格列本脲 | 发育正常 |
| 13[10] | 女 | PNDM | 40 | 2450 | 40 | 高 | 酸中毒 | K170R(c.509A>G) | 胰岛素、磺胺药 | _ |
| 14[7] | 男 | PNDM | 35 | 2300 | 82 | 高 | 酸中毒 | C42A(c.124T>C) | 从胰岛素转换为磺胺类 | 发育正常 |
| 15[11.12.15] | 女 | PNDM | 34 | 2700 | 150 | 高 | 酸中毒 | A201C(c.601C>T) | 从胰岛素转换为磺胺药 | 发育正常 |
| 16[13] | 男 | PNDM | _ | 2250 | 35 | 高 | 发热、脱水、酸中毒 | L233F(c.697 C>T) | 胰岛素使用10天转换为磺胺药 | 发育正常 |
| 17[9] | 女 | PNDM | 38 | 2140 | 63 | 高 | 酸中毒 | K170N(c.510G>C) | 胰岛素、磺胺药 | 全面发育落后 |
| 18[9] | 男 | PNDM | 40 | 2730 | 87 | 高 | 酸中毒 | R50P(c.149G>C) | 胰岛素、磺胺药 | _ |
| 19[14] | 女 | PNDM | 40 | 2600 | 35 | 高 | 酸中毒 | L164P | 胰岛素 | 发育正常 |
| 20[14] | 女 | PNDM | 40 | 3500 | 105 | 高 | 多尿、体重不增 | H46Y | 胰岛素、磺胺药 | 发育正常 |
| 21[15] | 女 | PNDM | 38 | 2110 | 3 | 高 | _ | E332K | INS | _ |
| 22[8] | 女 | DEND | 足月 | 2600 | 105 | 高 | 体重不增、发热、抽搐 | p.C166Y(c.497G>A) | 胰岛素、德巴金、托吡酯 | 肌张力高、癫痫 |
| 23[17.18] | 男 | DEND | 足月 | 2750 | 50 | 高 | 发热、癫痫 | c.602G>A(p.R201H) | 胰岛素、格列本脲 | 严重发育迟缓 |
| 24[16] | 男 | DEND | 37 | 2400 | 21月 | 高 | _ | S225T,del226-232 | 胰岛素、格列本脲 | 发育落后,癫痫 |
| 25[22] | 女 | DEND | 38+1 | 2710 | 9 | 高 | _ | V59A (176T > C) | 胰岛素、磺胺药不敏感 | 发育落后,癫痫 |
| 26[22] | 男 | DEND | _ | _ | 115 | 高 | _ | R50G | 胰岛素、格列本脲 | 发育落后,癫痫 |
| 27[19] | 女 | iDEND | 41 | 2550 | 36 | 高 | 脱水 | G53D | 从胰岛素转换为磺胺药 | 发育正常,运动功能障碍 |
根据KCNJ11的27种基因突变位点引起的新生儿糖尿病类型不同,分为三种,为短暂性新生儿糖尿病TNDM,永久性新生儿糖尿病PNDM,临床综合征(DEND或iDEND)。详见表2。

新生儿糖尿病分型
新生儿糖尿病分型
| 分型 | 基因突变位点 |
|---|---|
| TNDM | c.679G/A(E227K),p.Pro254Gln,G53V(c.158G>T),p.Glu229Lys(c.685G>A),p.R50Q(c.149G>A),A174G,C42R |
| PNDM | p.I182T(c.545T>C),p.G334D(c.1001G>A),C.175G>A(P.V59M),c.601C>Tp.(R201C),p.Q52L(c.155A>T), K170R(c.509A>G),Cys42Arg(c.124T>C),Arg201Cys(c.601C>T),L233F(c.697 C>T),K170N(c.510G>C),R50P(c.149G>C),L164P,H46Y,E332K |
| DEND/iDEND | p.C166Y(c.497G>A),c.602G>A (p.R201H),S225T/del226-232,V59A (176T > C) ,R50G,G53D |
研究表明新生儿糖尿病是单基因遗传变异导致的特殊类型糖尿病,发病率在1/9万到1/16万之间[24],但对患儿及其家庭危害极大,因其临床表征和致病基因异质性强,如不能明确病因,常不能得到有效的治疗。
新生儿糖尿病的临床表现从无症状、偶然发现的高血糖、严重脱水、电解质紊乱到糖尿病酮症酸中毒(DKA),DKA在某些单源性新生儿糖尿病中也更常见[1,24]。常见的临床表现为宫内生长受限,另一个常见的临床表现是生后发育不良,以及行为变化,如易怒和多尿。本研究中临床症状主要高血糖,宫内及宫外发育不良,由于新生儿多饮多食,多尿症状不易分辨。由于患儿在生后早期曾出现过高血糖症状,未进行跟踪随访,如早期检测可能其诊断及治疗会提前。有文献报道,新生儿糖尿病患者远期可能表现出睡眠障碍、注意力缺陷多动障碍以及学习、社会情感和行为发育迟缓等后遗症。本研究中患儿目前生后6月余,生长发育尚可,但因年龄较小,神经系统发育有无异常无法评估。
目前引起新生儿糖尿病的基因有二十余种,且不断有新的基因突变被发现。引起永久性新生儿糖尿病的主要致病基因为KCNJ11和ABCC8基因,编码ATP敏感性钾离子通道,占所有病例50%以上,其次为INS,占20%以上,该基因的突变导致胰岛素蛋白的错误折叠,导致内质网应力增加,最终导致细胞死亡。引起短暂性糖尿病的主要致病基因为6q24,主要为父源印记基因甲基化失活致过表达所致,大多在生后数月缓解,但在青春期或成年期复发,且发病时间较早,在生后数日或数周出现。在一项研究中,在78.8%的KCNJ11和ABCC8突变患者和30%的INS突变患者中发现了DKA。由于6q24的过度表达而患有短暂性糖尿病的儿童并没有发展为DKA。KCNJ11和ABCC8基因突变的患者对磺胺类药物的治疗很敏感,其余基因突变大部分需胰岛素治疗[11]。对16名患有KCNJ11突变的儿童采取磺胺类药物治疗前和治疗后比较,发现多动症和运动技能有显著改善,而社交能力、语言和智力评分并没有提高。在一项对81名KCNJ11突变引起的新生儿糖尿病患者中,47%存在中枢神经系统(CNS)症状的患者,在更换为磺酰脲类药物后,其肌张力、注意力、运动功能和言语等方面均有所改善。早期使用磺酰脲类药物治疗对神经发育影响更大,可能是处于大脑发育关键时期[17.18]。本研究患儿属于KCNJ11的V59M突变,对磺胺类药物治疗敏感,与上述研究结果一致。
通过文献复习发现,引起KCNJ11基因突变的位点多达三四十种,目前总结了27种突变位点,KCNJ11基因不但能引起永久性糖尿病,暂时性糖尿病也可发生,各种突变引起的临床表现特异,发病时间从几天到数月不等,大部分突变对磺胺类药物治疗敏感,能有效控制血糖,早期使用可改善神经发育不良结局[25]。研究发现一个三代日本家庭在KCNJ11中携带C42R突变的导致TNDM[7],一例24周早产儿发现KCNJ11 c.685G>A突变,引起TNDM[4]。另一例生后2月患儿明确基因c.602G>A (p.R201H)突变,导致PNDM,临床上有酮症酸中毒表现,给予磺胺类药物治疗后临床症状明显改善[12]。2008年一项日本的研究表明,p.A174G和p.R50G位点突变,可引起患儿发育迟缓及癫痫[6]。一例患儿22月诊断PNDM,基因检测明确S225T,del226-232基因突变,予胰岛素治疗,临床症状明显改善[16]。虽然大部分KCNJ11突变使用磺胺类药物能有效改善症状,但有文献报道V59A突变对PNDM及DEND,磺脲类药物治疗无反应[11]。
对6个月甚至12个月内明确的新生儿糖尿病,应尽早明确基因检测,不同的基因类型治疗药物不尽相同,KCNJ11基因突变引起的永久性新生儿糖尿病,胰岛素可成功转换为磺脲类药物治疗,能有效控制血糖,改善生活质量,改善神经发育。
所有作者均声明本研究不存在利益冲突



























