
患者,女性,78岁,因"四肢麻木无力2年"入院,伴四肢烧灼样疼痛,偶有饮水呛咳。当地医院予以患者口服甲钴胺等营养神经药物治疗,病情未见好转。近2年体质量减轻15 kg。
神志清楚,言语清晰流利,颅神经检查未见异常。双上肢肌萎缩,双上肢近端肌力2级、远端1级,双下肢肌力4级,四肢肌张力减低。双侧肘关节以下针刺痛觉减退,双膝关节以下针刺痛觉、震动觉、位置觉减退。四肢腱反射未引出,双侧Babinski征阴性。
结合患者临床症状表现、体征,实验室指标、腰穿、电生理等辅助检查结果,以及妇科会诊意见,确诊为抗Yo抗体相关的副肿瘤性周围神经病(PPN)。
给予糖皮质激素、营养神经、止痛等药物治疗。
患者病情无明显好转,出院2个月后电话随访时患者死亡。
神经科;妇科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
副肿瘤综合征(paraneoplastic neurological syndromes,PNS)是由全身恶性肿瘤的远隔效应引起中枢神经系统、周围神经、自主神经系统或肌肉损害的一组综合征,与肿瘤的直接侵犯和转移无关,其临床表现多样,主要包括副肿瘤性小脑共济失调、副肿瘤性边缘叶脑炎、副肿瘤性脑干脑炎、副肿瘤性周围神经病(paraneoplastic peripheral neuropathy,PPN)等[1]。目前PPN患者中常检测出的副肿瘤抗体是抗Hu、CV2、Amphiphysin抗体[2,3,4],而抗Yo抗体相关的周围神经病少见。本文报道抗Yo抗体阳性的PPN 1例,为临床提供参考。
患者,女性,78岁,因"四肢麻木无力2年"于2020年11月9日入院。患者2年前无明显诱因出现双手指和双脚趾麻木,症状逐渐向近端发展。18个月前出现四肢无力,以双上肢为重,表现为抬举费力,双手持物可,尚可独立行走。2个月前症状明显加重,出现双上肢持物不能,下肢行走困难,需他人搀扶行走,伴四肢烧灼样疼痛,偶有饮水呛咳,无吞咽困难、构音障碍,无恶心、呕吐,无发热,无视物模糊,无耳鸣、听力下降,无大小便障碍等。就诊于当地医院,行颈椎、腰椎磁共振示颈、腰椎间盘突出。患者口服甲钴胺等营养神经药物治疗,四肢麻木、无力症状未见好转。患者自发病以来,饮食、睡眠、大小便正常,近2年体质量减轻15 kg。既往有冠状动脉粥样硬化性心脏病、脑梗死病史,未遗留后遗症,无家族遗传病史。
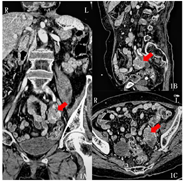
入院体格检查:神志清楚,言语清晰流利,悬雍垂居中,双侧软腭抬举可,咽反射存在,余颅神经检查正常。双上肢肌萎缩,双上肢近端肌力2级、远端1级,双下肢肌力4级,四肢肌张力低,双侧肘关节以下针刺痛觉减退,双膝关节以下针刺痛觉、震动觉、位置觉减退,双侧指鼻试验、轮替试验不能完成,跟-膝-胫试验尚可,四肢腱反射未引出,双侧Babinski征阴性。血尿便常规、肝肾功能、电解质、凝血功能、病毒系列、血管炎抗体、抗干燥综合征A型和B型抗体、血清免疫固定电泳未见明显异常。血清维生素B12 1 446 pg/ml(参考180~914 pg/ml),抗核抗体1∶1000,肿瘤标志物:糖类抗原125 4 053 U/ml(参考0~35 U/ml),人附睾蛋白4 293 pmol/L(参考0~140 pmol/L),糖类抗原724 11.5 U/ml(参考0~6.9 U/ml)。血清抗Yo抗体阳性,神经节苷酯抗GM1、GD1a、GD1b、GD2抗体阳性。腰穿脑脊液清亮、透明,压力正常,有核细胞计数13×106/L,单个核细胞为主(10×106/L),蛋白0.57g/L(参考0.15~0.45 g/L),葡萄糖和氯化物正常,脑脊液细胞学:可见少量成熟淋巴细胞、单核细胞。肌电图:多发周围神经受损(双侧基本对称,上肢重,累及运动、感觉纤维,轴索损害与脱髓鞘并存,以轴索损害为主,下肢以感觉纤维为主)。运动、感觉神经传导速度结果见表1、表2。F波:双胫神经F波出现率及潜伏期正常。针极肌电图:右第一骨间肌、肱二头肌及左拇短展肌可见纤颤电位和正锐波,右肱二头肌运动单位电位时限延长,右第一骨间肌、左拇短展肌主动收缩无运动单位电位,余所检肌募集电位减少。全腹盆腔增强CT:左侧附件区囊实性肿块,考虑卵巢癌;腹盆腔及腹膜后多发增大淋巴结,考虑转移(图1)。妇科会诊,考虑卵巢癌可能性大,建议进行B超引导下穿刺活检,转妇科行手术治疗。患者及家属要求出院,未行活检及手术治疗。

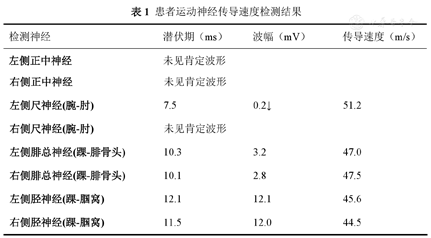
患者运动神经传导速度检测结果
患者运动神经传导速度检测结果
| 检测神经 | 潜伏期(ms) | 波幅(mV) | 传导速度(m/s) |
|---|---|---|---|
| 左侧正中神经 | 未见肯定波形 | ||
| 右侧正中神经 | 未见肯定波形 | ||
| 左侧尺神经(腕-肘) | 7.5 | 0.2↓ | 51.2 |
| 右侧尺神经(腕-肘) | 未见肯定波形 | ||
| 左侧腓总神经(踝-腓骨头) | 10.3 | 3.2 | 47.0 |
| 右侧腓总神经(踝-腓骨头) | 10.1 | 2.8 | 47.5 |
| 左侧胫神经(踝-腘窝) | 12.1 | 12.1 | 45.6 |
| 右侧胫神经(踝-腘窝) | 11.5 | 12.0 | 44.5 |
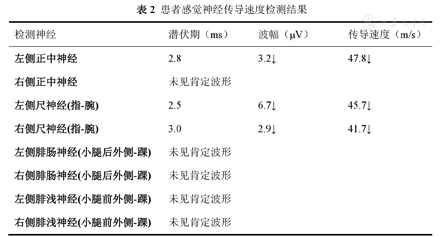
患者感觉神经传导速度检测结果
患者感觉神经传导速度检测结果
| 检测神经 | 潜伏期(ms) | 波幅(μV) | 传导速度(m/s) |
|---|---|---|---|
| 左侧正中神经 | 2.8 | 3.2↓ | 47.8↓ |
| 右侧正中神经 | 未见肯定波形 | ||
| 左侧尺神经(指-腕) | 2.5 | 6.7↓ | 45.7↓ |
| 右侧尺神经(指-腕) | 3.0 | 2.9↓ | 41.7↓ |
| 左侧腓肠神经(小腿后外侧-踝) | 未见肯定波形 | ||
| 右侧腓肠神经(小腿后外侧-踝) | 未见肯定波形 | ||
| 左侧腓浅神经(小腿前外侧-踝) | 未见肯定波形 | ||
| 右侧腓浅神经(小腿前外侧-踝) | 未见肯定波形 | ||
诊断:结合患者临床症状表现、体征,实验室指标、腰穿、电生理等辅助检查结果以及妇科会诊意见,确诊为抗Yo抗体相关的PPN。
鉴别诊断:(1)慢性炎性脱髓鞘性多发性神经根神经病:此病例患者有周围神经受累的症状和体征,虽然肌电图提示上下肢周围神经损害,但以轴索损害为主,没有明显根性受累证据,脑脊液结果未显示明显蛋白-细胞分离,所以不支持该诊断。(2)副蛋白血症性周围神经病:常见病因包括多发性骨髓瘤、华氏巨球蛋白血症、POEMS、意义未明的单克隆丙种球蛋白病,主要累及感觉神经,以脱髓鞘病变常见,此患者血清免疫电泳阴性,且肌电图显示以轴索损害为主,所以不支持该诊断。(3)淀粉样变性周围神经病:可以分为家族性淀粉样变性多周围神经病、获得性多发周围神经病、散发性淀粉样神经病,出现周围神经、自主神经损害等症状。此患者有周围神经损害证据,但是未发现其他部位淀粉样蛋白沉积,且无家族史,不支持该诊断。
住院期间给予激素(80 mg/d×7d)、营养神经(维生素B1 100 mg/d×10 d、甲钴胺1 mg/d×10 d)、止痛(普瑞巴林100 mg/d×10 d)等药物治疗。
患者出院时四肢无力、疼痛较前稍有好转,麻木症状较前无明显变化,放弃行手术治疗。出院后继续口服醋酸泼尼松龙片60 mg/d,每2周减量5 mg。出院2个月后电话随访时患者死亡。
PPN是一种累及到周围神经系统的PNS。PNS的发病机制尚不完全清楚,目前普遍认为与抗体介导的免疫机制有关[5]。在部分PNS患者中可以检测出相关的副肿瘤抗体,也有部分患者即使副肿瘤抗体阴性,也可以出现PNS。2004年Graus等[6]提出了PNS的诊断标准,并得到了国际上的普遍认可,主要包括四个方面:(1)具有典型的PNS综合征,且在临床症状出现后5年内发现肿瘤;(2)具有非典型PNS综合征,且在肿瘤治疗后明显改善,前提是该PNS综合征不易自发缓解;(3)具有非典型PNS综合征和PNS抗体,且在症状出现5年内发现肿瘤;(4)有典型或非典型PNS综合征,且有特征性的PNS抗体,但未发现肿瘤。本例患者有周围神经受损证据,以轴索损害为主,同时感觉纤维及运动纤维均受累,并在发病2年内筛查出肿瘤和Yo抗体,按照上述诊断标准,可以诊断为PNS。经过完善其他系统性自身免疫疾病相关抗体、代谢及感染等指标化验后,可排除神经系统症状是由代谢、炎症、结缔组织病等因素所致,故可以确诊为抗Yo抗体相关的PNS。
Yo抗体,也称1型抗浦肯野细胞胞质抗体,是由Greenlee等[7]于1983年在副肿瘤性小脑变性的患者中发现的一种抗浦肯野细胞的特异性自身抗体。Yo抗体能靶向特异性结合浦肯野细胞内的核糖体、内质网和高尔基体。其靶抗原是小脑变性相关蛋白-2(CDR2)和六氨基酸序列(L/FLEDVE)[8,9]。研究发现,抗Yo抗体多见于女性患者,且与肿瘤密切相关,其中常见的是乳腺癌、卵巢癌和膀胱癌[10]。这可能与这些患者体内出现CDR2过表达,从而触发了自身抗体的合成有关[11]。因此本例患者在检测出抗Yo抗体阳性后,我们对其进行了肿瘤筛查,发现了盆腔占位性病变,高度怀疑卵巢癌,但没有进一步病理活检证据支持。
目前研究发现,Yo抗体引起的PNS,多表现为副肿瘤性小脑变性、边缘叶脑炎、眼阵挛-肌阵挛综合征[9]。但是,抗Yo抗体阳性的PPN病例却很少被报道。在美国进行的一项长达21年的研究显示,约有10%的抗Yo阳性的PNS患者曾出现周围神经损害的表现。Taieb等[12]报道了1例抗Yo抗体阳性的PPN女性患者,仅表现出左上肢的单纯感觉性神经病变,感觉传导速度测定显示左侧正中神经、尺神经和桡神经未引出动作电位。2011年McNamara等[13]报道了1例患有卵巢癌的背根神经节病患者,神经电生理显示感觉神经动作电位缺失,运动神经传导速度正常,血清抗Yo抗体阳性,证实抗Yo抗体也可以表达在副肿瘤性背根神经节病的患者中。本例患者先出现的感觉症状,之后出现四肢运动障碍,虽然感觉与运动神经均受累,但是感觉症状体征表现的更为明显,但因二者同时受损,故应归为副肿瘤性感觉运动神经病,这与既往报道的抗Yo抗体相关的PPN患者的表现不同。
抗体与PPN的临床表现可能存在相关性。既往研究显示在PPN的患者中,常检测出抗Hu、CV2、Amphiphysin等抗体。这些抗体阳性的患者可单独或合并出现感觉、运动和自主神经受累的表现,通常感觉神经受累症状体征较重[14],且单纯感觉神经受累的患者少见[15]。这在抗Yo抗体阳性的PPN患者中还需进一步研究证实。本例患者为慢性起病,有周围神经损害的症状和体征,电生理检查显示多发周围神经损害,以轴索损害为主,脱髓鞘程度较轻,这与既往研究中结果一致[16]。
目前暂无统一的用于PPN的治疗方案,目前临床上主要采取原发肿瘤的治疗,还可以经验性应用激素、免疫球蛋白、血浆置换、免疫抑制剂等[17]。本例患者由于年龄大、合并基础疾病、以及自身经济条件的限制,仅以应用激素和相关对症药物治疗,效果欠佳,病情进展,预后较差。PPN的诊断目前主要依赖于临床症状、电生理检查及相关副肿瘤抗体等。当临床上出现周围神经严重损害,且当前症状体征不能用临床常见疾病解释时,我们应积极进行副肿瘤抗体检测,并筛查全身肿瘤,可能有助于PPN的早期诊断,以尽早进行针对性的治疗,提高患者的生活质量,改善预后。
所有作者均声明本研究不存在利益冲突



























