
患儿,2岁3个月,确诊急性淋巴细胞白血病高危组,先后进行化疗、异基因造血干细胞移植、嵌合型抗原受体基因修饰的T细胞治疗。因低热就诊。
入院体格检查:精神可,肺部听诊无异常,治疗过程中出现反复发热,伴右侧第五脚趾指甲和甲床发黑,随后出现追视差、意识模糊、右手手指间断性抽搐。
胸部CT示肺部团片影进行性进展,行肺部灌洗液检查,影像学检查示肝脏可见脓肿灶、脑部异常密度灶,经组织培养、血培养、骨髓培养、脑脊液宏基因组二代测序诊断为多部位毛霉菌感染。
抗细菌药物先后应用美罗培南、利奈唑胺、复方磺胺注射液、替加环素、头孢他啶阿维巴坦、万古霉素、环丙沙星治疗,抗真菌药物先后应用卡泊芬净、伏立康唑、两性霉素B脂质体、两性霉素B胆固醇硫酸酯复合物,并予静注人丙种免疫球蛋白、输血支持治疗。
家属放弃治疗,后随访死亡。
儿科;血液肿瘤科;感染科;神经内科;影像科;病理科;超声医学科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)为儿童恶性肿瘤的常见疾病之一,起源于造血干细胞的恶性克隆增殖,主要治疗方案为化疗和造血干细胞移植(hematopoietic stem cell transplantation,HSCT)。对于复发难治的ALL,嵌合抗原受体T细胞治疗(chimeric antigen receptor T cell therapy,CAR-T cell therapy)是一种新型的对抗白血病肿瘤细胞的免疫疗法,取得了很好的效果。但移植后和CAR-T细胞治疗后由于大剂量的化疗药物应用、细胞免疫功能损伤导致免疫功能低下,真菌感染是影响此类患儿治疗效果、且严重时可造成死亡的一种严重的并发症。现报道1例ALL患儿异基因HSCT(allo-HSCT)和CAR-T细胞治疗后出现多部位毛霉菌感染的临床诊疗经过,提高临床医师对毛霉菌感染的早期识别和诊断的能力。
患儿,男,2岁3个月,2021年6月18日因"ALL异基因HSCT和CAR-T细胞治疗后,发热1 d"入院。2019年12月7日因"面色苍白半个月"入当地医院,经骨髓形态学、免疫分型、基因检查诊断为急性B淋巴细胞白血病(高危,MLL-AF1P阳性,CNS1)。给予VDPD方案(长春新碱+泼尼松+柔红霉素+培门冬酶)诱导缓解治疗,第33天骨髓形态学缓解,骨髓微量残留病(minimal residual disease,MRD)示异常表达细胞比值0.525%,后序贯给予CAM方案(环磷酰胺+阿糖胞苷+6-巯基嘌呤)化疗1个疗程。2020年3月14日复查骨穿,骨髓形态学示见58.2%的原始幼稚细胞,骨髓MRD示异常表达细胞比值约为44.365%,提示疾病复发,再次给予地塞米松+阿糖胞苷+柔红霉素+长春新碱方案重新诱导治疗后骨髓形态学达缓解,后序贯给予HR-1’方案(地塞米松+MTX+阿糖胞苷+培门冬酶+环磷酰胺)化疗1个疗程。
2020年7月11日来我院治疗,查骨髓形态学示缓解,骨髓MRD示未见异常表达细胞,荧光定量PCR检测MLL-AF1P基因阴性。患儿与其姐姐HLA 9/10基因相合(A位点不合),2020年7月23日给予BU/CY+ATG+司莫司汀预处理,2020年8月1日回输供者外周血干细胞,回输MNC计数7.125×108/kg,CD34+细胞6.064×106/kg,CD3细胞为3.869×108/kg,环孢素+吗替麦考酚脂抗移植物抗宿主病(graft versus host disease,GVHD)治疗,+10 d白细胞植入,+11 d血小板植入。+18 d合并Ⅳ度肠道GVHD,给予积极抗排异、营养支持治疗后好转,移植期间给予伏立康唑预防真菌治疗,肺部未发生感染。后定期门诊随诊,期间复查骨髓形态、MRD、MLL-AF1P基因均阴性,移植后4个月停环孢素。
移植后5个月(2021年12月31日)复查骨髓形态学:幼稚淋巴细胞比例为32.4%。骨髓STR示完全供者嵌合状态(姐姐来源细胞占100%),提示疾病复发。2020年1月1日给予地西他滨+阿糖胞苷+米托蒽醌方案化疗,2021年1月13日至上级医院就诊,行CAR-T细胞治疗。2021年1月19日回输供者CAR-T细胞(CD19/CD22)(7.7×106/kg),回输后合并心脏毒性和肠道感染、肝脏排异,给予限液、抗感染、抗排异和积极对症治疗后好转。回输后1个月复查骨髓形态缓解,MRD阴性,骨髓FISH检测MLL探针阴性。治疗期间肺部未见明确感染迹象,病情稳定后返我院每周输注静注人免疫球蛋白支持治疗,规律口服氟康唑片预防真菌治疗,他克莫司胶囊和甲泼尼龙片抗排异治疗,定期复查骨髓形态、MRD、MLL-AF1P基因持续阴性。
2021年6月12日开始有阵发性低热表现,最高37.7℃,可自行下降,无畏寒、寒战,无咳嗽、气促等表现,监测指脉氧波动在96%~98%,未予治疗,2021年6月18日入我院。
体格检查:体温36.8℃,脉搏102次/min,呼吸25次/min,血压85/52 mmHg(1 mmHg=0.133 kPa)。神志清楚,精神可,轻度贫血貌,呼吸平稳,三凹征阴性,双肺呼吸音粗,未闻及干湿性啰音,心腹查体无异常。神经系统查体阴性。既往史、个人史无特殊。本研究为回顾性病例系列研究,通过我院医学伦理委员会审核批准,经患儿监护人均知情同意并签署知情同意书。
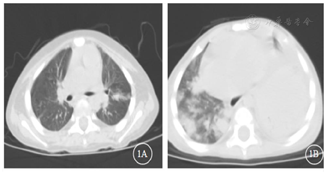
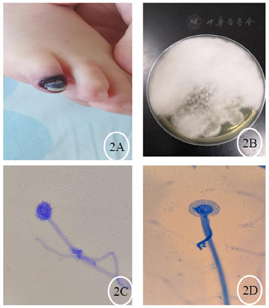
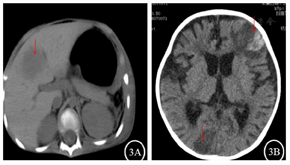
入院后实验室检查:血常规+C反应蛋白(表1),降钙素原0.138 ng/ml。巨细胞病毒(cytomegalovirus,CMV)DNA和EB病毒DNA(EBV-DNA):阴性。真菌D-葡聚糖(G)和曲霉菌半乳甘露聚糖(GM):阴性。血培养:无细菌生长。肝功能:谷丙转氨酶249.9 U/L,谷草转氨酶92.9 U/L,碱性磷酸酶472.3 U/L,γ-谷氨酰转肽酶1135.4 U/L。肾功能、电解质正常。淋巴细胞亚群:T淋巴细胞(CD3+)96%,T8淋巴细胞(CD3+CD8+)92%,T4淋巴细胞(CD3+CD4+)4%,CD4/CD8 0.05,NK细胞(CD16+56+)4%,B细胞(CD19+)0%。胸部CT:肺部团片影(图1A)。积极完善纤维支气管镜检查,肺泡灌洗液革兰染色:检出阴性杆菌、未检出抗酸杆菌。肺泡灌洗液培养阴性、未检出嗜血杆菌。肺泡灌洗液真菌培养基鉴定:未检出真菌。肺泡灌洗液下呼吸道多重细菌核酸检测:肺炎链球菌DNA、金黄色葡萄球菌DNA、耐甲氧西林mecA基因、大肠埃希菌DNA、肺炎克雷伯菌DNA、铜绿假单胞菌DNA、鲍曼不动杆菌DNA、嗜麦芽窄食单胞菌DNA、流感嗜血杆菌DNA、嗜肺军团菌DNA、结核分枝杆菌复合群DNA、肺炎支原体DNA、肺炎衣原体DNA均阴性。肺泡灌洗液宏基因组检测(metagenomics next generation sequencing,mNGS):奴卡菌属;血mNGS:奴卡菌属;PICC管培养:奴卡菌属。胸部CT示肺部片影持续进展,左肺实变伴胸腔积液出现(图1B),右侧第五脚趾呈现黑色(图2A)。影像学CT提示肝脏脓肿(图3A),双侧大脑半球多发团片状异常密度影(图3B)。右侧第五脚趾组织病理培养、骨髓培养、血培养、脑脊液和复查血液mNGS均检出小克银汉霉(图2B~D)。治疗期间血象持续、进行性下降,呈严重骨髓抑制血象(表1)。2021年7月14日行骨穿:骨髓形态增生活跃,粒红系比值形态正常,巨核细胞50个,MRD<0.01%,MLL-AF1P基因阴性,STR示完全供者嵌合状态(姐姐来源细胞占100%)。2021年8月6日复查骨髓形态示增生重度减低,红系两系受抑制,全片未见巨核细胞,MRD<0.01%,MLL-AF1P基因阴性。2021年8月6日行脑脊液检查:脑脊液细胞数为3×106/L,生化正常,体液细胞学未见异常细胞,白血病免疫分型未见异常表型细胞。
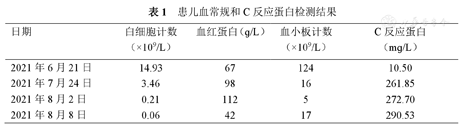
患儿血常规和C反应蛋白检测结果
患儿血常规和C反应蛋白检测结果
| 日期 | 白细胞计数(×109/L) | 血红蛋白(ɡ/L) | 血小板计数(×109/L) | C反应蛋白(mɡ/L) |
|---|---|---|---|---|
| 2021年6月21日 | 14.93 | 67 | 124 | 10.50 |
| 2021年7月24日 | 3.46 | 98 | 16 | 261.85 |
| 2021年8月2日 | 0.21 | 112 | 5 | 272.70 |
| 2021年8月8日 | 0.06 | 42 | 17 | 290.53 |



结合病史、实验室检查结果,目前该患儿诊断:1.多部位毛霉菌感染(肺部、皮肤、血、脑部、肝脏);2.奴卡菌属败血症;3. ALL;4.异基因HSCT术后;5. CAR-T细胞治疗后;6.肝脏慢性GVHD。
入院后给予舒普深50 mg/kg、每8小时1次和卡泊芬净首剂70 mg/m2、维持剂量50 mg/m2抗感染、他克莫司0.5 mg、每12小时1次和甲泼尼龙片6 mg、每日1次抗排异治疗,患儿体温稳定。2021年6月26日复查胸部CT提示肺炎加重,停卡泊芬净,改为伏立康唑8 mg/kg、每12小时1次抗真菌治疗。2021年7月3日患儿再次出现反复发热,以低热为主,热峰37.7~38.0℃,复查胸部CT示仍进行性加重。2021年7月7日完善纤维支气镜检查,肺泡灌洗液mNGS提示皮疽奴卡菌属,给予调整为美罗培南40 mg/kg、每8小时1次,利奈唑胺10 mg/kg、每8小时1次,继续联合伏立康唑抗感染治疗,并间断输注静注人免疫球蛋白2.5 g免疫支持治疗,患儿仍有低热。2021年7月12日PICC管培养和血mNGS回示见奴卡菌属生长,联合复方磺胺注射液0.2 g、每12小时1次联合抗感染治疗,但发热热峰呈升高趋势,38.5℃,每日1~2次,且三系出现进行性下降,给予粒细胞刺激因子升白细胞、输注悬浮红细胞和机采血小板支持治疗,并停用影响血象的药物。2021年7月17日停斯沃,加用替加环素1.2 mg/kg、每12小时1次,患儿体温热峰仍持续升高,达39.0℃,热峰2~3次/d。2021年7月23日停替加环素和美平,改为头孢他啶阿维巴坦62.5 mg/kg、每8小时1次,阿米卡星7.5 mg/kg、每12小时1次抗感染治疗,并予甲强龙改为静点控制炎症反应,停用他克莫司,患儿体温仍无好转,甲强龙逐步减量。2021年7月24日出现右侧第五脚趾指甲发黑,面积逐渐扩大至甲床、指腹(图2A)。2021年7月27日行右侧第五脚趾指甲组织培养。2021年7月29日培养结果回示小克银汉霉,给予停用威凡,加用两性霉素B脂质体3 mg/kg、每日1次,患儿每日仍有2~3次热峰,热峰稍有下降,38.0℃,应用两性霉素B脂质体后患儿出现顽固性低钾血症。2021年8月2日更换为两性霉素B胆固醇硫酸酯复合物4 mg/kg、每日1次抗真菌治疗,患儿热峰和发热间隔无好转。
2021年8月7日患儿出现右侧手指间断抽搐、嗜睡,完善16排肝脏、头颅CT平扫示肝左叶团状低密度灶、双侧大脑半球多发团片状异常密度影、脑萎缩样改变,提示病情呈进行性进展,家属放弃治疗,随访患儿于当天死亡。
ALL是儿童最常见的恶性肿瘤,5年生存率已达90%以上,目前化疗和异基因HSCT是主要的治疗手段,但复发和难治的ALL患儿的治疗仍存在挑战,CAR-T细胞免疫治疗对于复发/难治的B-ALL取得了很好疗效,可作为难治性ALL的挽救性治疗方案[1,2,3]。该患儿为高危的B-ALL,化疗过程中复发,根据诊疗指南[4],行异基因HSCT。然而移植后复发,为复发难治性B-ALL。在降低肿瘤负荷后,进行了双靶点CAR-T细胞免疫治疗再次缓解,虽然最终因合并感染死亡,但白血病持续缓解状态,提示双靶点的CAR-T细胞免疫治疗在此类患儿中的疗效是肯定[5],也是传统治疗方法外的首选方法之一。该患儿在治疗后出现了心脏毒性,提示该治疗的毒副作用仍是其关注点和研究热点。该患儿采用了供者来源的细胞进行了CAR-T细胞治疗,这为HSCT后复发的患儿提供了新的治疗思路,HSCT后序贯供者来源的CAR-T细胞免疫疗法是可行的,且有可能会降低复发的概率。但该患儿出现了肝脏慢性GVHD,提示应用供者来源的细胞进行免疫治疗时,需预先进行评估GVHD的风险和回输后密切关注是否出现GVHD。且根据报道[6],有可能出现危及生命的GVHD。这是和自体来源的细胞进行免疫治疗的不同之处。
复发/难治ALL由于经历了长时间高强度的化疗、HSCT甚至CAR-T细胞免疫疗法等一系列的治疗,免疫功能长期处于严重低下的状态,治疗过程中的感染不容忽视,可严重影响患儿的预后。侵袭性真菌病(invasive fungal disease,IFD)在此类人群中多见,是导致患儿死亡的重要原因之一。毛霉菌病是IFD的一种,与曲霉菌和念珠菌导致的IFD相比,在临床相对少见[7]。据现有报道,在毛霉菌病中常见的是根霉菌、毛霉菌、根毛霉菌,小克银汉霉属引起的感染病例报道较少[8],最常见的感染部位是肺和鼻脑,其他部位如皮肤、胃肠道或全身播散性较为少见[9]。其中播散性的死亡率达100%[10],其临床表现无明显特异性,特别是早期感染阶段,即使出现发热等症状也难以和其他原因导致的发热鉴别。其影像学检查的表现亦是多样化,多发结节、斑片影等均可出现,增加了该病早期诊断的难度。真菌培养的阳性率低,微生物培养和组织病理学检测仍是诊断的金标准,随着检测技术的进步,病原微生物mNGS在临床工作中有很大的帮助,其检测敏感性高、速度快,在罕见病原体或培养困难的病原体检测中,可以弥补目前传统方法的不足。毛霉菌病的首选治疗药物为两性霉素B,但该药容易引起肝肾功能损害、电解质紊乱导致患者的耐受性差,临床实际应用中可以选择不良反应较小的两性霉素B脂质体。另有研究报道泊沙康唑可作为推荐的替补治疗方案,但建议其血药浓度应>2 μg/ml[11]。
本例患儿为HSCT、CAR-T细胞治疗后,因低热入院。入院后查淋巴细胞亚群示B细胞为0,免疫功能未重建,既往并无真菌感染病史,院外口服氟康唑预防真菌治疗中。入院后虽然予卡泊芬净、伏立康唑积极抗真菌治疗,但肺部仍呈进行性进展,且出现局部组织的真菌感染,组织病理培养为小克银汉霉。经过常规培养和mNGS的检测,骨髓和血、脑脊液均检出小克银汉霉。肝脏CT提示可见脓肿,虽未进行肝脏穿刺活检检查,但患儿基础疾病处于缓解状态,支持脓肿为感染性,结合患儿血液和骨髓均检出小克银汉霉,传播途径应为血流感染播散所致。该明确病原菌后根据诊疗指南,予两性霉素B脂质体应用,由于患儿不能耐受顽固性低钾血症,更换为两性霉素B胆固醇硫酸酯复合物,但该患儿表现不典型,治疗过程检测出奴卡菌属,早期并无明确真菌感染的证据,使毛霉菌感染被掩盖,且感染导致骨髓正常的造血功能被抑制,积极的粒细胞刺激因子升白细胞、输血并未能改善患儿的血象,没有争取足够的时间控制多部位的毛霉菌感染,病情持续恶化,最终死亡。
总之,毛霉菌病的早期诊断和治疗极为关键。清除危险因素、早期识别必要时运用mNGS等检测手段辅助诊断,及时调整治疗,可以降低病死率,改善预后。此例病有一定临床借鉴作用,提醒医师在常规治疗效果不佳的感染时需警惕不常见病原菌,在早期控制疾病进展,提高患儿生存率。
所有作者均声明本研究不存在利益冲突



























