
患者,女性,26岁,以活动后胸闷、气短症状为表现就诊。
患者怀孕后出现活动后胸闷、气短,休息后减轻,随怀孕月份增长症状逐渐加重。入院半个月前患者出现静息状态下胸闷、憋气、气短,夜间不能平卧,需半卧位及吸氧方能改善。入院后查体提示双肺呼吸音稍粗,左肺底及右下肺可闻及细湿啰音。肺动脉瓣区第二心音亢进。
患者完善心脏超声示:1.继发孔型房间隔缺损,缺口大小22 mm,双向血液分流;2.右心增大,左房增大;3.重度肺动脉压力增高,肺动脉收缩压估测值79 mmHg(1 mmHg=0.133 kPa);4.三尖瓣中-重度关闭不全。完善右心导管术测压示:主肺动脉压为92/42 mmHg,右心室压为87/9 mmHg,右心房压为15/11 mmHg。患者心脏彩超及右心导管检查均提示主肺动脉压力明显升高,患者妊娠合并先天性心脏病伴肺动脉高压的诊断明确。
患者重度肺动脉压力升高合并妊娠,于VA-ECMO支持下给予引产治疗后,予以口服西地那非及安立生坦治疗。
患者在VA-ECMO支持下成功引产,引产术后患者心脏负荷较前明显减轻,加用西地那非级安立生坦降低肺动脉压力后,患者胸闷气短症状较前明显缓解,出院前复查心脏彩超提示肺动脉压力及三尖瓣跨瓣压力较前明显下降。
心血管内科;妇产科;重症医学科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
肺动脉高压(pulmonary hypertension,PH)是指由多种异源性疾病(病因)和不同发病机制所致肺血管结构或功能改变,引起肺血管阻力和肺动脉压力升高的临床和病理生理综合征,继而发展成右心衰竭甚至死亡。根据2021版中国肺动脉高压诊断与治疗指南,诊断PH的金标准为:海平面、静息状态下,经右心导管检查测定的肺动脉平均压(mean pulmonary artery pressure,mPAP)≥25 mmHg(1 mmHg=0.133 kPa)[1]。由于心导管检查为有创检查,临床上尤其是妊娠期间多采用超声心动图测得的三尖瓣返流速估测肺动脉收缩压[2],超声心动图估测的肺动脉收缩压≥40 mmHg可诊断PH,并定义肺动脉收缩压≥80 mmHg为重度PH[3,4]。妊娠期孕妇的心输出量增加30%~50%,血容量增加40%~50%,耗氧量增加20%,且全身血管阻力降低,其中包括肺血管[5]。这导致mPAP在整个正常妊娠期相比孕前期基本无变化。但对于PH患者来说,长期代偿逐渐导致肺动脉收缩及重塑,肺动脉弹性下降,在妊娠期则无法适应逐渐增多的血容量及心输出量,mPAP呈进行性升高,右心室后负荷增大,甚至右心衰竭。尤其在妊娠20~24周、分娩期及产后时期易出现PH的急剧恶化[6]。PH合并妊娠的发生率约为1.1/10万,但病死率可高达30%~56%[7]。PH迄今仍无有效的治疗方法,尤其是重度PH合并妊娠患者,难以耐受妊娠晚期及分娩期血流动力学变化,极易发生肺动脉高压危象,导致孕产妇猝死。本文报道1例危重症肺动脉高压合并妊娠患者的临床表现、诊疗经过及转归,为危重症肺动脉高压合并妊娠的诊治提供参考。
患者,26岁。因"活动后胸闷、气短不适5个多月,加重半个多月"于2021年4月24日入院。患者于2020年12月怀孕后出现活动后胸闷、气短,休息后减轻,随怀孕月份增长症状逐渐加重。半个月前患者出现静息状态下胸闷、憋气、气短,夜间不能平卧,需半卧位及吸氧方能改善,无明显胸痛,无头晕、头痛,无发热、咳嗽、咳痰、咯血,无黑朦、晕厥。外院予以维护心功能、利尿、稳定内环境及对症治疗,患者症状无明显改善,为求进一步诊治转至我院,门诊以"重度肺动脉高压"收入心血管内科监护病房。
入院时脉搏93次/min,呼吸频率20次/min,血压90/58 mmHg,血氧饱和度94%。神志清,精神差,双肺呼吸音稍粗,左肺底及右下肺可闻及细湿啰音。心率93次/min,律齐,肺动脉瓣区第二心音亢进。
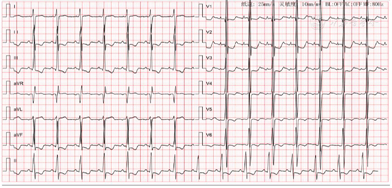
生化检查示:高敏心肌肌钙蛋白I正常,氨基末端脑钠肽前体1000 ng/L(正常值<450 ng/L)。碳酸氢根15.5 mmol/L(正常值22.0~29.0 mmol/L,下同)。乳酸脱氢酶258 U/L(135~214 U/L),超敏C反应蛋白6.0 mg/L(<2.87 mg/L),血沉、电解质、凝血常规正常。心电图(图1)示:窦性心律、右束支传导阻滞、电轴右偏、左室高电压、右室高电压、T波异常、ST-T改变。心脏超声(表1)示:1.继发孔型房间隔缺损(atrial septal defect,ASD),缺口大小22 mm,双向血液分流;2.右心增大,左房增大;3.重度肺动脉压力增高,肺动脉收缩压估测值79 mmHg;4.三尖瓣中-重度关闭不全。胸部超声未见胸腔积液。

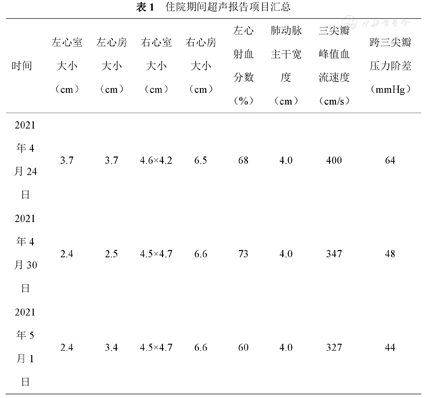
住院期间超声报告项目汇总
住院期间超声报告项目汇总
| 时间 | 左心室大小(cm) | 左心房大小(cm) | 右心室大小(cm) | 右心房大小(cm) | 左心射血分数(%) | 肺动脉主干宽度(cm) | 三尖瓣峰值血流速度(cm/s) | 跨三尖瓣压力阶差(mmHg) |
|---|---|---|---|---|---|---|---|---|
| 2021年4月24日 | 3.7 | 3.7 | 4.6×4.2 | 6.5 | 68 | 4.0 | 400 | 64 |
| 2021年4月30日 | 2.4 | 2.5 | 4.5×4.7 | 6.6 | 73 | 4.0 | 347 | 48 |
| 2021年5月1日 | 2.4 | 3.4 | 4.5×4.7 | 6.6 | 60 | 4.0 | 327 | 44 |
根据患者现症状、体征及目前检查结果,考虑患者目前诊断为慢性心力衰竭急性加重;继发性重度肺动脉高压;房间隔缺损(继发孔型);三尖瓣关闭不全;孕22周。根据患者病情,择期需完善右心导管检查。
鉴别诊断:(1)左心疾病所致的肺动脉高压。左心疾病是PH的最常见病因,常见于高血压病,二尖瓣、主动脉瓣疾病,右心导管检查表现为肺动脉压力轻中度升高,跨肺压差正常,肺毛细血管楔压(pulmonary capillary wedge pressure,PCWP)>15 mmHg。(2)肺部疾病和/或低氧导致的肺动脉高压。慢性阻塞性肺疾病是该类PH的最常见病因,此外还有间质性肺疾病所致的PH,此类患者多有慢性咳嗽、咳痰、呼吸睡眠暂停或打鼾病史,体格检查可发现杵状指,桶状胸,完善肺通气功能可见通气/弥散功能异常,完善肺部CT可见肺气肿,肺实质和间质异常征象。(3)慢性血栓栓塞性肺动脉高压和(或)其他肺动脉阻塞性病变所致肺动脉高压:此类PH以慢性血栓栓塞性肺动脉高压(chronic thromboembolic pulmonary hypertension,CTEPH)最为常见,该类型PH好发于特定类型患者,多见于脾切除,心房分流术后,急性肺栓塞,慢性炎症,仅有1/3的CTEPH患者存在明确的下肢深静脉血栓或急性肺栓塞病史,最新研究显示急性肺栓塞2年后CTEPH累积发病率约为2.3%[23]。此类PH确诊需完善肺动脉造影。此外肺血管炎也可导致PH,肺血管炎所致PH多为全身大动脉炎累积肺动脉,其常被误诊为CTEPH,多伴有多系统受累,确诊需行组织活检。
患者入院后给予吸氧、抗感染(头孢哌酮钠他唑巴坦钠)、抗凝(低分子肝素)、降肺动脉压(西地那非25 mg、1次/d)、激素(甲强龙40 mg)及对症支持治疗。
由于患者病情危重,及时组织全院多学科会诊(multidisciplinary team,MDT),MDT意见:1.患者现妊娠中期,发现房缺,重度肺动脉高压,心肺功能差,不宜继续妊娠,建议终止妊娠;2.在CCU病房行经阴道引产术终止妊娠;3.根据血压逐渐增加西地那非剂量,以降低肺动脉压;4.若引产术中及术后出现疼痛可请麻醉科行椎管内镇痛;5.停用低分子肝素,以免术中出血;6.待分娩结束后再行心脏手术。
根据MDT会诊意见给予降低肺动脉压力药物治疗,引产期间随引产药物使用后患者出现SpO2下降至56%,给予无创呼吸机不能改善。遂紧急气管插管,患者同时出现血压下降,最低至77/40 mmHg,血气分析示严重酸中毒(pH 7.15),予以多巴胺、碳酸氢钠治疗,效果不佳,心率125次/min,血氧饱和度在60%~70%波动,氧合改善不明显,随后予以床边经皮股动静脉体外膜肺氧合(Venoarterial extracorporeal membrane oxygenation,VA-ECMO)置入。初始流量2.5 L/min,转速3000 r/min;患者血压可维持在90~100/60~70 mmHg,心率80次/min左右,血氧饱和度可维持在95%~99%。
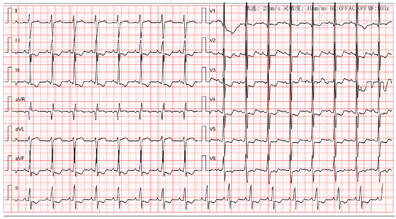
于VA-ECMO支持下患者顺利引产。29日成功拔除气管插管,患者意识清楚,生命体征平稳,治疗上加用安立生坦(1.7 mg 1次/d)降低肺动脉压。VA-ECMO支持下复查心脏彩超示患者心功能较前好转(表1),下调参数后患者情况稳定,VA-ECMO支持5 d后成功撤机。后为评估肺动脉压情况行右心导管术测压:主肺动脉压为92/42 mmHg,右心室压为87/9 mmHg,右心房压为15/11 mmHg;肺动脉压数值高不宜行ASD封堵术,建议药物治疗一段时间后根据肺动脉压考虑择期封堵。术后调整降低肺动脉压力药物:安立生坦(5 mg 1次/d),西地那非(50 mg、2次/d)。术后患者16 d后一般情况良好,要求出院,出院前复查心电图示(图2):1.窦性心律;2.不完全右束支阻滞;3.右室肥大;4.ST-T改变。出院诊断为:心源性休克;艾森曼格综合征;房间隔缺损;三尖瓣关闭不全;1型呼吸衰竭。

本例为房间隔缺损孕中期女性,发生重度肺动脉高压,病情危重,VA-ECMO支持下经综合治疗后好转出院,此类病例国内罕见。该患者孕22+周,心脏彩超示:ASD(继发孔型,左缘大血管短轴切面22 mm,双向血液分流);入院后肺动脉收缩压估测值79 mmHg,之后右心导管检查肺动脉压92/42 mmHg;妊娠合并先天性心脏病伴肺动脉高压的诊断明确。患者孕前一般活动下未出现明显症状,且外院心脏彩超未发现ASD,此次入院发现的ASD缺口直径为22 mm,目前经胸超声心动图能够明确诊断缺损直径≥25 mm为大孔ASD[8]。此例患者属于轻中度ASD。李雯等[9]报道ASD患者中PH的发生率为17.30%,轻中度ASD一般不会导致重度肺动脉高压。本例患者可能存在原发性PH,ASD为基础病因,妊娠成为诱发PH急性加重的重要原因。
本例患者血氧饱和度急剧下降后气管插管无法改善缺氧,因为气管插管主要是改善肺通气,但PH患者肺通气功能无明显下降,只是右心室血液难以流向肺内进行氧合供应全身,所以气管插管对本类患者作用不大。
近年来有报道ECMO可作为PH患者心功能失代偿时的桥梁[10]。VA-ECMO是一种循环呼吸辅助手段,对呼吸和/或循环衰竭的患者进行体外支持,使受损的心肺充分休息,为心、肺功能恢复创造条件[11]。该技术近一两年中才在重度PH合并妊娠的患者中使用[12]。有报道指出,接受ECMO的PH患者由于严重的右心衰竭在分娩后存活时间未超过3个月[13]。目前此类病例较少,ECMO在此类患者中使用的短期和长期效果仍需进一步研究确认。对于此例患者,血氧饱和度低主要是因为肺动脉内过高的压力阻止右心血液流向肺,肺血流减少,肺内通气/血流比上升,供应全身的动脉血减少,出现全身器官的缺氧;VA-ECMO是通过股静脉将静脉血抽出体外进行充分氧合,再将氧合后的"动脉血"经股动脉输入主动脉,供应躯干及上肢,VA-ECMO可同时辅助心肺功能,让心肺得以休息,最重要的是解决了PH患者右心血液难以进入肺内的问题;而VV-ECMO将静脉血抽出氧合后仍输入下腔静脉,需经右心流经肺再流到左心以供应全身,无法解决PH患者右心血液难以进入肺内的问题,因此,重度PH患者在未去除妊娠等诱因情况下VA-ECMO几乎是唯一的治疗之策。此外,如果VA-ECMO泵的压力过大,可能出现的较严重的并发症就是患者心脏和机器对抗,导致左心内压力过高,而此PH患者的基础病因是房间隔缺损,正好左心可以经缺损处向右心分流释放压力,所以此病例是VA-ECMO的良好适应症。故选择VA-ECMO支持技术,帮助患者度过引产前后的急性期,维持生命体征。
PH患者行VA-ECMO支持可能存在的撤机困难的问题,但是本例患者引产后最终得以成功撤机,而并未再次出现重度肺动脉高压,可能原因是:患者孕前长期房缺可代偿,维持稍高的肺内动脉压,现去除妊娠这一重大诱因后,患者在VA-ECMO支持下度过了急性期,可以恢复孕前的代偿状态。
由于妊娠合并心脏病伴PH的死亡率高,最新专家共识,无论患者的世界卫生组织心功能分级多少、mPAP分度如何,均应严格避孕[14]。对于已经发生的妊娠合并心脏病伴PH,及时终止妊娠施已是共识,在孕中期建议行封堵术或体外循环下的心脏外科手术治疗[18]。但本例患者为重度肺动脉高压,房间隔缺损处已出现双向分流,即发生艾森曼格综合征,需要右向左分流以释放压力,不宜封堵。对于终止妊娠的方式,最佳方法仍然存在争议,国内关于PH合并妊娠的指南建议根据患者的风险分级来决定终止妊娠的方式,本患者孕中期,心功能IV级,根据风险分级,考虑为高危组,共识建议剖宫产,因其可在较短时间内终止妊娠,避免长时间子宫收缩引起血流动力学变化,减轻疲劳与疼痛引起的耗氧量增加,可较好控制血流动力学改变及生理学变化,同时共识建议对于孕中期同时合并严重心血管并发症(重度肺动脉高压、严重瓣膜狭窄、严重心脏泵功能减退等)的高危患者,应尽早终止妊娠[14]。但也有报道显示,PH轻度升高且足月,患者可耐受阴道分娩,结局良好,同时也有国外研究提倡选用进阴道引产的方式进行分娩[14,15,16,17]。经MDT专家组讨论,本例病情危重,有VA-ECMO支持,且胎儿较小,孕妇宫缩强度、频率均正常,无解剖结构上的禁忌,虽然阴道分娩期间的血管迷走神经反应会减少经脉回流,但剖宫产也有同样的影响,且剖宫产为外科手术,对患者的心肺功能要求更为严苛,同时在ECMO支持下行剖宫产手术可能导致更多的失血,综合考虑患者更适宜经阴道分娩。
患者因氧合难以维持,行VA-ECMO支持治疗,导致患者氧合无法维持的原因是妊娠持续所致的心肺负荷加重,如无法解除心肺负荷,甚至可能导致患者发生心源性休克甚至导致死亡,在此情况下,唯有使用ECMO进行生命支持方可继续引产,但使用VA-ECMO需要充分抗凝,可能导致患者阴道分娩后出现大出血,若引产后子宫收缩无力或不完全流产,可出现致命性大出血,需要紧急切除子宫,甚至危及生命。既往报道的在妊娠过程中使用VA-ECMO支持的病例较少,但有研究表明,ECMO支持下的妊娠和产后患者的总体母体生存率与非妊娠患者相似,但目前就妊娠患者使用ECMO的抗凝治疗来说,维持抗凝的最佳活化凝血时间(Activated clotting time,ACT)及部分活化凝血酶时间(activated partial thromboplastin time,APTT)范围尚未达成共识,在各种研究中,多将ACT维持于140~220 s,APTT多维持于50~80 s[19,20,21]。经心内科、产科及多学科综合评估,ECMO支持下引产为目前患者最适宜选择,但抗凝治疗会大大增加患者的出血风险,故需针对出血风险及可能出现的并发症进行充分预案。本例患者采取综合措施来预防和应对大出血风险,包括:在VA-ECMO允许范围内下调抗凝指标,肝素用量减半,尽量不用其他抗凝药及增加出血风险的药,最后本例患者的APTT多维持于较低线(50~60 s);同时与妇产科反复进行沟通,引产前充分做好大出血预警方案(子宫内球囊压迫备用);血库留存大量红细胞、血浆等备用;维持患者凝血功能和内环境稳定(提前输注血浆及多种维生素)等。最终患者成功引产,未发生大出血。因此,对于此类高危患者,综合采取以上预警措施可以避免大出血。
目前的共识及临床经验支持在可行的情况下,选择硬膜外麻醉,优于全身麻醉,因硬膜外麻醉相对静脉药物全身麻醉可在一定程度上减少血流动力学波动,但本患者已予以VA-ECMO支持血流动力学,故经MDT专家组讨论,选择使用全身静脉麻醉,且既往已有研究报道,全身麻醉与硬膜外麻醉的生存率并无明显差异[22]。
在此类危重患者的诊疗中,MDT发挥着重要作用。本例患者有产科、麻醉科、心内科、心外科教授参与MDT讨论,对终止妊娠、降低肺动脉压、麻醉镇痛、降低出血风险的处理作了充分准备和预防,后患者恢复良好。MDT整合、协调了各专科的医疗资源及优势,为急危重症患者提供全面、综合的治疗保障,改善不良预后,预防并发症的发生,减轻术后疼痛,为患者提供优质的医疗护理服务,促进早日康复。
本例也给我们带来一些思考,患者的轻中度ASD现已发展为艾森曼格综合征,错失了ASD封堵术的最佳时机,体现了早期治疗原发病的重要意义。妊娠是其发展为重度肺动脉高压的主要诱因,而避孕是可以预防或延缓PH的发生的,可见预防措施对防止严重并发症发生的重要性。
总之,目前重度PH合并妊娠的死亡率高,临床治疗棘手,且应用VA-ECMO治疗的病例稀少。本病例由MDT合作诊疗指导,在VA-ECMO支持下,及时终止妊娠,并进行传统内科治疗和肺血管扩张剂治疗及相应的对症治疗,患者恢复良好。希望本例报道能够为此类患者的治疗提高参考,并进行疾病相关的基础及临床研究,以期为该病的诊治提供临床经验。
所有作者均声明本研究不存在利益冲突



























