
患者,女性,18岁,病程2年余,诊断Rosai-Dorfman病(又称窦组织细胞增生伴巨大淋巴结病)。
患者以反复发热、淋巴结肿大为主要表现,伴有盗汗、易疲劳,伴有鼻塞。体格检查示贫血貌,双侧颈部及乳突区、颌下多发淋巴结肿大,无压痛、质韧、活动度可、无融合。
通过淋巴结活检,病理提示组织细胞增生性病变,结合免疫组化所示S-100+,CD68+,CD1a-表型,诊断为Rosai-Dorfman病。
患者曾接受淋巴结清扫术,术后复发,后接受依托泊苷联合甲泼尼龙方案治疗,但病情持续进展,故此次给予美罗华联合来那度胺方案治疗。
接受美罗华联合来那度胺治疗2个疗程后,患者未再发热,颈部淋巴结较前缩小。随访至出院后4个多月,病情未再反复。
血液科;病理科;皮肤科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
罗萨伊-多尔夫曼病(Rosai-Dorfman病)是一种罕见的原因不明的良性组织细胞增生性疾病。主要特征是窦组织细胞增生伴淋巴结肿大以及组织细胞内有完整的淋巴细胞的现象,故又称伴巨大淋巴结病窦组织细胞增生症[1,2]。本病主要发生于儿童或青年,最常见的表现是存在体积较大的颈部淋巴结肿大,通常为双侧且无痛,也可累及淋巴结外部位如皮肤和皮下组织、骨骼和头颈部器官,确诊需要通过病理学分析[3]。本文报道1例难治性Rosai-Dorfman病,通过对疾病的全面评估实施了个体化治疗,本例报道旨在提高对本病的认识,减少误诊和漏诊,为治疗方案的选择提供思路。
患者,女性,18岁。主诉为反复发热、淋巴结肿大2年余。患者于2017年10月发现左侧颈后淋巴结肿痛、皮温增高,鸽蛋大小、质韧、活动度可、无破溃,伴有低热,38℃左右,当时无咳嗽咳痰、无腹痛腹泻、无恶心呕吐等不适。起病初至当地社区卫生中心就诊,以"上呼吸道感染"处理,予以静脉抗生素治疗(具体药物不详),未见明显好转。随后县医院继续予抗感染治疗(具体药物不详)后热退、淋巴结疼痛消失,但淋巴结仍肿大,与发病时变化不大。后颈部淋巴结逐渐增大,2017年11月就诊于外院,查颈部淋巴结超声示双侧颈部淋巴结肿大伴结构异常,右侧较大约45 mm×16 mm,左侧较大约46 mm×25 mm,查血常规示白细胞计数20.32×109/L,中性粒细胞占比0.853,血红蛋白100 g/L,血小板计数399×109/L,查骨穿细胞学:骨髓增生活跃,粒系增高占76%,细胞免疫分型:流式细胞术分析未见明显异常表型细胞群;骨髓病理:未见到异常肿瘤细胞,骨髓造血细胞增生尚可。2017年12月12日行淋巴结穿刺病理示良性淋巴组织增生性病变,考虑淋巴结窦组织细胞增生症(Rosai-Dorfman病)伴灶区IgG4阳性浆细胞数量增加。当地未予系统治疗,建议随访。
出院后患者仍有上述症状,平均每月发热1次,伴双侧多发颈部淋巴结肿大压痛,热退后压痛可消失,但淋巴结仍肿大。2018年3月16日就诊于外院,查B超示甲状腺双侧叶多发低回声结节,TI-RADS3类,双侧颈部多发淋巴结肿大,甲状腺功能正常,血常规示白细胞计数和中性粒细胞比例升高,血红蛋白77 g/L较前下降,血小板正常。2018年3月22日就诊于外院再次行左颈淋巴结清扫术,术后病理示S100(+),CD68,(+)CD1a(-),Ki67(5%~10%+),CD163(+),结合HE形态后左颈淋巴结病变考虑为Rosai-Dorfman病(窦组织细胞增生伴巨大淋巴结病);血常规示血红蛋白89 g/L,较前有上升,间断中药治疗,具体不详,但症状仍未好转,伴易疲劳、盗汗。
2018年6月29日患者于外院行淋巴结穿刺,病理可见增生活跃的淋巴细胞、浆细胞及巨噬细胞,倾向Rosai-Dorfman病(具体见后),免疫组化:CD30(-),CD163(+),CD68(+),S100(-),Ki67(10%+)。骨穿病理示骨髓造血组织增生活跃。颈胸腹盆CT示双侧颈部Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ区多发肿大淋巴结,口咽部周围及鼻咽顶后壁软组织增厚,考虑淋巴结增生可能性大,右侧斜裂及水平裂胸膜增厚,胸腔积液,纵隔内多发淋巴结、部分增大,双侧腹股沟多发小淋巴结。2018年7月11日起予依托泊苷+甲泼尼龙治疗,具体为:依托泊苷100 mg、d1~3静滴,甲泼尼龙40 mg d1~3静滴,依托泊苷50 mg口服d9、d12、d16、d19、d24、d31,泼尼松60 mg口服d1~21,d22~28逐渐减量停药。
1个月余后(2018年8月29日)患者再次入外院复查颈胸腹盆CT提示颈部淋巴结部分较前变小,纵隔内多发淋巴结部分较前增大,口咽部周围及鼻咽顶后壁软组织增厚,大致同前,双侧腹股沟区多发小淋巴结,大致同前;腹部超声示脾大。当时查血红蛋白71 g/L,血小板329×109/L。遂再次给予依托泊苷+甲泼尼龙方案治疗,具体为:依托泊苷100 mg、d1~3+甲泼尼龙40 mg、d1~3静滴,辅以护胃、升白等对症支持治疗。经2程依托泊苷+甲泼尼龙治疗后颈部淋巴结未见明显缩小。2018年12月19日再次于外院行右侧颈部淋巴结穿刺示淋巴组织反应性增生伴多量浆细胞浸润,免疫组化报告未见;结合良性病变,考虑随访,未再继续治疗。患者回到当地仍有反复发热,每次间隔15~60 d,热峰达38.5℃,发热时有畏寒、无寒战,淋巴结出现红肿热痛,伴易疲劳、盗汗,偶有高热时鼻衄,无月经量增多,每于发热时(2019年1月28日、2019年3月10日、2019年3月29日、2019年5月24日、2019年7月12日)在当地医院行依托泊苷+甲泼尼龙及抗感染治疗维持后热平、淋巴结红肿消退。
2019年7月起患者出现鼻塞,无血性分泌物或流涕、无头痛,鼻塞逐渐加重,其间患者自觉肿大淋巴结个数增多。2019年9月27日于我院行淋巴结穿刺活检示"左颈部淋巴结穿刺活检标本"组织细胞增生性病变,结合免疫组化标记结果,符合Rosai-Dorfman病。免疫组化:组织细胞S-100(+),CD68(+),PGM-1(+),CD1α(-),Langerin(-);淋巴细胞CD20(滤泡区+),CD79α(滤泡区+),CD3(滤泡外区+),CD5(滤泡外区+),Bcl-2(生发中心-),Bcl-6(生发中心+),CD30(极个别+),Ki67(生发中心约70%+),ALK-1(-),CD10(-);浆细胞CD38(+),CD79α(+),κ(部分+),λ(部分+),κ与λ比值未提示轻链限制性,IgG(+),IgG4(散在少数+);CD21(FDC+);EBV原位杂交:EBER(-)。2019年10月14日于外院行淋巴结活检,诊断尚未明确。2019年10月21日于我院进一步查PET-CT示鼻腔、鼻咽部黏膜增厚,代谢增高(SUVmax 7.6),双侧颌下、颈部、锁骨上、纵隔、右肺门多发淋巴结肿大伴代谢增高(SUVmax 9.3~10.3),骶骨、右侧髂骨溶骨性骨质破坏伴代谢增高(SUVmax 4.8~5.4),结合病史,考虑Rosai-Dorfman病相关性改变;脾肿大,代谢不高;左侧腹股沟稍高代谢淋巴结显示。现为了进一步诊治,门诊拟"局部淋巴结肿大"收入我科。自发病以来,患者神清,精神软,易疲劳,睡眠好,胃纳差,二便正常,体重近2年来减轻15 kg。患者既往否认高血压、糖尿病、冠心病、甲亢等慢性病史。2014年患水痘,中药治疗后痊愈。否认肝炎结核等传染病史。预防接种随社会。否认重大外伤史;淋巴结穿刺活检史见现病史。自述外院住院期间输注悬浮红细胞1 U,具体不详。否认药物、食物过敏史。出生生长于原籍,无疫水疫区接触史,否认烟酒等不良嗜好。月经初潮14岁,月经规律,周期约28 d,每次持续4~5 d,发病后月经周期15~30 d,量较前减少,无痛经,末次月经为2019年10月11日。未婚未育。否认家族性遗传性疾病史。
血液检查,血常规:2017年11月28日白细胞计数20.32×109/L↑,中性粒细胞百分比85.3%↑,血红蛋白100 g/L↓,血细胞比容0.34↓,平均红细胞体积78.1 fl↓,平均红细胞血红蛋白含量23.0 pg↓,平均红细胞血红蛋白浓度295 g/L↓,血小板计数399×109/L。2018年3月16日白细胞计数13.92×109/L,中性粒细胞占比0.90,血红蛋白77 g/L↓,血细胞比容0.25↓,平均红细胞体积71.3 fl↓,平均红细胞血红蛋白含量21.5 pg↓,平均红细胞血红蛋白浓度301 g/L↓,血小板计数399×109/L。2018年3月22日白细胞计数12.8×109/L↑,中性粒细胞占比0.819↑,血红蛋白89 g/L↓,血小板计数325×109/L。2018年8月30日白细胞计数7.79×109/L,血红蛋白71 g/L↓,血小板计数329×109/L。2019年10月29日白细胞计数9.61×109/L↑,中性粒细胞占比0.858↑,血红蛋白92 g/L↓,血细胞比容0.316↓,平均红细胞体积73.1 fl↓,平均红细胞血红蛋白含量21.3 pg↓,平均红细胞血红蛋白浓度291 g/L↓,血小板计数426×109/L。
生化指标:2019年10月29日总蛋白89 g/L↑,白蛋白36 g/L,白球比0.68↓,维生素B6 24.5 μmol/L(14.6~72.9 μmol/L)。
免疫指标:2017年12月13日自身免疫抗体阴性。2018年8月30日IgG 2280 mg/dl↑(751~1560 mg/dl),IgM 205 mg/dl(46~304 mg/dl),IgE 219 IU/ml↑(5.0~165.3 IU/ml),IgA 305 mg/dl(82~453 mg/dl)。2017年12月13日外周血流式CD3细胞亚群52.2%↓,CD4细胞亚群22.2%↓,CD8细胞亚群25.8%,CD4/CD8 0.86↓。2019年10月29日外周血流式CD3细胞亚群64.4%,CD4细胞亚群29.5%,CD8细胞亚群30.3%,CD4/CD8 0.97↓(1.00~2.50)。2019年10月29日IgG4 3.54 g/L↑(0.03~2.00 g/L)。
感染指标:2017年11月28日结核分枝杆菌γ-干扰素体外释放试验(T-N)0.0;EB病毒DNA实时荧光检测扩增阴性。2018年8月30日CMV抗体及DNA阴性。2019年10月29日抗CMV-IgM阳性,抗HSV-I IgM阳性,肺支抗体阳性。感染病原二代测序-外周血:检出溶血葡萄球菌、科氏葡萄球菌、HSV1、肺炎支原体。内分泌指标2018年3月16日甲状腺功能正常。
溶贫检测:2019年10月31日Coombs试验阴性,EPO 77.30 mIU/ml↑ (4.3~29 mIU/ml),结合珠蛋白206 mg/dl↑(36~195 mg/dl),血铁2.6 μmol/L↓(9.0~27.0 μmol/L),铁蛋白37.8 ng/ml(11.0~306.8 ng/ml),总铁结合力53.7 μmol/L(45.6~80.6 μmol/L)。
骨髓检查:2017年11月29日(外院)骨髓涂片:骨髓增生活跃,粒系增高占76%。细胞免疫分型:流式细胞术分析未见明显异常表型细胞群。骨髓活检:骨髓造血细胞增生尚可。造血组织与脂肪组织比例1∶1~1.5,粒红比约6∶1,以粒细胞为主(MPO+),巨核细胞2~4个/HPF,三系细胞形态未见明显异常。另见少量淋巴细胞散在及小灶性分布。网状纤维染色:网状纤维不增加(MF-0)。免疫组化:淋巴细胞CD20(+,少数),CD3(+,部分),CD5(+,部分),CD56(-),粒酶B(-),原位杂交EBER1/2(-)。2018年7月10日(外院)骨髓活检:镜下造血组织约占70%,三系可见,巨核细胞4~7个/HPF。免疫组化:CD3散在+,CD20散在+,CD61散在+,CD71少量+,MPO部分+,CD34-,CD117-,S100-,CD68散在+,骨髓造血组织增生活跃2019年10月30日(本院)骨髓涂片:骨髓增生活跃,粒红比正常。粒红巨三系增生活跃;成熟红细胞可见轻度缗钱状排列就血小板散在或成簇可见。髓片中可见少数淋巴细胞形态欠佳。流式免疫分型:未见异常细胞浸润。
影像学检查:2017年11月29日颈部淋巴结及甲状腺B超(外院):双侧颈部淋巴结肿大,结构异常(右侧较大约45 mm×16 mm,左侧较大约46 mm×25 mm)。甲状腺两侧叶结节;结节性甲状腺肿?2018年3月16日甲状腺B超(外院):甲状腺双侧叶多发低回声结节,TI-RADS3类,双侧颈部多发淋巴结肿大;2018年7月10颈胸腹盆CT(外院):1.双侧颈部Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ区多发肿大淋巴结;2.口咽部周围及鼻咽顶后壁软组织增厚,考虑淋巴结增生可能性大;3.右侧斜裂及水平裂胸膜增厚,请结合临床;4.胸腔积液;5.纵隔内多发淋巴结、部分增大,请结合病史;6双侧腹股沟多发小淋巴结。2018年8月29日颈胸腹盆CT(外院):与7月10日老片相比,双侧颈部多发肿大淋巴结,部分较前变小;纵隔内多发淋巴结部分增大,较前部分淋巴结略增大;口咽部周围及鼻咽顶后壁软组织增厚,大致同前;右侧胸腔积液,较前略增多;盆腔内软组织密度影较前稍缩小,双侧腹股沟区多发小淋巴结,大致同前;右侧较前增大;盆腔积液。2018年8月30日腹部超声(外院):脾大(厚约4.4 cm,长约12.3 cm)。2019年10月21日PET-CT(本院):1.鼻腔、鼻咽部黏膜增厚,代谢增高;双侧颌下、颈部、锁骨上、纵隔、右肺门多发淋巴结肿大伴代谢增高;骶骨、右侧髂骨溶骨性骨质破坏伴代谢增高,结合病史,考虑Rosai-Dorfman病相关性改变;2.脾肿大,代谢不高,建议结合临床;3.左侧腹股沟稍高代谢淋巴结显示。
活组织病理检查:2017年12月12日(外院):良性淋巴组织增生性病变,淋巴结窦组织细胞增生症(Rosai-Dorfman病)伴灶区IgG4阳性浆细胞数量增加。免疫组化:淋巴细胞CD20(+,部分),CD3(+,部分),Ki67(+,20%~30%),组织细胞CD163(+),CD68/PGM-1(+),S100(+)、CD1a(-),Langerin(-),浆细胞CD138(+),IgG4(+,灶区40-50个/HPF),Igλ(+,少数),Ig κ(+部分),EBER1/2(-)。2018年3月22日(外院):"左颈淋巴结活检标本"S100(+),CD68(+),CD1a(-),Ki67(5%~10%+),CD163(+),结合HE形态后左颈淋巴结病变考虑为Rosai-Dorfman病(窦组织细胞增生伴巨大淋巴结病)。2018年6月29日(外院):增生活跃的淋巴细胞、浆细胞及巨噬细胞,倾向Rosai-Dorfman病。免疫组化:CD30-,CD163+,CD68+,S100-,Ki6710%+。2019年9月27日(本院):"左颈部淋巴结穿刺活检标本"组织细胞增生性病变,结合免疫组化标记结果,符合Rosai-Dorfman病。免疫组化:组织细胞S-100(+),CD68(+),PGM-1(+),CD1α(-),Langerin(-);淋巴细胞CD20(滤泡区+),CD79α(滤泡区+),CD3(滤泡外区+),CD5(滤泡外区+),Bcl-2(生发中心-),Bcl-6(生发中心+),CD30(极个别+),Ki67(生发中心约70%+),ALK-1(-),CD10(-);浆细胞CD38(+),CD79α(+),κ(部分+),λ(部分+),κ与λ比值未提示轻链限制性,IgG(+),IgG4(散在少数+);CD21(FDC+);EBV原位杂交:EBER(-)(图1)。基因检测:KRAS、NRAS、PIK3CA、BRAF未检测到突变。
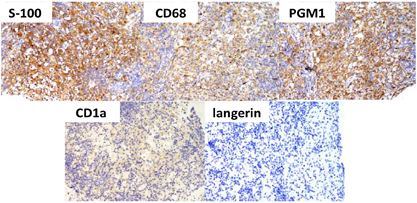

诊断:患者青年女性,以反复发热、淋巴结肿大为主要表现。影像学检查提示病灶范围包括双侧颌下、颈部、锁骨上、纵隔、右肺门多处淋巴结和鼻腔、鼻咽部黏膜及骶骨、右侧髂骨结外累及。淋巴结活检病理提示组织细胞增生性病变,结合免疫组化所示S-100+,CD68+,CD1a-表型,诊断为Rosai-Dorfman病。
鉴别诊断:(1)其他组织细胞疾病。临床上Rosai-Dorfman病需要与多种肿瘤相鉴别,包括淋巴瘤或癌性淋巴结转移。但是,组织学上唯一需要鉴别的是其他组织细胞增生症。Rosai-Dorfman病中泡沫组织细胞的稀缺可与Erdheim-Chester病相鉴别。淋巴细胞伸入现象的存在可区别于Erdheim-Chester病或"反应性"窦组织细胞增生。免疫组化分析可以将Rosai-Dorfman病与Langerhans细胞组织细胞增生症和Erdheim-Chester病明确区分。(2)感染相关疾病。对于耳、鼻、喉区的病灶,应该与鼻硬结病相区分,该病病程很长,可达20~30年,大多原发于鼻腔前部,少数原发于咽、喉、气管等处,可出现卡他症状、声嘶、呼吸困难等相应症状,需通过病理进行鉴别,同时应仔细检查Frisch杆菌的存在。对于黏膜区的病灶,需要与软斑病相区分,该病以慢性非特异性肉芽肿性炎为特点,常见的致病病原体包括大肠杆菌、结核杆菌、变形杆菌和金黄色葡萄球菌等。本例患者外周血中检出溶血葡萄球菌、科氏葡萄球菌、肺炎支原体、HSV1,以上病原体感染均可引起发热,但通常无淋巴结肿大表现。(3)IgG4相关性疾病。IgG4相关性疾病病理表现为IgG4+比例>40%,每高倍镜视野下IgG+浆细胞>100个。一些研究亦显示某些Rosai-Dorfman病与IgG4相关性疾病有关。从组织学上讲,这两类疾病都具有明显的纤维化表现,有时还有明显的浆细胞浸润,此外,在一些Rosai-Dorfman病变中发现了大量IgG4浆细胞,提出了这两个类别存在重叠综合征的可能。这些发现基本上都基于组织学分析,尚没有足够的临床数据支持。但是这两类疾病的鉴别很重要,对于IgG4相关性疾病,皮质类固醇治疗通常非常有效。本病例淋巴结组织无IgG4浸润,外周血IgG4轻度升高,不考虑该诊断。(4)继发于Rosai-Dorfman病的肿瘤在个别患者中发现,确诊Rosai-Dorfman病后可迅速发生淋巴瘤。这表明,与Castleman病一样,有部分Rosai-Dorfman病处于细胞恶性增生的危险中,特别是非霍奇金淋巴瘤的发生。因此在临床当出现这类异常情况时,尤其是病情明显恶化时,需要对病灶重新活检和病理分析。
患者通过淋巴结病理活检确诊Rosai-Dorfman病,累及鼻腔及骨骼,不伴KRAS、NRAS、PIK3CA或BRAF突变。患者曾行淋巴结清扫术,术后仍复发,且手术有损伤颈部神经及血管风险,术后水肿可能;曾多次依托泊苷联合甲泼尼龙方案治疗,但病情持续进展;故此次给予美罗华联合来那度胺方案治疗。
接受美罗华联合来那度胺治疗2隔疗程后,患者未再发热,B超提示颈部淋巴结较前缩小。随访至出院后4个多月,病情未再反复。
本例患者为青年女性,以反复发热、淋巴结肿大为主要表现,伴有盗汗、易疲劳,伴有鼻塞。通过淋巴结活检,病理提示组织细胞增生性病变,结合免疫组化所示S-100+,CD68+,CD1a-表型,外院诊断为Rosai-Dorfman病。患者曾接受淋巴结清扫术,术后复发,后接受多次依托泊苷联合甲泼尼龙方案治疗,疾病仍持续进展。本次发病,结合实验室检查、影像学检查、病理检查和二代测序等对病情进行全面评估,最终病理确诊Rosai-Dorfman病,累及鼻腔及骨骼,不伴KRAS、NRAS、PIK3CA或BRAF突变。
Rosai-Dorfman病的确诊需要通过病理学分析,具有特征性的Rosai-Dorfman细胞,形态一致,分化良好;核较大,空泡状,圆形或卵圆形;胞浆丰富淡红染,多数在胞浆中可见完好的淋巴细胞、浆细胞及中性粒细胞,称为淋巴细胞伸入现象[4]。Rosai-Dorfman细胞表达所有泛巨噬细胞标记(CD68,HAM56,CD14,CD64,CD15)以及与巨噬细胞功能相关的标记(CD64,FcgR)。Rosai-Dorfman病中S100的强表达使其区别于Erdheim-Chester病,而CD1a和Langerin表达的缺失将其与Langerhans细胞组织细胞增生症相区分[5]。
目前Rosai-Dorfman病的发病机制尚不明确。研究表明,不同于Langerhans细胞组织细胞增生症和Erdheim-Chester病,Rosai-Dorfman病例中未观察到复现的BRAF-V600E突变[6]。Diamond等通过全外显子组测序和(或)RNA测序对37例BRAF-V600E野生型的非朗格汉斯细胞组织细胞增生症的病例进行研究,证实了存在MAP2K1(32%),NRAS(16%),KRAS(11%),PIK3CA(8%)和ARAF(3%)的突变[6]。在所有类型的非Langerhans细胞组织细胞增生症中,包括8例Rosai-Dorfman病患者,其中多数涉及KRAS,NRAS或ARAF突变[6]。基于这些突变的发现,RAS/RAF/MAPK/ERK途径被进一步证实参与了部分Rosai-Dorfman病的发病过程。MAPK/ERK信号通路通过调节多种转录因子的活性,调控许多基本的细胞生物过程,包括增殖,分化,凋亡和存活。这些发现在Rosai-Dorfman病的诊断中具有重要价值,也使难治或侵袭性Rosai-Dorfman病患者有可能从靶向治疗中获益。
针对Rosai-Dorfman病尚无统一的治疗指南,提倡针对个体情况进行治疗。对于无并发症的淋巴结Rosai-Dorfman病、无症状的皮肤Rosai-Dorfman病以及不影响重要脏器功能或无明显症状的其他部位Rosai-Dorfman病,可采用观察随访的方案,其他患者应经过全面评估后选择相应的治疗方案[7]:单病灶Rosai-Dorfman病可采用外科手术治疗、放疗,多灶性Rosai-Dorfman病通常需联合全身治疗包括皮质类固醇、化疗、免疫调节治疗、mTOR抑制剂西罗莫司或靶向治疗[8]。
Rosai-Dorfman病的预后具有临床异质性,多灶性和结外性Rosai-Dorfman病,尤其是有肾、肝、肺累及的患者,常表现出不良预后。Pulsoni等总结分析了80例Rosai-Dorfman病患者的预后,其中10例(12%)死于Rosai-Dorfman病,在40例未接受化疗、放疗或外科手术的患者中34例(85%)获得疾病缓解,在9例接受外科手术的患者中8例(88.9%)获得完全缓解,21例接受放疗及化疗的患者疗效较差,而其他治疗方案的病例数相对较少[9]。Rosai-Dorfman病的病程可能较长,需要长期随访,密切监测病情变化,靶向药物和新型药物将可能使复发难治患者获益。
Rosai-Dorfman病是一种罕见的组织细胞增生性疾病,具有临床异质性,诊断和治疗较为困难。目前通过组织病理检查可对Rosai-Dorfman病进行诊断,但其分子生物学特征尚不明确,可能与KRAS,NRAS或ARAF突变有关,其发病机制仍需进一步研究。应对疾病进行全面评估后制定个体化治疗方案,并在随访过程中根据疗效评估及时调整治疗方案,靶向治疗和联合治疗的应用可能改善Rosai-Dorfman病患者的预后。
所有作者均声明本研究不存在利益冲突































