
患者,女性,34岁,确诊为低危慢性髓系白血病慢性期,治疗过程中对多种酪氨酸激酶抑制剂(TKI)耐药,出现ABL激酶区F317L、Y253H突变,用达沙替尼联合尼罗替尼治疗达到主要分子学反应(MMR),后疾病进展至急淋变,伴头颅硬膜下血肿、大脑镰疝、肺部感染、胸腔积液入院。
间歇性头痛伴恶心、呕吐。神志淡漠,对答迟缓,两肺呼吸音低,未闻及干湿罗音及胸膜摩擦音。肝脾肋下未及。轻度运动性失语,右侧肢体肌力4级,其余神经系统检查未见异常。
患者骨髓涂片、免疫分型、染色体、BCR-ABL基因定量和ABL突变结果明确诊断为慢性髓系白血病急淋变,ABL F317L、Y253H突变。头颅CT显示头颅硬膜下血肿,大脑镰疝,胸部CT示肺部感染,胸腔积液。
口服奥雷巴替尼40 mg qod联合COP方案化疗,甘油果糖、甘露醇进行降颅压脱水治疗,头孢他定治疗肺部感染。
慢性髓系白血病疾病已达最佳疗效(CHR,CCyR,MMR,未检测出突变)。头颅血肿完全吸收,肺部感染治愈,胸腔积液消失。
血液科 肿瘤科 药剂科 检验科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
慢性髓系白血病是起源于造血干细胞的一种髓系恶性增殖性疾病,9号和22号染色体易位形成BCR-ABL融合基因,导致产生具有高酪氨酸激酶活性的BCR-ABL融合蛋白,是慢性髓系白血病发生的分子基础[1]。酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)使大多数慢性髓系白血病患者获得长期生存[2,3,4],但仍有15-20%患者出现耐药,甚至发生疾病进展[5]。本文报道1例慢性髓系白血病低危患者在治疗中发生多种TKI耐药,进展至急变期,旨在提高医师对慢性髓系白血病诊疗的认识包括药物选择,规范监测,耐药和疾病进展的治疗策略。
患者,女性,34岁,因"间歇性头痛伴恶心、呕吐2周"于2022年3月1日入院。患者于2020年9月单位体检时发现白细胞升高,当时患者无明显不适症状。2020年9月8日复查血常规:白细胞计数101.4×109/L,血红蛋白107 g/L,PLT 427×109/L,体检脾肋下未及。外周血涂片示原粒细胞1%,早幼粒细胞1%,中幼粒细胞12%,晚幼粒细胞6%,嗜碱性粒细胞3%,嗜酸性粒细胞1%。外周血BCR-ABL:ABL1为290%,给予羟基脲2#,tid po;碳酸氢钠2# tid po。2020年9月21日骨髓涂片示慢性髓系白血病慢性期,ph+细胞100%,外周血BCR-ABL:ABL1为203%,未发现ABL激酶区突变。确诊为慢性髓系白血病慢性期,SOKAL低危,ELTS低危,Hasford低危。2020年10月6日起口服伊马替尼400 mg qd,期间出现不良反应包括头痛、恶心、呕吐伴颜面部水肿,肌肉和骨骼疼痛,均为Ⅰ~Ⅱ级。伊马替尼治疗3个月复查血常规达完全血液学缓解,骨髓染色体分析示45, XX,-20,Ph[1]/46XX[19],达部分细胞遗传学缓解(partial cytogenetic response, PCyR),BCR-ABL::ABL1IS 22.75%,出现ABL Y253H突变,二代测序(Next generation sequencing,NGS)未发现其他突变,提示伊马替尼耐药。2021年1月13日起转换达沙替尼100mg qd po。达沙替尼治疗3个月复查血常规达完全血液学缓解,达完全细胞遗传学缓解(complete cytogenetic response,CCyR),BCR-ABL::ABL1IS9.816%,出现ABL F317L突变,NGS未发现其他突变,外周血BCR-ABL::ABL1IS1.4% ,提示达沙替尼耐药。2021年4月27日起转换尼罗替尼400 mg q12 h po。尼罗替尼治疗3个月复查达完全血液学缓解,骨髓染色体分析示45-46,XX,ph[2] /46xx[18],失去CCyR,BCR-ABL::ABL1IS45%,又出现ABL Y253H突变,NGS未发现其他突变,外周血BCR-ABL::ABL1IS 22%,提示尼罗替尼耐药。至此,建议患者HLA配型。患者在服用三种TKI期间均无减量和停药的情况。2021年8月3日起予以口服尼罗替尼400 mg q12 h,联合口服达沙替尼60 mg qd,期间曾出现皮疹,不良反应Ⅱ级,经对症处理后好转,未中断治疗。联合治疗3个月复查达完全血液学缓解,CCyR,ABL未发现突变,NGS未发现其他突变,外周血BCR-ABL::ABL1IS0.028%,达到主要分子学反应(major molecular response,MMR)。2022年2月9日复查血常规示白细胞计数7.54×109/L,血红蛋白110 g/L,PLT 484×109/L,失去完全血液学缓解。外周血BCR-ABL::ABL1IS8.2%,失去MMR。立即预约骨髓检查。2022年2月14日开始出现头晕,渐进性加重伴恶心、呕吐,2022年2月25日骨髓穿刺检查结果示慢性髓系白血病急变,急淋变,原淋+幼淋60%,流式细胞仪检测示common B急淋变伴髓系表达,LAIP特征为CD13+,CD33+,CD123p+,CD38p+,CD34+,CD10+,CD20-,CD19+,CD45dim。染色体分析示46,XX,ph[20],ph+100%,ABL F317L、Y253H突变又重新出现,NGS未发现其他突变。2022年2月28日出现精神萎靡,不能行走,门诊血常规示白细胞计数109.56×109/L,血红蛋白107 g/L,PLT 152×109/L,原始细胞71%,先给予口服羟基脲2粒tid,急诊留院观察。于2022年3月1日收住入院。既往身体健康,无不良嗜好。否认其他疾病史、否认家族遗传学病史及冶游史、手术史和药物过敏史。体格检查:平卧推入病房,神志淡漠,对答迟缓。全身皮肤黏膜无明显出血点,浅表淋巴结未及肿大。颈软,眼球运动不受限,双侧瞳孔等大等圆,对光反应灵敏。双眼闭合好,双侧鼻唇沟对称,口角无歪斜,伸舌居中。两肺呼吸音低,未闻及干湿啰音及胸膜摩擦音。心率102次/min,心律齐,各瓣膜听诊区未闻病理性杂音,无胸骨压痛。腹部平软、无压痛,肝脾肋下未及。轻度运动性失语,右侧肢体肌力4级,肌张力正常,左侧肢体肌力、肌张力正常,双侧肢体均无感觉障碍及水肿。双侧病理征均为阴性。
1.血常规(图1)。
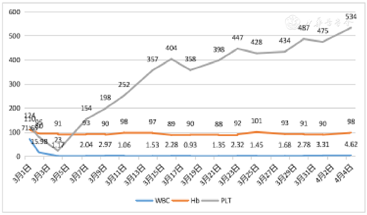

2.骨髓检查结果和外周血BCR-ABL定量结果见文中描述。
3.影像学结果:(1)头颅CT结果(图2)。(2)胸部CT结果(图3)。(3)心电图和心超未见明显异常。
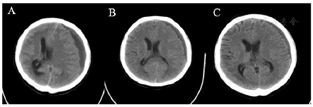

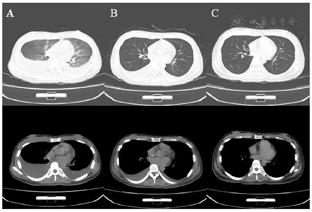

4.其他检查:肝肾功能无异常,Fg 1.8g/L,其他出凝血指标在正常范围。
根据指南[2,3],患者初发时确诊为慢性髓系白血病慢性期,治疗过程中出现伊马替尼耐药,达沙替尼耐药,尼罗替尼耐药。入院时慢性髓系白血病急淋变合并头颅硬膜下血肿、大脑镰疝、肺部感染、胸腔积液。
入院后给予对症支持治疗,交替使用甘油果糖、甘露醇进行降颅压脱水治疗,头孢他定治疗肺部感染,口服奥雷巴替尼40 mg qod联合COP方案(CTX 1 150 mg d1,VDS 4 mg qw×4,地塞米松10 mg qd)化疗。
患者治疗后症状明显缓解。治疗2周后骨髓示:慢性髓系白血病-完全缓解,MRD 0.14%。治疗过程中血液学不良反应包括白细胞减少和ANC减少,为不良反应Ⅳ级,贫血不良反应Ⅰ级,血小板减少不良反应Ⅳ级,给予输注单采血小板。非血液学不良反应包括心动过速、皮肤色素沉着、低钾血症、r-GT升高、甘油三酯升高、蛋白尿,均为不良反应Ⅰ级。治疗期间奥雷巴替尼无减量。治疗1个月头颅血肿明显吸收,肺部感染痊愈,胸腔积液明显吸收。2022年5月17日外周血BCR-ABL::ABL1IS0.0078%。头颅CT无异常。2022年6月8日骨髓涂片示慢性髓系白血病-完全缓解,染色体为46XX[20],达CCyR,BCR-ABL::ABL1IS0.063%,达MMR,患者继续口服奥雷巴替尼40 mg qod,并准备造血干细胞移植。
TKI的出现极大地改善了慢性髓系白血病患者的预后。与既往传统治疗相比,一代TKI伊马替尼治疗慢性髓系白血病慢性期的总体生存达85%~90%[6]。与伊马替尼相比,二代TKI尼罗替尼,达沙替尼,氟马替尼一线治疗慢性髓系白血病慢性期能使慢性髓系白血病患者获得更快、更深的疗效[7,8,9]。目前中国能获得的四种一线治疗慢性髓系白血病的TKI各有其不同的不良反应特点[6,7,8,9]。TKI的有效治疗使一部分获得深层次分子学反应的慢性髓系白血病患者能够成功追求无治疗缓解。因此慢性髓系白血病确诊后的一线药物选择需根据患者的治疗目标、疾病分期、合并症和合并用药、药物服用的便捷、药物的费用、药物的可及性等多方面综合考虑。该患者为年轻女性,治疗应以无治疗缓解为目标,因其考虑经济较多,选用伊马替尼400 mg qd作为一线治疗,患者在伊马替尼治疗3个月后出现了Y253H突变,根据体外TKI对突变的作用,Y253H突变可能对达沙替尼治疗更敏感[2,3,4]。因此患者转换达沙替尼治疗,在达沙替尼治疗3个月后复查,未检测到Y253H突变,但出现了新的F317L突变,该突变对尼罗替尼敏感[2,3,4],对达沙替尼耐药。因此患者转换了尼罗替尼治疗。在尼罗替尼治疗3个月后,未检测到F317L突变,但Y253H突变又重新出现。ABL激酶区突变是TKI的主要耐药机制之一,约50%的TKI耐药患者发生激酶区突变,突变阻碍TKI与ATP位点的结合从而影响疗效[10]。该患者治疗结果显示,其存在2种突变,这2种突变均表现为对一种TKI敏感,但对另一种TKI却耐药。患者表现为多种TKI耐药,建议HLA配型为造血干细胞移植作准备。当时国内无其他可供选择的有效药物和临床研究,有文献报道两种靶向药物的联合可能会提高疗效[11],因此给予尼罗替尼和达沙替尼联合治疗。考虑到2种TKI联合可能出现不良反应的叠加,且尽管出现新的突变,患者在接受达沙替尼治疗时细胞遗传学疗效优于尼罗替尼,因此选择标准剂量的尼罗替尼联合减低剂量的达沙替尼,既保证了疗效,又减少了可能出现的不良反应。患者在接受两药联用后3个月达到MMR,Y253H和F317L突变均未检测出。然而,最佳疗效维持不足3个月,患者即发生疾病进展至急变期,发生了急淋变。据文献报道TKI一线治疗失败后,随着药物治疗线数的提高,疗效更差[12]。根据指南[2,3,4],对在接受TKI治疗过程中发生急变患者的治疗方案需转换TKI并联合化疗,当时正好国内奥雷巴替尼上市,奥雷巴替尼是三代TKI,其作用机制与一二代TKI相似,仍为ABL激酶区ATP结合位点的竞争性抑制。已有报道显示[13],奥雷巴替尼能有效治疗既往TKI耐药的慢性髓系白血病患者,尤其是伴有T315I突变的患者,因此患者转换奥雷巴替尼治疗,并联合化疗。因患者当时出现头颅血肿,中线移位,病情危重,因此选择温和的COP方案,并加强支持对症治疗。患者最终达到了完全缓解,复查达到了MMR。后续需进行造血干细胞移植[2,3,4]。从该病例也体现了慢性髓系白血病治疗过程中规范监测的重要性。根据指南推荐[2,3,4],在接受TKI治疗后每3个月需评估血液学,细胞遗传学和分子学疗效。该患者正是在这样的规范监测下,及时发现了药物耐药,进行了药物转换,并及时发现了疾病进展,及时治疗,挽救了生命。目前对慢性髓系白血病患者的预后评分系统包括SOKAL,Hasford和ELTS等,通常低危患者显示出对TKI治疗更好的疗效和更低的疾病进展的可能[1]。但该患者在规范服药的情况下却表现出多种TKI耐药,甚至疾病进展,较为少见,提示对慢性髓系白血病预后的精准评估可能需要纳入更多的预后因素。
所有作者均声明本研究不存在利益冲突



























