
患者,女性,14岁,因"发作性症状13年"入院。患者长期服用多种抗癫痫药物治疗,服药依从性差,症状控制欠佳,为行癫痫术前评估入院。患者出生后即存在右侧面部大片状葡萄酒色斑,在校学习成绩稍差,无癫痫、类似皮损家族史。
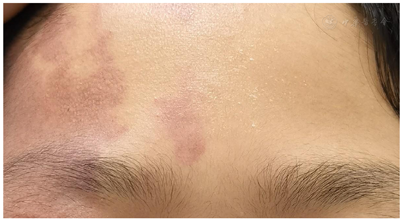
主要发作形式为局灶性起病知觉保留的肌阵挛发作,以及局灶性知觉保留感觉症状起病进展为双侧强直-阵挛发作。体格检查:简易精神状态量表25分;右侧额部、面颊、口周可见片状葡萄酒色斑,边界清,压之不褪色;粗测双眼左侧视野缺损。
患者完善长程视频脑电监测、头计算机断层显像、头增强磁共振成像、头正电子发射断层显像/计算机断层显像,并完善多学科会诊,考虑Sturge-Weber综合征诊断明确,并完善血代谢性及免疫性病因筛查除外其他疾病可能。在常规影像学检查的基础上补充了磁共振增强液体衰减反转恢复(CE-FLAIR)序列后,患者柔脑膜受累的范围得到了清晰的显示。
基于影像所见患者柔脑膜受累范围广,提示手术风险极高,同时发作频率较低,既往未规律、足疗程抗癫痫治疗,多学科会诊考虑暂不适合手术治疗。遂予患者口服拉考沙胺治疗,根据患者发作情况调整药物剂量,并提高患者用药依从性,患者发作频率明显降低。
出院3个月后随访,患者近1个月未再出现全面性发作,仅偶有四肢肌阵挛样抖动。
神经科;影像科;神经外科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
Sturge-Weber综合征(Sturge-Weber syndrome,SWS)又称脑面血管瘤病,发病率约为1/20 000新生儿,特征为三叉神经眼支分布区的葡萄酒色斑和同侧柔脑膜的静脉-毛细血管畸形[1]。超过25%的SWS患者存在药物难治性癫痫,需要考虑接受手术治疗[2]。明确患者柔脑膜受累的侧别和程度至关重要,因为不同的受累范围需要不同的手术方案[1]。磁共振成像(magnetic resonance imaging,MRI)增强液体衰减反转恢复(contrast-enhanced fluid-attenuated inversion recovery,CE-FLAIR)序列在显示柔脑膜病变方面比传统的增强T1(contrast-enhanced T1,CE-T1)序列更有优势,可能反映SWS患者真正的脑膜强化[3]。然而,相关的病例报道仍然罕见。现将为行癫痫术前评估入我院的1例典型SWS患者报道如下,并介绍在本例中CE-FLAIR序列如何帮助治疗决策。
患者,女性,14岁,因"发作性症状13年"于2021年收入我院神经科病房。患者1岁2个月时无明显诱因出现全身肌阵挛样抖动,双肩为著,数秒缓解,此后上述症状间断出现,性质及持续时间同前,平均3~5次/d。1岁3个月时出现意识丧失、倒地、四肢抽搐,表现为上肢屈曲、下肢伸直,伴口唇紫绀、口咽分泌物多,持续1 min左右自行缓解,发作后意识模糊持续约10~20 min。此后间断出现发作性意识丧失伴四肢抽搐,性质同前,平均4~5次/月。外院予口服奥卡西平、丙戊酸钠治疗(剂量不详),未规律服药,1年约出现5~6次全面性发作,偶有肌阵挛样发作。患者发作性症状出现时均不伴发热。2018年后患者家属自行停用抗癫痫药物。2019年于我院门诊就诊,头MRI平扫及磁敏感加权成像(susceptibility weighted imaging,SWI)示右侧大脑半球体积小,右侧颞顶枕叶皮层钙化可能大;视频脑电图示发作间期轻度不正常脑电图,右额中线可见棘慢波,余不详。先后予口服左乙拉西坦500 mg、2次/d及托吡酯50 mg、2次/d治疗,症状无明显缓解。后患者家属自行将抗癫痫药改为口服奥卡西平0.45 g、2次/d及丙戊酸钠0.75 g、2次/d,患者仍间断有发作性意识丧失伴四肢抽搐,平均3次/月。2020年初我院门诊加用口服拉考沙胺100 mg、2次/d,上述发作频率降低为1次/月左右。患者家属从2020年中旬起自行停服所有抗癫痫药物。2021年于我院门诊复诊,考虑"症状性癫痫",予恢复口服拉考沙胺100 mg、2次/d,此后患者平均每个月3~4次肌阵挛样抖动,每个月1~2次全面性发作,全面性发作前偶可有视物大小变化先兆。患者症状控制欠佳,遂为行癫痫术前评估入院。
既往史及其他病史:第2胎,足月顺产。患者出生后可见右侧面部大片状葡萄酒色斑。否认宫内窘迫、产伤、窒息、缺氧等病史,否认热性惊厥史。5月龄可独坐,13月龄可行走,运动发育与同龄儿相仿;在校学习成绩较平均水平稍差,否认反应迟钝、记忆力下降等。患者家属否认三代以内直系亲属及其他亲属存在癫痫或类似皮损病史。
入院后体格检查:生命体征正常,心、肺及腹部体格检查未见异常。简易精神状态量表(mini-mental state examination,MMSE)25分;右侧额部、面颊、口周可见片状葡萄酒色斑,边界清,压之不褪色(图1);粗测双眼左侧视野缺损;余神经系统体格检查未见异常。

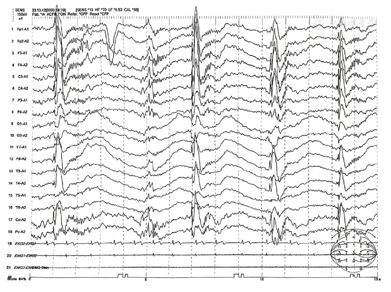
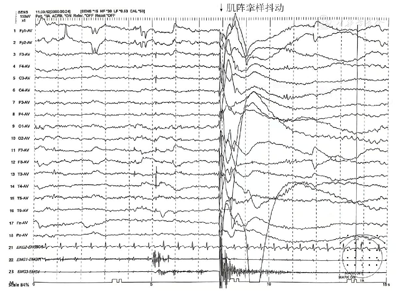
血常规、肝肾功能等未见异常。血清铜蓝蛋白、血氨、乳酸、抗核抗体谱、抗中性粒细胞胞浆抗体谱、抗神经抗原抗体等代谢性及自身免疫性疾病筛查均未见明显异常。长程视频脑电监测(video electroencephalogram,VEEG):异常青少年期脑电图,发作间期脑电图示睡眠期双侧前部导联棘-慢复合波,右侧半球为著(图2);监测到电临床发作2次,表现为四肢肌阵挛样抖动伴头左偏,持续时间2 s,同步脑电图见右侧半球前部导联为著棘-慢复合波,肌电记录见同步簇样肌电(图3)。


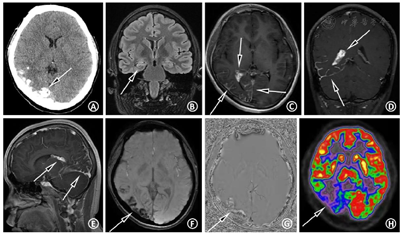
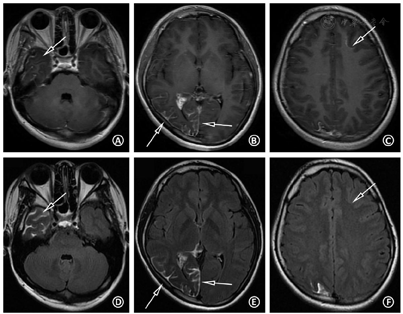
头计算机断层显像(computed tomography,CT)平扫:右侧颅腔、大脑半球较对侧略小,右侧枕颞叶多发斑片状钙化(图4A)。海马常规MRI:右侧海马硬化(图4B)。头颅磁共振静脉血管成像(magnetic resonance venography,MRV):未见明显异常。头增强MRI+SWI:右侧大脑半球体积小,CE-T1序列示右侧颞顶枕叶柔脑膜强化,右侧脉络丛较左侧增大、强化(图4C,图4D,图4E),SWI序列示右侧枕颞叶多发不均匀低信号影,相位图上呈高信号,符合钙化特点(图4F,图4G)。头正电子发射断层显像(positron emission tomography,PET)/CT:右侧颞顶枕叶体积小,脑实质萎缩,代谢减低或缺损,考虑致痫灶定位于右侧半球(图4H)。值得注意的是,CE-T1序列所示右侧颞极(图5A箭头)及左侧额叶高信号(图5C箭头)是否为异常柔脑膜强化不肯定,然而头CE-FLAIR序列可清晰显示右侧颞极存在柔脑膜强化(图5D),并除外左侧额叶的柔脑膜受累(图5F),提示患者的脑膜受累范围为单侧颞顶枕叶广泛受累。结合CE-T1、CE-FLAIR,以及SWI序列(未展示该层面SWI图像),考虑左侧额叶高信号(图5C箭头)为发育性静脉畸形可能。眼科视野检查示双眼左侧视野缺损。皮肤科会诊考虑右侧面部鲜红斑痣临床诊断明确,符合SWS皮肤表现。


患者主要表现为发作性肌阵挛样抖动;或意识丧失伴四肢抽搐,后者可在发作前有视觉先兆,表现为"视物大小变化"。上述症状有刻板性、短暂性、重复性的特点,抗癫痫药物可部分减少发作,考虑为痫性发作。癫痫类型方面,根据2017年国际抗癫痫联盟(International League Against Epilepsy,ILAE)癫痫发作分类标准[4],结合患者上述癫痫发作形式、发作期及发作间期VEEG,以及头部影像学,考虑癫痫类型为局灶性起病知觉保留的肌阵挛发作,以及局灶性知觉保留感觉症状起病进展为双侧强直-阵挛发作。病因方面,本例患者有典型自幼出现的面部葡萄酒色斑,合并症状性癫痫,头CT及MRI示脑萎缩、钙化和脑膜血管瘤表现,经我院神经科、神经外科、核医学科、放射科多学科会诊,考虑患者SWS诊断明确。共患病方面,本例患者可合并性格和认知功能异常等,患者在校成绩较平均水平差,提示可能有学习障碍,但由于患者未能配合完成更精细的评估量表,目前尚不完全明确。
(1)脑血管畸形:包括海绵状血管瘤、动静脉畸形等,可因缺血、出血或压迫形成致痫灶,缺血可导致脑内多发钙化灶表现,需鉴别。但本例患者合并面部葡萄酒色斑,且头MRI及SWI等影像学检查均未见脑血管畸形征象,不支持。
(2)遗传代谢病:临床表现常为癫痫发作、精神运动发育迟滞等,患者幼儿期起病,有上述表现,需鉴别。但患者遗传代谢病不能解释患者面部葡萄酒色斑及头MRI改变,且患者入院后代谢性疾病筛查均未见异常,不支持。
(3)感染性疾病:患者病程长,需要鉴别结核、隐球菌等易导致慢性感染的病原体感染,但患者家属否认患者病程中发热、头痛等表现,且感染亦无法解释面部葡萄酒色斑及头MRI改变,不支持。
我院多学科会诊意见:结合患者头CE-T1、CE-FLAIR序列及头PET/CT影像,患者右侧颞枕叶存在广泛异常强化伴代谢减低,左侧大脑半球未见受累。若患者优势半球位于左侧,则病灶侧为非优势半球,必要时可考虑病灶侧脑叶离断术治疗。由于患者已存在视野缺损,手术对患者目前视野影响较小。但患者单侧柔脑膜受累范围广,目前发作频率较低,且未规律、足疗程抗癫痫治疗,考虑手术风险较高、获益较小,建议先调整药物治疗。与患者家属商议后,患者家属选择暂继续药物治疗。嘱患者继续口服拉考沙胺100 mg、2次/d,逐渐加量为150 mg、2次/d,勿自行调整药物剂量,关注病情变化。经上述诊疗后,患者病情平稳出院。
出院后3个月随访,患者近1个月未再出现全面性发作,仅偶有四肢肌阵挛样抖动。
增强MRI是显示SWS患者柔脑膜血管瘤范围的最佳影像学方法,增强MRI联合SWI能较全面地显示SWS患者的脑部异常。SWS患者的头MRI影像主要有如下特点:①沿脑回表面的柔脑膜强化;②患侧脉络丛增大、强化;③髓质静脉、室管膜下静脉增粗;④患侧顶、枕叶钙化;⑤同侧大脑半球萎缩[5]。一般认为,SWS的血管改变是原始脉管丛在发育的前3个月中静脉引流的早期胚胎发育失败所致,此种异常导致脑血流量降低、血流淤滞及进行性缺血改变,从而导致脑钙化及脑萎缩的异常现象[6]。
2021年SWS诊治的共识声明推荐使用增强MRI评估新发或症状进展的SWS患者,并提及了CE-FLAIR序列在个别患者中的应用[7]。目前,CE-FLAIR序列在SWS中的应用仅见于少数研究[8,9],并且详细描述CE-FLAIR序列协助进行规范癫痫术前评估的个案尚罕见报道。CE-FLAIR序列对于检出脑膜或脑沟等表浅部位的感染、炎症,以及肿瘤转移是高度有效的,因为CE-FLAIR序列上正常血管及脑膜基本无强化[10]。并且,Goo等[11]认为,CE-FLAIR序列尤其适合显示SWS的柔脑膜血管瘤病,因为柔脑膜血管瘤病中病变处的血流速度较慢。的确,Fukuoka等[12]的体外实验表明,与CE-T1序列相比,CE-FLAIR序列对低造影剂浓度及慢血流速度更敏感。SWS中柔脑膜血管瘤的形成导致静脉血淤积、流速减慢,故CE-FLAIR序列能较清晰地显示此类病变,并排除CE-T1序列中正常血管及脑膜强化的干扰。
此外,对于行癫痫术前评估的SWS患者,明确患侧脑部具体的病变范围,以及除外看似正常的"健侧"脑部的轻微受累,对制定后续治疗方案是不可或缺的。Griffiths等[8]报道了1例疑似左侧SWS的患儿,CE-T1序列仅提示左侧大脑半球异常强化,但CE-FLAIR序列显示对侧柔脑膜亦存在病变,双侧受累排除了手术的可能。对于本例患者,CE-FLAIR序列清晰地显示了右侧颞极等处在CE-T1序列上显示欠清的病变,同时除外了左侧大脑半球受累,从而精确地显示了患者病变的范围。如果仅根据患者CE-T1序列的图像,则可能误认为本例患者右侧脑叶受累范围较小,从而可能作出推荐患者手术治疗的决策,增大患者治疗的风险。
综上所述,对于SWS等脑膜受累的疾病,特别是拟行癫痫术前评估者,在CE-T1序列的基础上补充CE-FLAIR序列,对清晰、精确地显示病变的侧别、范围而言可能是至关重要的。磁共振CE-FLAIR序列在类似的临床情境下可能需要得到更广泛的应用。
所有作者均声明本研究不存在利益冲突































