
患者,男性,56岁。因"左额顶脑膜瘤切除术后8个月余"为主诉就诊。1年余前患者因"右手乏力、言语欠流利"为主诉就诊,完善相关检查,诊断为"左侧额顶脑膜瘤",于2021年2月12日在全麻下行"左额顶脑膜瘤切除术",2021年10月复查CT示右肺下叶见直径约1.5 cm结节影,遂入院进一步检查。
头颅压痛,头颅顶可见术后瘢痕,愈合可,后颈可见一长约10 cm术后愈合瘢痕。
2021年10月10日复查CT示右肺下叶可见结节影,直径约1.5 cm,增强扫描轻度强化;前上纵膈可见类圆形软组织密度影,边界清楚,大小约4.4 cm×3.3 cm,增强扫描轻度强化。2021年10月13日MRI示:多发胸椎椎体及附件、所扫及L1椎体异常信号,结合病史,考虑为转移瘤可能;于2021年10月11日在局部浸润麻醉下行CT引导下经皮纵膈占位穿刺活检术。术后病理诊断为转移性间变性脑膜瘤,免疫组化结果示:EMA(弱+),PR(散在+),SSTR2(+),P53(约70%+),Ki67(60%+)。NGS检测结果示NF2基因突变,IFNG融合基因,KEAP1融合基因,MDM2基因突变。
于2021年10月21日、2021年12月1日、2022年1月12日给予"依托泊苷+顺铂+异环磷酰胺"方案化疗;于2021年10月13日至2021年10月27日给予椎体放疗;于2021年11月10日、2021年12月22日、2022年2月4日给予"依托泊苷+顺铂+表柔比星"方案化疗;于2022年3月2日给予"依托泊苷+顺铂"方案化疗,定期给予"地舒单抗"抗骨转移;于2022年3月15日给予"安罗替尼"靶向治疗;于2022年3月30日给予"肺、纵膈、头颅质子放疗";于2022年7月5日、2022年7月26日、2022年8月16日给予"度伐利尤单抗+安罗替尼"治疗。
术后患者言语及肌力均较前恢复。2022年9月6日复查CT及MRI提示颅内病灶稳定,肺部多发结节较前增大,同时双肺炎症考虑间质性肺炎。于2022年9月8日给予"贝伐珠单抗+依维莫司"方案化疗,同时规律给予地舒单抗至今。
病理科;神经外科;肿瘤科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
脑膜瘤是最常见的中枢神经系统肿瘤之一,起源于蛛网膜颗粒细胞,该病的患病率约占所有颅脑肿瘤的37%[1];根据第5版世界卫生组织中枢神经系统肿瘤分类指南(WHO CNS5),将脑膜瘤大致分为3类,分别为WHOⅠ级、WHOⅡ级和WHOⅢ级[2]。根据组织病理学特性,这3类脑膜瘤又被分为15种不同的细胞亚型[3]。多数为良性的WHOⅠ级肿瘤,生长速度较为缓慢,少数为WHOⅡ~Ⅲ级肿瘤。不同分型之间治疗方法及预后不同,后者术后复发率及病死率较高,且对周围组织有明显的侵袭性[4]。神经纤维瘤病Ⅱ型(neurofibromatosis type 2,NF2)基因位于22号染色体长臂上,编码Merlin蛋白,50%~60%的脑膜瘤中存在NF2的缺失或突变[5],其难以通过单纯手术彻底治愈,目前的相关研究较少,本文报道1例伴NF2突变等多基因变异的间变性脑膜瘤并肺转移1例,并结合相关文献进行相关临床病理及分子遗传学特征分析,旨在提高对该病的认识。
1年余前患者因"右手乏力、言语欠流利"为主诉就诊我院,完善相关检查,诊断为"左侧额顶脑膜瘤",于2021年2月12日在全麻下行"左额顶脑膜瘤切除术",术后病理结果示:符合间变性脑膜瘤,WHO Ⅲ级;侵犯骨组织及纤维脂肪组织。
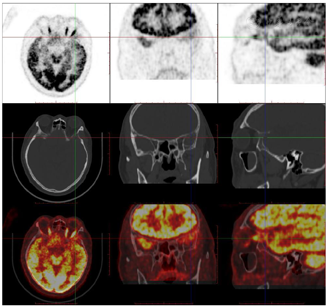
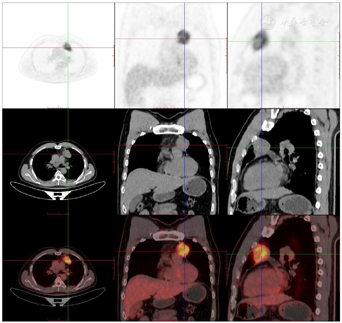
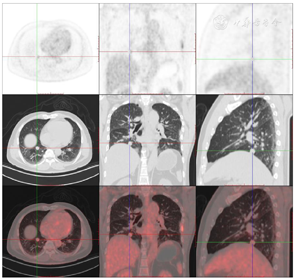
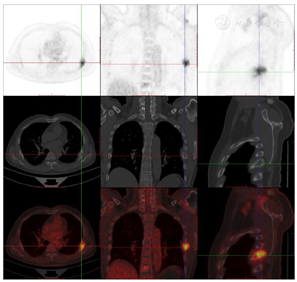
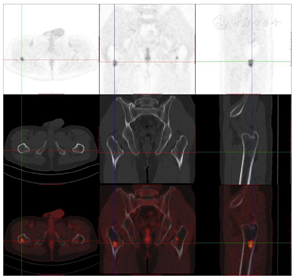
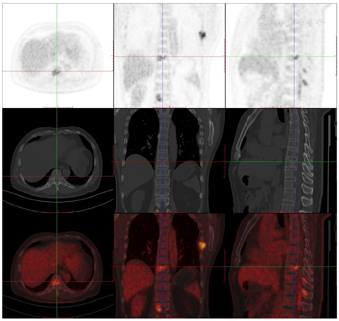
头颅顶可见术后瘢痕,愈合可,后颈可见一长约10 cm术后愈合瘢痕。头颅压痛、包块。发病来,患者神志清,精神可,睡眠可,饮食及大小便正常,体重无明显变化。2021年10月8日行PET-CT示左侧额顶部颅骨术后改变;左侧颞极片状高密度影并邻近骨质破坏,代谢增高(图A);左前纵膈肿块,代谢增高(图B);双肺散在结节,代谢轻度增高(图C);右侧锁骨、左侧第6肋,胸9-腰1、3椎体及其附件骨、双侧髂骨及双侧股骨近端多发混合型骨质破坏,代谢不同程度增高,考虑多发转移瘤(图D,图E,图F);2021年10月10日复查CT示右肺下叶可见结节影,直径约1.5 cm,增强扫描轻度强化;前上纵膈可见类圆形软组织密度影,边界清楚,大小约4.4 cm×3.3 cm,增强扫描轻度强化。于2021年10月11日在局部浸润麻醉下行CT引导下经皮纵膈占位穿刺活检术。病理结果示:肺穿刺组织内见恶性肿瘤,符合转移性间变性脑膜瘤。2021年10月13日MRI示:多发胸椎椎体及附件、所扫及L1椎体异常信号,结合病史,考虑为转移瘤可能。






诊断:伴NF2突变的间变性脑膜瘤并肺转移。
诊断依据:1)左侧额顶叶肿瘤显微镜下示:肿瘤细胞密集,由非典型脑膜瘤形态构成,部分瘤细胞异型性明显,核着色较深,核仁明显,核分裂象易见,间质少,病灶片状坏死(图①、②);免疫组化结果显示:EMA(-),PR(-),D2-40(+),SSTR2(少量+),CD34(-),Ki67(60%+),S-100(-),SOX-10(-)。
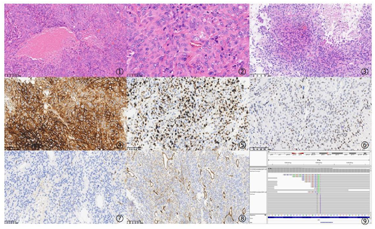

2)肺穿刺病理结合形态、免疫组化、影像学及病史符合转移性间变性脑膜瘤(图③)。免疫组化结果:EMA(少量+),D2-40(+),PR(个别+),SSTR2(+),CD34(-),TTF-1(-),Ki67(60%+),P53(25%中等+),CK(AE1/AE3)(-),LCA(-),SOX-10(-), GFAP(-)(图④-⑧)。
3)NGS检测结果示:NF2基因p.T23lfs*27第1外显子移码突变(图⑨);IFNG融合基因;KEAP1融合基因;MDM2基因p.E236K第9外显子错义突变。
鉴别诊断:间变型脑膜瘤需与转移癌、恶性黑色素瘤等鉴别。
排除禁忌后,于2021年10月21日、2021年12月1日、2022年1月12日给予"依托泊苷+顺铂+异环磷酰胺"方案化疗,于2021年10月13日至2021年10月27日给予椎体放疗,于2021年11月10日、2021年12月22日、2022年2月4日给予"依托泊苷+顺铂+表柔比星"方案化疗,过程顺利。于2022年3月2日给予"依托泊苷+顺铂"方案化疗,定期给予"地舒单抗"抗骨转移,耐受可。于2022年3月15日给予"安罗替尼"靶向治疗。于2022年3月30日给予"肺、纵膈、头颅质子放疗",过程顺利。于2022年7月5日、2022年7月26日、2022年8月16日给予"度伐利尤单抗+安罗替尼"治疗。
术后患者言语及肌力均较前恢复,目前一般情况尚可。2022年9月6日复查CT及MRI提示颅内病灶稳定,肺部多发结节较前增大,同时双肺炎症考虑间质性肺炎。排除禁忌,于2022年9月8给予"贝伐珠单抗+依维莫司"方案化疗,同时规律给予地舒单抗。2022年9月29日给予"贝伐珠单抗+依维莫司"治疗至今。
2型神经纤维瘤病(neuro fibromatosis type 2,NF2)基因是一种抑癌基因,该基因定位于染色体22q12.2,编码一种由595个氨基酸所组成的蛋白质一Merlin蛋白。Merlin是一种多功能的抑癌蛋白,能与PIKE、eIF3c发生相互作用,影响细胞周期蛋白D1(cyclin D1)的表达和细胞增殖,介导接触依赖性增殖抑制,当NF2基因突变时,会使编码的Merlin蛋白丢失,导致2型神经纤维瘤病以及散发性脑膜瘤的发生。NF2脑膜瘤的好发部位为大脑镰中后部、矢状窦旁和脑表面,位于颅底的NF2脑膜瘤较少见;散发脑膜瘤则更常见于矢状窦旁、大脑凸面、蝶骨嵴和鞍区等位置[6,7]。另外,Clark等[8]进一步证实非NF2基因突变型脑膜瘤几乎都为良性(Ⅰ级),且染色体稳定性高,好发于颅底内侧面。而NF2基因突变和/或22号染色体缺失的脑膜瘤更有可能是非典型脑膜瘤(Ⅱ)级,且染色体稳定性差。国内外多位学者指出WHOⅡ~Ⅲ级脑膜瘤的侵袭性明显较WHOⅠ级脑膜瘤强,且具有局部浸润性、非典型的组织学表型及复发性高等特点。潜在的预后因素包括手术切除程度、是否接受一般放疗或立体定向放疗、Ki67/MIB-1标记指数、P53过表达及众多的基因表达谱。近来,越来越多的预后因素和信号转导通路中的分子标志物被广泛研究[9]。
本例患者NGS检测到除了NF2基因p.T23lfs*27第1外显子移码突变,还发现IFNG融合基因、KEAP1融合基因,MDM2基因p.E236K第9外显子错义突变。其中IFNG融合基因,由IFNG下游基因间隔区和MDM2基因5’UTR重排组成。IFNG是γ干扰素的编码基因,具有重要的免疫调节功能,表现为当病原体入侵宿主时,IFNG激活巨噬细胞使之杀灭病原体,形成免疫应答的第一道防线[10]。该基因的突变与病毒、细菌、寄生虫感染和几种自身免疫性疾病的易感性增加有关。另外检测到KEAP1融合基因,由MAP7下游基因间隔区和KEAP1基因第2外显子重排组成。Keap1-Nrf2-ARE信号通路是对氧化应激及外来化学物质损害的主要保护通路,主要包括细胞核转录因子(Nrf2)、Kelch样ECH相关蛋白-1(Keap1)和ARE(antioxidant response element)分子。Nrf2正常情况下与Keap1结合在一起,受到刺激时受Keap1的调控,是细胞调节抗氧化应激反应的重要转录因子;释放入核的Nrf2与抗氧化反应元件ARE相互作用,调节下游抗氧化基因转录。其体细胞突变通常发生在肿瘤患者中,可导致对转录活性、抗氧化反应和元素介导的解毒酶基因表达的抑制[11]。此外,患者还有MDM2基因p.E236K第9外显子错义突变,MDM2蛋白是一种DNA结合蛋白,可起转录因子的作用,并能与P53蛋白结合,抑制P53介导的转录活性和阻止P53诱导凋亡的作用,属于肿瘤抑制基因,其突变或功能受抑制在肿瘤的发生、发展过程中起重要作用[12]。这三种基因突变的临床意义尚不明确,若导致蛋白功能异常,可能影响下游信号通路,参与肿瘤发生发展。脑膜瘤的恶性进展涉及染色体变异、基因突变、缺失或扩增及细胞信号传导通路的异常调节等事件,异常表达的分子在肿瘤组织中具有异质性和时空特异性,针对这些异常分子机制仍需进一步探索。
Goutagny等[13]回顾性研究了患有287例脑膜瘤的NF2患者,平均随访110.2个月。诊断时脑膜瘤的平均最大直径为14.3 mm,平均年生长率为1.5 mm,66%的肿瘤没有生长或变化很小。随访期间出现25例新发脑膜瘤(8.7%),其生长速度高于其他脑膜瘤(6.6 mm/年)。对14例NF2患者的脑膜瘤样本进行的单核苷酸多态性阵列分析显示,随着等级的增加,染色体不稳定性增加,最常见的丢失是在22q、lp、18q和6p上。在WHO Ⅱ级或Ⅲ级的NF2脑膜瘤中,约35%为进行性生长或症状性脑膜瘤,其发病年龄小于散发脑膜瘤,且肿瘤常具有更高的增殖活性。对有明显症状的NF2脑膜瘤应积极给予干预措施;对于无临床症状及影像学检查无明显生长的NF2脑膜瘤患者,可选择随访观察[14]。对于随访期间出现明显的占位性症状和影像学检查发现肿瘤快速增长的脑膜瘤患者,应及时就诊并采取相应的治疗措施,以免错过最佳的治疗时机造成更严重的神经功能障碍。手术是NF2脑膜瘤的首选治疗方案,术后辅助放化疗综合治疗。放射治疗是NF2脑膜瘤无法行手术切除及术后残留、肿瘤复发患者的重要治疗方法,但放射治疗后肿瘤与周围正常组织的粘连仍然不可避免,甚至会出现肿瘤恶变的可能。目前,一些使用激素受体拮抗剂和特异性受体阻断剂治疗NF2脑膜瘤的药物临床试验具有很好的前景,但仍需要进一步的临床验证[15]。通过对脑膜瘤发病的分子机制研究,靶向药物和免疫治疗有望成为NF2脑膜瘤新的治疗方法。
所有作者均声明本研究不存在利益冲突



























