
患者,男,28岁,因"乏力纳差伴呕吐1个多月"入院,明确诊断为"多发性骨髓瘤,k轻链型,Ⅲ期(ISS分期),高危(mSMART3.0),侵犯胸壁、直肠",完善遗传病全外显子组测序检测(先证者、父母三人家系)提示本人及其父均有辅酶Q8B(coenzyme Q8B,COQ8B)移码变异,变异频率为47.5%。
起病表现为纳差、恶心、呕吐,乏力,有贫血、肋骨骨折、高血钙和肾功能不全,伴左胸壁和直肠肿块。入院时神志清楚,精神萎靡,体温37.4℃,血压128/74 mmHg(1 mmHg=0.133 kPa),贫血貌,双肺呼吸音低,心率144次/min,律齐,未及杂音,未闻及心包摩擦音。腹软,无压痛,肝脾无肿大,双下肢不肿。
完善三大常规、生化、免疫、骨髓穿刺、骨髓活组织检查、胃肠镜、胸壁肿物活组织等评估患者的临床特征,根据梅奥诊所mSMART3.0骨髓瘤分层进行危险分层;完善遗传病全外显子组测序检测(先证者、父母三人家系)。
4次PAD(硼替佐米+吡柔比星+地塞米松)方案化疗后达到严格意义的完全缓解(sCR),进行自体干细胞采集,后续2个RD(来那多胺+地塞米松)方案,2022年7月行自体干细胞移植。
目前持续sCR。
血液科;内分泌科;消化科;肾内科;骨科;心胸外科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
多发性骨髓瘤(multiple myeloma,MM)是一种浆细胞恶性增殖性疾病,在肿瘤中占1%,在血液系统肿瘤中占10%[1]。该疾病好发于中老年人,目前仍不可治愈,中位诊断年龄为69岁,50%以上的患者在诊断时年龄大于75岁[2,3]。年轻的多发性骨髓瘤较罕见,本例患者为28岁男性,完善遗传病全外显子组测序检测(先证者、父母三人家系)提示本人及其父均有COQ8B移码变异,变异频率为47.5%。有研究表明COQ8B基因的致病变异可导致肾病综合征9型(nephrotic syndrome,type 9;NPHS9)[MIM:615573],呈常染色体隐性遗传[4],但该基因突变是否参与了本例年轻患者的多发性骨髓瘤的发病需要进一步探索。
患者,男,28岁,因"乏力纳差伴呕吐1个多月"入院。患者入院1个多月前因恶心、呕吐,无发热,外院内科门诊就诊,考虑慢性胃炎,予以头孢米诺抗感染、奥美拉唑治疗后自觉略好转,间断仍有恶心、干呕,服用左氧氟沙星、曲美布汀治疗,继而出现头晕、乏力、活动后气急,2周前患者进食火锅后再次出现恶心、腹胀、呕吐,呕吐黄色液体1次,发热37.6℃,遂外院发热门诊就诊,血常规提示"Hb 98 g/L,WBC 8.22×109/L,PLT 143×109/L,CRP 2.83 mg/L",血钙2.9 mmol/L,肌酐134 μmol/L,胸部CT提示"左侧第7肋局部骨皮质扭曲",继续予以抗感染、保胃治疗恶心无好转,遂排除新冠感染后消化科住院进一步诊治。入院后完善胃肠镜,胃镜提示"慢性非萎缩性胃炎伴胆汁反流",肠镜提示"直肠息肉",均取活组织送病理活检。住院期间予以抗感染、止吐、制酸治疗,患者仍干呕不止,胃纳差,心率快(139次/min),遂完善正电子发射计算机断层显像仪/核磁共振成像(positron emission computed tomography/magnetic resonance,PET/MR)提示"左侧第7肋骨质断裂,周围软组织FDG代谢增高,考虑恶性肿瘤伴病理性骨折,建议穿刺活检病理,心影增大,两侧胸腔积液,全身骨髓FDG代谢增高,考虑反应性增生,右侧上颌窦炎症"。患者有贫血,骨质破坏,肾功能不全,高钙,需警惕浆细胞肿瘤,遂介绍至我院血液科就诊入院。入院时患者胃纳差、干呕、乏力、活动后气急,偶咳嗽,无痰,低热。患者既往体健,无手术史,无冶游史,无药物食物过敏史,否认肝炎、结核等传染病病史,父母体健,否认家族性遗传疾病史。
入院时神志清楚,精神萎靡,低热(37.4℃),血压128/74 mmHg(1 mmHg=0.133 kPa),贫血貌,双肺呼吸音低,可及少许湿啰音,心音低,心率144次/min,律齐,未及杂音,未闻及心包摩擦音。腹软,无压痛,肝脾无肿大,双下肢不肿。
血常规:Hb 98 g/L,WBC 8.22×109/L,PLT 143×109/L,CRP 2.83 mg/L。生化:血钙2.68 mmol/L,肌酐134 μmol/L,总蛋白69.8 g/L,白蛋白52.6 g/L,球蛋白17.2 g/L,白球蛋白比:3.1,LDH 275 U/L,铁蛋白896 ng/ml,pro-BNP 983 pg/ml。胃镜:慢性非萎缩性胃炎伴胆汁反流。肠镜:直肠息肉(类圆形,直径约3 mm),已取活检,1周后拿病理报告。PET/MR(图1):左侧第7肋骨质断裂,胸壁直径4.8 cm类圆形软组织团块影,SUVmax 2.98。
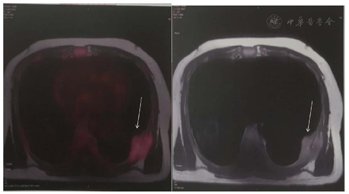

血常规:Hb 75 g/L,PLT 107×109/L,WBC 5.75×109/L,CRP 13 mg/L。血β2MG:10.69 mg/L。心脏超声:右房增大,少量心包积液,检查时心动过速。胸部CT:胸骨、胸腰椎及两侧多发肋骨(右侧第1、5肋,左侧第7肋)骨质异常,左侧第7肋病理性骨折,两肺散在炎症,右肺下叶局部肺组织实变、不张,右胸腔少量积液。第1次骨髓细胞学检查:骨髓增生明显活跃,未见异常细胞。第2次骨髓细胞学检查:原浆细胞22%,免疫表型CD38++CD138++mkappa+。骨髓活组织(图2A、图2B)病理:骨小梁间见片状浆样细胞增生,细胞有异形,CD38+。血尿免疫固定电泳结果回报:κ轻链(+)。血游离κ轻链:3905 mg/L,尿游离κ轻链:91500 mg/L。骨髓染色体核型:45,XY,del(11)(q14),add(14)(q32),inc[cp2]。
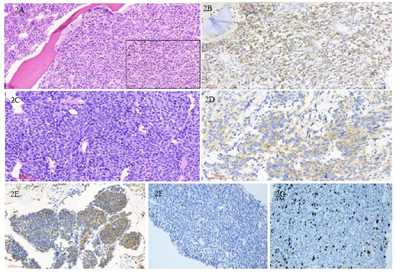

骨髓荧光原位杂交技术(fluorescence in situ hybridization:FISH)IgH重排阳性,RB1基因缺失18%,D13S319基因缺失26%,1q21/1p32融合基因异常11%。直肠息肉病理:极少量活检组织,浆细胞瘤不能除外,CD38+CD138+,ki-67:30%。胸壁肿物病理(图2C~G):浆细胞骨髓瘤,CD38+,kappa+,ki-67为20%,刚果红染色阴性,MYD88阴性。
入住我院患者情况进一步恶化,结合患者的CRAB症状,有浆膜腔积液,尽管患者年级较轻,仍需首先考虑浆细胞疾病,胸壁肿物考虑为髓外侵犯,遂完善生化免疫、血清免疫固定电泳、骨髓细胞学、骨髓活组织检查,当天骨髓细胞学提示"骨髓增生明显活跃,未见异常细胞",疾病诊断一度陷入僵局。
患者在外院的时候曾行肠镜,提示直肠息肉(类圆形,直径约3 mm),此时直肠病理结果提示恶性肿瘤,待后续具体的免疫组化结果进一步明确。患者同时存在胸壁肿物,高钙血症,那么患者难道是肿瘤多发转移,胸壁肿物为原发灶?
关于患者胸壁肿物,请胸外科医师会诊后不能除外骨肉瘤、软骨肉瘤等恶性肿瘤可能,但患者中度贫血,心率144次/min,心功能ECOG评级2级,由于肿瘤性质不同,术式也不同,建议请介入科行粗针穿刺检查。完善胸壁肿物穿刺,3 d后口头报告提示"浆细胞骨髓瘤",遂再次完善多部位的骨髓细胞学检查,报告回报提示"原浆细胞22%,免疫表型CD38++CD138++mkappa+",之后血尿免疫固定电泳结果回报:κ轻链(+)。血游离κ轻链:3905 mg/L,尿游离κ轻链:91500 mg/L。胸壁肿物、直肠肿物正式病理报告回报"浆细胞骨髓瘤,CD38+CD138+"。骨髓活组织检查提示:骨小梁间见片状浆样细胞增生,细胞有异形。骨髓染色体核型:45,XY,del(11)(q14),add(14)(q32),inc[cp2]。骨髓FISH:IgH重排阳性,RB1基因缺失18%,D13S319基因缺失26%,1q21/1p32融合基因异常11%。根据患者存在CRAB症状(高钙血症、肾功能不全、贫血、骨质破坏),血β2-MG:10.69 mg/L,可确诊多发性骨髓瘤,k轻链型,Ⅲ期(ISS分期),高危组,髓外侵犯胸壁、直肠。
明确诊断后4次PAD(硼替佐米1.3 mg/m2皮下注射d1、d4、d8、d11+吡柔比星10 mg/m2静滴d1~d4+地塞米松20 mg静脉d1~d2,d4~d5,d8~d9,d11~d12)方案化疗后达到严格意义的完全缓解(stringent complete response,sCR),进行自体干细胞采集,后续2个RD(来那多胺25 mg口服d1~d21+地塞米松40 mg口服d1、d8、d15、d22)方案,2022年7月行自体干细胞移植。患者在第1次化疗第5天出现肿瘤溶解综合征,予以激素、水化、碱化、利尿治疗,3 d后好转,继续完成第1次后半程化疗。之后化疗均按时顺利完成。
经2个疗程治疗后,患者恶心、呕吐、乏力症状消失,贫血改善,胸腔积液、心包积液消失,窦性心动过速和高钙血症也均已纠正。4个疗程后复查胸部CT提示胸壁肿物消退,骨髓未见异常浆细胞,免疫蛋白电泳k轻链及血k游离轻链阴性,疗效评估为sCR,因疫情原因自体干细胞移植延后,继续2个疗程RD(来那多胺25 mg口服d1~d21+地塞米松40 mg口服d1、d8、d15、d22)方案,2022年7月行自体干细胞移植,目前仍持续sCR。
多发性骨髓瘤是一种恶性疾病,其特征在于浆细胞和单克隆免疫球蛋白或游离轻链(free light chain,FLC)的异常增殖,约占所有血液恶性肿瘤的10%[5]。轻链多发性骨髓瘤(light-Chain multiple myeloma,LCMM)是一种不太常见的多发性骨髓瘤,其特征在于恶性浆细胞无法产生重链,导致排他性地产生轻链,与其他类型的MM相比,LCMM的病程更为积极,预后更差,肾功能衰竭、骨病和全身性轻链AL淀粉样变性似乎更常见[6,7]。研究表明,大部分的MM患者的中位年龄在65岁,只有一小部分MM在40岁之前(约2%)发病,疾病进展迅速,侵袭性较高,常伴有髓外疾病(extramedullary multiple myeloma ,EMD)、溶骨性病变、肾功能衰竭和蛋白尿[8,9]。一项研究小于30岁的年轻多发性骨髓瘤的患者中22%的患者为轻链型(总数52人)[10]。一项韩国单中心研究也提示小于40岁的多发性骨髓瘤患者轻链比例较高[11]。高风险细胞遗传学是极年轻MM患者不良结局的可靠预测指标,经过选用含有蛋白酶体抑制剂的方案,尽早自体干细胞移植后,似乎年轻人的生存率更好[12,13,14]。
考虑该患者发病年龄较轻,又是不太常见的LCMM,需要警惕家族有无高危遗传因素,所以我们完善了患者与其父母共三人的遗传病全外显子组测序检测,发现患者与父亲均存在COQ8B基因突变,受检者所携c.994delC(p.Leu332Trpfs*7)变异遗传自父亲。COQ8B基因与NPHS9发病关系密切[4],基因COQ8B与另外一个辅酶Q10的产生有关,有研究表明,BTZ抗性细胞显示出谷氨酰胺驱动的三羧酸循环和氧化磷酸化的活性增加,以及对电子传递链抑制的脆弱性增加,通过甲羟戊酸途径靶向辅酶Q10合成,可以克服多发性骨髓瘤的硼替佐米耐药[15]。COQ8B基因突变与多发性骨髓瘤的相关性研究未发现更多的文献研究,该基因是否参与调节了患者体内多发性骨髓瘤的发生发展过程有待进一步研究。
另在此主要讨论骨髓细胞学及病理学检查的必要性及局限性。
该患者高度怀疑多发性骨髓瘤,但第1次骨髓细胞学未发现异常,仅骨髓活组织检查见片状浆样细胞增生,细胞有异型。由于多发性骨髓瘤中异常浆细胞常局灶性分布,骨髓穿刺抽吸时易出现骨髓稀释,对于高度怀疑多发性骨髓瘤的患者,而骨髓检查与临床表现不符合时,建议多部位穿刺以协助明确诊断,同时建议完善骨髓活组织检查,较多的骨髓组织能更全面地呈现骨髓增生情况及疾病表现。
对于恶性肿瘤疾病,病理活组织检查目前仍是金标准,但由于其报告出具时间耗时长,对组织的数量要求较高,可以辅助以分子生物学如FISH、肿瘤组织cDNA等检查协助诊断,同时临床医师仍要仅仅抓住临床的症状、体征等全面分析,抽丝剥茧,拨云见雾,不可仅仅依赖影像学和实验室检查。
可惜的是本例患者没有完善24 h尿轻链检查,另外由于肠镜在外院检查,后续联系病理科借片或加做刚果红染色均未达成。
LCMM在年轻患者中比例较高,进展迅速,因此快速诊断和早期治疗对于改善患者预后至关重要。该患者以消化道症状起病,门诊辗转1个多月,一波三折方诊断明确。多发性骨髓瘤常累及多系统,消化科、内分泌、肾内科、骨科、胸外科等门诊医生应警惕该疾病。COQ8B基因是否参与了本例年轻患者的多发性骨髓瘤的发病发展需要进一步探索。
所有作者均声明本研究不存在利益冲突



























