
病例1,先证者为男性,66岁,发现背部肿物1个月余入院。肿瘤史:患者34岁患胃癌,40岁患左半结肠癌,54岁患右半结肠癌,62岁患右侧输尿管尿路上皮癌和膀胱尿路上皮癌,均予以手术切除。家族史:患者父亲和姐姐均患胃癌去世。病例2,先证者为男性,46岁,发现阴茎肿物而入院。肿瘤史:患者39岁患右半结肠腺癌,已手术切除,53岁患脑胶质母细胞瘤,54岁时死于脑胶质母细胞瘤复发。家族史:患者父亲曾患结肠癌和脑胶质母细胞瘤,已去世;患者妹妹48岁时患脑胶质母细胞瘤;一弟弟患结肠息肉;另一弟弟未见异常。
病例1患者背部见突出于皮肤表面直径约2 cm×2cm质韧肿物,表面破溃,伴压痛,按压肿物后上肢无麻木,感觉正常。病例2患者阴茎龟头见一大小约2 cm×2 cm的菜花状肿物,表面苍白,有渗出,质硬。
肿物切除后病理诊断均为鳞状细胞癌。免疫组织化学检测均显示肿瘤MSH2和MSH6表达阴性。2名患者肿瘤史和家族史情况皆符合修订版的Bethesda指南和中国人Lynch综合征家系筛查标准。胚系基因检测结果显示:病例1存在MSH2基因杂合性致病性突变;病例2存在MSH2基因杂合性492bp碱基缺失。患者临床表现和分子检测结果证实2例患者为Lynch综合征相关的皮肤和黏膜鳞状细胞癌。
病例1患者行背部肿物切除术完整切除肿物;病例2患者行阴茎部分切除及尿道外口成形术。
2例患者术后随访未见肿瘤复发及转移。
皮肤科;病理科;肿瘤科;泌尿外科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
Lynch综合征是一种常染色体显性遗传病,子代有50%的遗传几率,具有家族聚集性,是常见的遗传性癌症易感综合征之一[1]。患者一生中可同时或异时性发生多种肿瘤,以结直肠癌和子宫内膜癌最为多见,其次为胃癌、尿路上皮癌、卵巢癌等。Lynch综合征相关皮肤肿瘤较为少见,临床表现为Muir-Torre综合征,发生的肿瘤包括皮脂腺瘤、皮脂腺癌、角化棘皮瘤等[2]。Lynch综合征相关皮肤和黏膜的鳞状细胞癌报道较少。本文报道2例Lynch综合征相关皮肤和黏膜鳞状细胞癌病例,以期提高临床和病理医师对该类肿瘤的认识水平和诊疗水平。
病例1:患者,男性,66岁,因发现背部肿物一月余于2021年3月17日入院。
现病史:专科检查显示背部突出于皮肤表面直径约2 cm×2 cm质韧肿物,表面破溃,伴红肿与压痛,无波动感,按压肿物后上肢无麻木。
既往史:患者34岁患胃癌,40岁患左半结肠癌,54岁患右半结肠癌,62岁患右侧输尿管尿路上皮癌和膀胱尿路上皮癌,均予以手术切除。
家族史:患者父亲和姐姐均患胃癌去世。
病例2:患者,男性,46岁,因发现阴茎冠状沟肿物而入院。
现病史:阴茎冠状沟肿物大小约2 cm×2 cm,菜花状,表面苍白,有渗出,质硬,活动差。触及左腹股沟有一肿大淋巴结,大小约1 cm×1 cm,活动可,质韧,边界清。
既往史:患者39岁患右半结肠腺癌,已手术切除,53岁患脑胶质母细胞瘤,后切除并行放射治疗。
家族史:患者父亲曾患结肠癌和脑胶质母细胞瘤,已去世;患者妹妹48岁时患脑胶质母细胞瘤;一弟弟患结肠息肉;另一弟弟未见异常。
病例1:患者背部肿物行手术完整切除。病理检查显微镜下可见肿瘤呈巢团状,中央可见角化珠形成(图1A),肿瘤侵犯真皮层,周围大量淋巴细胞浸润,病理诊断为高分化鳞状细胞癌。结合患者肿瘤史和家族史,高度怀疑Lynch综合征。四项错配修复(mismatch repair,MMR)蛋白质的免疫组织化学检测显示肿瘤MSH2(图1B)和MSH6(图1C)表达阴性,MLH1(图1D)和PMS2(图1E)表达阳性,提示存在MMR功能缺陷(deficient MMR,dMMR)。
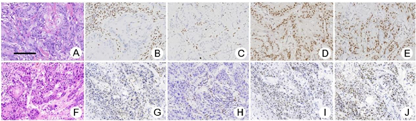

病例1:A.皮肤鳞状细胞癌HE染色;B. MSH2表达阴性;C. MSH6表达阴性;D. MLH1表达阳性;E. PMS2表达阳性。病例2:F.阴茎鳞状细胞癌HE染色;G. MSH2表达阴性;H. MSH6表达阴性;I. MLH1表达阳性;J. PMS2表达阳性。标尺长度为100 μm
病例2:患者行阴茎部分切除术以完整切除肿物,并行尿道外口成形术、左腹股沟淋巴结清扫。病理学检查显微镜下可见肿物表面糜烂,肿瘤细胞巢呈团状、条索状(图1F),部分可见角化珠形成,瘤细胞核分裂像易见,可见细胞间桥。肿瘤间质内见大量淋巴细胞和中性粒细胞浸润。病理诊断为中分化鳞状细胞癌,侵犯神经,左腹股沟淋巴结未查见癌。鉴于患者肿瘤史和家族史,肿瘤组织进行MLH1、PMS2、MSH2和MSH6错配修复蛋白质的免疫组织化学染色。结果显示,肿瘤细胞MSH2(图1G)和MSH6(图1H)阴性表达,MLH1(图1I)和PMS2(图1J)阳性表达,提示存在dMMR。
我们应用免疫组织化学染色方法分别检测了两例患者异时发生的其他肿瘤和家系成员肿瘤组织中四种MMR蛋白质的表达情况,结果显示MSH2和MSH6均表达阴性[3,4]。
两例患者家系系谱图如图2A和图2C所示。MMR胚系基因检测显示,病例1存在MSH2 c.715C>T(p.Q239X)致病性杂合突变(图2B);全外显子测序结果显示病例2存在MSH2基因492bp缺失(chr2:47656751-47657242),该缺失经PolyPhen-2软件预测为致病性变异(0.933)。两例患者MSH6和上皮细胞黏附分子(Epithelial cell adhesion molecule,EPCAM)基因均未检测到致病性变异。
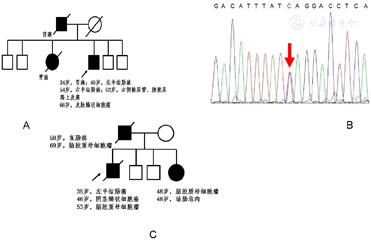

病例1:A.家系系谱图;B.MSH2 c.715C>T胚系致病性突变,Sanger测序;病例2,C.家系系谱图
根据Lynch综合征的临床筛查标准,两例患者的肿瘤史及家族史情况皆符合修订版的Bethesda指南和中国人Lynch综合征家系筛查标准(表1)。综合上述病理诊断、临床及基因检测结果,两例患者均诊断为Lynch综合征相关皮肤和黏膜鳞状细胞癌。

Lynch综合征的临床筛查标准
Lynch综合征的临床筛查标准
| 临床筛查标准 | 内容 |
|---|---|
| 修订版Bethesda指南[5] | 满足以下一项即可:(1)结直肠癌发病年龄<50岁;(2)同时性或异时性结直肠癌或其他Lynch综合征相关癌症,无论年龄;(3)60岁以内发病的结直肠癌,伴有MSI-H样组织学特点(如淋巴细胞浸润肿瘤上皮、克罗恩病样反应、黏液腺癌或印戒细胞癌、髓样癌);(4)结直肠癌患者有≥1例的一级亲属患Lynch综合征相关癌,且其中一个发病年龄<50岁;(5)结直肠癌患者有两个及以上的一级或二级亲属患Lynch综合征相关癌,不论年龄 |
| 中国人Lynch综合征家系标准[6] | 家系中有≥2例组织病理学明确诊断的结直肠癌患者,其中2例为父母与子女或同胞兄弟姐妹关系(一级血亲),同时符合以下任一条件:(1)≥1例为多发性结直肠癌(包括腺瘤);(2)≥1例结直肠癌发病年龄<50岁;(3)家系中≥1例患Lynch综合征相关肠外恶性肿瘤(包括胃癌、子宫内膜癌、小肠癌、上尿路上皮癌、卵巢癌和肝胆系统癌) |
病例1患者行背部肿物完整切除,病例2患者行阴茎部分切除、尿道外口成形以及左腹股沟肿大淋巴结切除术。
病例1术后随访1年余未见肿瘤复发和转移。病例2术后随访9年未见肿瘤复发和转移,该患者于53岁时发现脑胶质母细胞瘤,术后1年出现复发后并死亡。
Lynch综合征的发生与DNA错配修复基因胚系突变导致的MMR蛋白表达缺失、DNA错配修复功能缺陷有关。常见的MMR基因包括MLH1、PMS2、MSH2和MSH6。在正常情况下,MSH2和MSH6结合形成异源二聚体以识别DNA链上的错配碱基并与该位点结合,随后MLH1和PMS2结合形成的异源二聚体被募集至错配位点,在其他错配修复相关酶的参与下,切除含有错配碱基的一段DNA链并进一步合成正确的DNA链,从而完成错配碱基的修复,以保证遗传物质的完整性和稳定性[7]。dMMR的发生机制包括:(1)MMR基因胚系突变。Lynch综合征患者中,MLH1基因和MSH2基因胚系突变病例占60%~80%,MSH6基因和PSM2基因胚系突变病例占15%[8]。目前,大约60%的MMR基因致病性错义突变会干扰剪接,形成截短的、不具有MMR功能的蛋白质片段。本报道中病例1 MSH2 c.715C>T胚系突变(图2B)可使MSH2转录提前终止,产生截短、无功能的MSH2片段。病例2致病性杂合突变,MSH2基因492bp缺失导致MSH2基因转录产物剪接异常、7号外显子缺失。(2)上皮细胞黏附分子(Epithelial cell adhesion molecule,EPCAM)基因(位于2p21)胚系突变。1%~3%的Lynch综合征是由于EPCAM基因3’端外显子胚系缺失引起下游MSH2启动子甲基化和表达沉默导致的[9]。上述MMR/EPCAM基因异常存在于精子或卵子,导致子代出生时所有细胞内MMR/EPCAM的一个等位基因就已经发生了异常,并可遗传给后代,导致Lynch综合征的发生。Lynch综合征患者一生中只需要MMR的另一等位基因再经历一次突变失活就可导致dMMR,使得一系列靶基因复制时出现的错误不能被修正,若涉及细胞生长、分化、凋亡及转移等相关基因的突变累积则最终导致细胞发生恶性转化。因此,Lynch综合征相关肿瘤表现为早发性、多发性的特征。此外,dMMR还可导致基因组中的1~6个碱基对为单位的短串联重复序列(即微卫星序列),在复制发生错误时不能及时被修复而导致碱基的错误插入、缺失和错配,从而出现遗传物质的微卫星不稳定性(microsatellite instability,MSI)。在结直肠癌中,dMMR与MSI密切相关,二者的一致率>95%[10]。
Lynch综合征相关皮肤和黏膜鳞状细胞癌较为罕见。有研究显示,在1942例Lynch综合征患者中仅有12例(0.6%)皮肤癌,包括鳞状上皮和皮脂腺浸润性癌[11]。Ykema等[12]发现,在331例Lynch综合征患者中,仅13例(2.4%)患者出现皮肤鳞状细胞癌,中位发病年龄为52岁(33~60)岁,女性多见(71%),86%的患者具有MSH2胚系突变,所有病例都表现为dMMR。这提示,皮肤鳞状细胞癌应归入Lynch综合征相关肿瘤谱系。此外,MMR免疫组化和MSI的PCR检测结果一致性仅33%,提示应用MMR免疫组化预测MSI状态的准确率可能比结直肠癌低,这需要更多病例样本的进一步研究。本报道中两例患者鳞状细胞癌免疫组织化学染色都显示MSH2和MSH6阴性,胚系基因检测结果均显示MSH2存在致病性变异。因此,两例患者的皮肤和黏膜鳞状细胞癌均与Lynch综合征相关。
Lynch综合征相关皮肤和黏膜鳞状细胞癌的治疗以手术切除为主。近年来,免疫抑制剂治疗为不适合手术或放射治疗的患者提供了新的治疗策略。Khaddour等报道了一例具有MLH1基因胚系突变的患者腹股沟皮肤鳞状细胞癌切除后复发并侵犯大腿内收肌和阴茎根部,后出现肘窝转移。二代测序检测结果显示肿瘤突变负荷高并且具有高度MSI。肿瘤PD-1免疫组化检测结果显示肿瘤阳性率为30%,肿瘤内浸润性免疫细胞阳性率为10%。患者经PD-1抑制剂帕博丽珠单抗治疗后达到完全缓解[13]。
总之,Lynch综合征相关皮肤和黏膜鳞状细胞癌在临床病理学、分子遗传学、诊断与治疗等方面均与散发性皮肤和黏膜鳞状细胞癌存在差异。提高对这类肿瘤的识别能力有助于高危家族成员肿瘤的"早发现、早诊断、早治疗"。在临床诊疗过程中需仔细询问患者的肿瘤史和家族史,结合肿瘤组织四种MMR蛋白质的免疫组织化学染色和患者MMR/EPCAM基因胚系突变检测即可做出诊断。此外,PD-1/PD-L1免疫检查点抑制剂对该类鳞状细胞癌可能具有潜在的治疗作用。希望本病例能够为临床医师对该类肿瘤的诊疗提供思路。
聂义聪 马玉婷 薛英杰,等.Lynch综合征相关皮肤和黏膜鳞状细胞癌2例[DB/OL].中国临床案例成果数据库,2023(2023-01-13).http://journal.yiigle.com/LinkIn.do?linkin_type=cma&DOI=10.3760/cma.j.cmcr.2023.e00281.
所有作者均声明本研究不存在利益冲突



























