
患者,男性,51岁,因体检发现转氨酶高1个月入院。
浅昏迷,肝病面容,皮肤巩膜无黄染,腹部膨隆,移动性浊音阳性,双下肢及低垂部位轻度水肿。
结合转氨酶、总胆红素、异常血凝指标以及腹部CT、腹部超声等化验检查结果,诊断为慢加急性肝衰竭(B型 晚期)原因待查?肝性脑病Ⅳ期;高胆红素血症;高氨血症;肝硬化 脾大 门静脉高压 腹水;高乳酸血症;凝血功能障碍;肺部感染;急性肾功能不全。
2021年10月27日至11月23日行9次非生物型人工肝(DPMAS联合PE)治疗,并根据药敏结果积极行抗肺部感染治疗。2021年11月24日综合评估后行跨血型同种异体原位肝移植术,术中给予利妥昔单抗,术后予激素、他克莫司、麦考酚钠肠溶片三联免疫抑制治疗,术后恢复顺利。
截至目前为止,患者定期随访,一般状况良好,患者肝功能基本正常,肝脏血流未见明显异常,未见排斥反应,血型抗体效价低(抗A IgG抗体<1,IgM抗体1)。
肝脏移植科;重症医学科;消化内科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
肝衰竭是临床常见的严重肝病综合征,病情进展快,病死率极高。它是多种因素引起的严重肝脏损害,导致合成、解毒、代谢和生物转化功能严重障碍或失代偿,主要表现有黄疸、凝血功能障碍、肝肾综合征、肝性脑病、腹水等[1,2]。肝移植手术是终末期肝病唯一有效的治疗措施。人工肝治疗技术可以使肝衰竭患者成功过渡到肝移植手术[2]。我们报道1例肝衰竭昏迷患者经过人工肝支持治疗后,成功行跨血型经典原位肝移植术,旨在探讨在人工肝支持治疗下,为肝衰竭昏迷患者行肝移植治疗的时机和挑战。
患者,男性,51岁,主诉因"体检发现转氨酶高1个月",于2021年10月26日就诊于青岛大学附属医院崂山院区,患者1月前查体发现转氨酶高,为1650 U/L(具体AST/ALT不详),当时无腹痛、腹胀、恶心、纳差等不适,于当地医院查总胆红素699 umol/L,给予保肝、利胆以及人工肝治疗3次,病情逐渐加重,神志逐渐由清至嗜睡至昏迷状态,于当地重症监护室给予连续肾脏替代疗法(Continuous renal replacement therapy,CRRT)及人工肝等治疗,病情未见明显好转,转入我院继续治疗。患者既往体健,否认肝炎病史,否认高血压、心脏病史,否认糖尿病、脑血管疾病、精神疾病史,否认手术史,30年前有外伤史(具体不详),已戒烟戒酒20年,无特殊药物服用史。体格检查:身高173 cm,体重81 kg,BMI 27.06 kg/mm2,浅昏迷,肝病面容,皮肤黏膜及巩膜黄染,双侧瞳孔等大等圆,直径约5mm,对光反射迟钝,深大呼吸,双肺呼吸音粗,双肺散在湿性啰音。腹部膨隆,无压痛及反跳痛,移动性浊音阳性,腹部无包块,肠鸣音弱,约2次/min。双下肢及低垂部位轻度水肿。
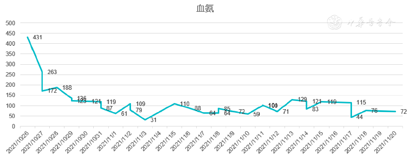
2021年10月26日入院时查血常规:白细胞计数12.11×109/L,红细胞计数3.20×1012/L,血红蛋白106 g/L,红细胞压积31.30%,血小板58×109/L;全血C反应蛋白23.96 mg/L;降钙素原1.9 ng/ml;血凝常规:凝血酶原时间25.90 s,PT百分活度31.00%,国际化标准比值(PT) 2.42 INR,纤维蛋白原0.93 g/L,部分凝血活酶时间74.90 s,APTT比值2.2R;血氨431 umol/L;肝功:血清谷草转氨酶483 U/L,血清谷丙转氨酶262 U/L,白蛋白43.8 g/L,总胆红素739.1 umol/L;肾功能:尿素氮10.1 mmol/L,肌酐155.47 umol/L。乳酸13.2 mmol/L。甲胎蛋白等肿瘤标记物无升高。肝炎及自身抗体相关化验均阴性,梅毒及HIV阴性。
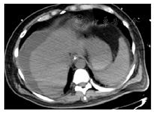
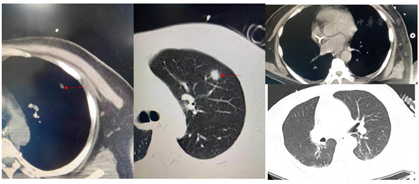
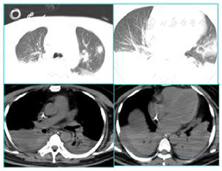
2021年10月28日于青岛大学附属医院行腹部CT(图1)提示肝硬化、脾大、门脉高压、腹水表现、胆囊区高密度影。2021年10月28日胸部CT(图2)提示左肺上叶炎性结节可能,双肺坠积性炎症可能性大,双侧胸膜增厚,右侧少量胸腔积液、心腔密度减低。


序贯器官衰竭评分(Sequential organ failure assessment,SOFA)17分;急性生理学及慢性健康状况评分系统(Acute physiology and chronichealth evalution scoring system, APACHE Ⅱ)25分;终末期肝病模型(Model for end-stage liver disease, MELD)44分;Child-Pugh评分13分,C级。
1.慢加急性肝衰竭(B型晚期)原因待查?2.肝性脑病Ⅳ期;3.高胆红素血症;4.高氨血症;5.肝硬化;6.脾大;7.门静脉高压;8.腹水;9.高乳酸血症;10.凝血功能障碍;11.肺部感染;12.急性肾功能不全。
根据患者病史、化验及CT结果,综合诊断为慢加急性肝衰竭。
鉴别诊断:1.肝脾肿大的相关疾病,包括血液病、代谢性疾病;2.腹腔积液相关疾病,包括缩窄性心包炎、结核性腹膜炎、腹膜癌肿等。
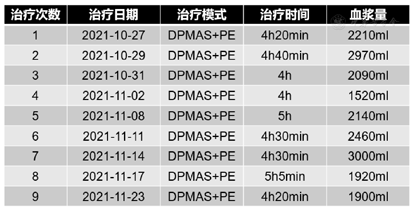
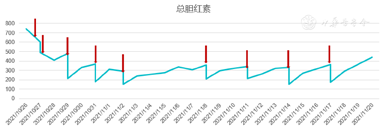
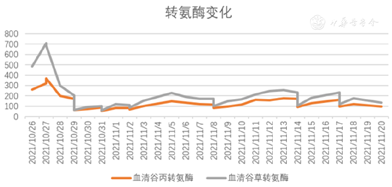
入院后立即给予经口气管插管接呼吸机辅助呼吸,判断意识为深昏迷(Glasgow评分:2+T),给予保肝、降血氨、退黄、营养支持等治疗,并给予双重血浆分子吸附系统(Double plasma molecules adsorption system,DPMAS)联合血浆置换(Plasma exchange,PE)并序贯连续肾脏替代疗法(Continuous renal replacement therapy,CRRT)支持治疗。治疗时间及模式见图3。经治疗后患者血氨变化情况见图4,总胆红素变化情况见图5,转氨酶变化情况见图6。




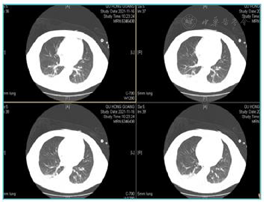
患者经口气管插管后给予床旁纤维支气管镜及肺泡灌洗等检查,并留取相关培养。肺泡灌洗液及痰培养结果为肺炎克雷伯菌肺炎亚种、嗜麦芽窄食单胞菌、少动鞘氨醇单胞菌、铜绿假单胞菌、耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)。肺泡灌洗液二代测序技术(又称高通量测序技术,Next Generation Sequencing Technology,NGS)检查:肺炎克雷伯菌、嗜麦芽窄食单胞菌、屎肠球菌、表皮葡萄球菌、EB病毒、巨细胞病毒。血培养为表皮葡萄球菌和摩根菌摩根亚种。尿培养示摩根菌摩根亚种。真菌GM试验2.98S/CO(正常<0.5),真菌G试验1050.2 pg/ml(>151.5阳性)。巨细胞病毒DNA 2.02E+03拷贝/ml(阳性,正常≤5.00E+02)。2021年11月5日行胸部CT检查提示双侧胸腔积液伴双肺下叶萎缩不张,左肺上叶结节,双肺坠积性炎症改变(图7)。

后根据患者感染情况,经医院抗菌管理组会诊,先后给予美罗培南、多黏菌素(静脉联合雾化)、卡泊芬净、伏立康唑、头孢哌酮舒巴坦、替加环素、替考拉宁、两性霉素B雾化、更昔洛韦等积极抗感染治疗。经过积极抗感染、营养支持等相关治疗后,2021年11月16日复查胸部CT提示肺部炎症较前明显好转,见图8。

患者神志变化情况为入院时为浅昏迷状态,后随着病情进展,逐渐转为深昏迷,后经过积极人工肝、保肝、降氨等处理,患者神志逐渐由昏睡、嗜睡,进而于入院第17天转为神志清楚。
经全院专家MDT讨论,患者具有肝移植手术指征,于2021年11月24日行同种异体原位肝移植术,跨血型,供体为A型血,受体为O型血。手术顺利,手术时间8小时25分钟,无肝期56分钟,冷缺血352分钟,术中出血1000 ml,术中应用利妥昔单抗350 mg,甲强龙480 mg,术后给予他克莫司、麦考酚钠肠溶片、激素三联免疫抑制药物治疗,并给予免疫球蛋白(20 g×12 d)静脉滴注,同时监测血型抗体效价。患者术后第1天出现发热,最高体温38.1℃,给予亚胺培南西司他丁、卡泊芬净、替考拉宁经验性抗感染等治疗后,患者未再发热。术后肝功能逐渐好转,肝脏血流未见明显异常。
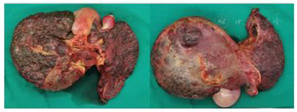
术后肝脏标本病理提示:肝脏大小19 cm×13 cm×10 cm,肝表面及切面满布灰褐色颗粒状结节,部分胆管略扩张,肝组织肝小叶结构破坏,肝细胞中度水肿伴中-重度淤胆,小胆管增生显著,毛细胆管内胆栓形成,间质纤维组织增生伴多量淋巴细胞浸润,分隔肝组织成假小叶结构,符合结节性肝硬化(G3S4)(图9)。

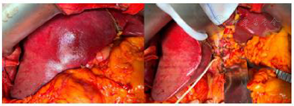
患者术后置入新肝的照片(图10)。

患者于2021年12月29日病情好转出院。出院后定期随访、按时复查,监测血药浓度,定期复查肝脏超声等。患者肝功能基本正常,肝脏血流未见明显异常,未见排斥反应,血型抗体效价低(抗A IgG抗体<1,IgM抗体1)。患者目前一般状况良好,体力食欲大致正常,无特殊不适。
人工肝的治疗机制是基于肝细胞的强大再生能力,通过一个体外的机械、理化和生物装置,清除各种有害物质,补充必需物质,改善内环境,暂时替代衰竭肝脏的部分功能,为肝细胞再生及肝功能恢复创造条件或等待机会进行肝移植[2]。人工肝支持系统主要包括非生物型、生物型和混合型。目前我国主要应用的是非生物型人工肝。常用的模式有血浆置换(Plasma exchange,PE)、血浆(血液)灌流(Plasma-or-hemoperfusion,PP/HP)、血液滤过(Hemofiltration,HF)、血液透析(Hemodialysis,HD)等。常用的组合模式有双重血浆分子吸附系统(Double plasma molecules adsorption system,DPMAS)、血浆透析滤过(Plasmadiafiltration)等,以及国外常用的分子吸附再循环系统(Molecular absorbent recycling system,MARS)、连续白蛋白净化治疗(Continuous albumin purification system,CAPS)等。本例患者入院时已呈现昏迷状态,立即给予了非生物型人工肝(DPMAS+PE)、CRRT以及相关内科药物对症支持治疗后,患者神志逐渐转清。非生物型人工肝治疗可以为肝衰竭患者行肝移植手术做准备,使其成功过渡至肝移植。
行肝移植手术的时机是对病人预后是否好转的关键,本病例病人,在前期治疗过程中,病人病情逐渐好转,肺部感染控制可,但由于缺乏供肝,导致患者当时无法行肝移植手术。继续给予间断非生物型人工肝、内科保守对症支持治疗,待有肝源后于入院第29天行跨血型同种异体肝移植术。如何评估和量化肝功能,对于明确肝病病程和把握肝移植的手术时机具有重要意义。特别是急性肝衰竭或慢加急性肝衰竭合并多器官功能衰竭的患者,移植窗口期非常窄,可能需迅速做出移植决定,待病情初步稳定后,应快速进行肝移植评估[3]。
各种评分系统可以提前评估患者预后,常用的有终末期肝病模型( Model for end stage liver disease,MELD)评分、MELD-Na评分和Child-Turcotte-Pugh( CTP)分级等。Child分级根据肝功能分为A、B、C三级,分级越高,肝功能越差,预后生存时间越短。MELD评分系统可以有效评价移植前患者等待供肝期间的死亡率[4],所以中国和美国的器官分配网络均是以MELD评分为基础进行肝源的分配。美国和欧洲均是建议MELD评分≥15分可纳入肝移植等待名单[5,6],而中国指南则是建议MELD评分≥12分纳入肝移植等待名单,≥18分的患者需要行肝移植手术[7]。然而这些评分系统均有些许不足之处。
为了完善各种评分系统,目前有许多研究也建立了各种预测模型,LIN S等人[8]通过年龄、MELD评分和肝脏与腹腔面积比研究的HBV-ACLF的3个月病死率预测模型,其预测准确率高达87.7%。Du LY等[9]通过回顾性分析601名乙肝慢加急肝衰竭(HBV-ACLF)并且行PE治疗患者的临床相关指标,发现LC、TBil、PT-INR、感染和肝性脑病(hepatic encephalopathy,HE)是HBV-ACLF患者接受以PE为中心的ALSS治疗3个月预后独立预测因子,并提出了预测性PALS评分模型和简化的PALS评分。Logit(P) = -7.498+0.878×LC+0.006×TBil+1.268×PT-INR+0.529×感染+1.506×HE。并得出结论PALS评分0-2分对3个月死亡率的敏感性和阴性预测值均>90%,而PALS评分6-9分的特异性和阳性预测值均>90%。其预测价值优于CART模型和MELD评分。更好的评分系统,可以预测病人的预后,可以对病情进行更加精准的评估。
然而除了一些评分系统以外,还有哪些方面是我们需要关注和手术时机相关的问题呢?肝衰竭的患者,很多会合并肝性脑病、腹水、更严重者可能还合并肝肾综合征、肝肺综合征等。对于合并肝性脑病的患者,我们主要的治疗原则是及时去除诱因,尽快将精神神经异常恢复至正常状态,根据2018版《肝硬化肝性脑病诊治指南》推荐,对于内科治疗效果不理想、反复发作的肝性脑病患者,建议行肝移植治疗[10]。肝硬化最常见,并且首先出现的失代偿表现是腹水,并且3级腹水的患者在所有MELD层级的死亡率都很高[11]。Giannelli,V等[12]研究也表明顽固性腹水会增加失代偿期肝硬化患者的死亡率,并且增加心脏功能受损率。2017版中国肝硬化腹水指南以及2018版欧洲肝病学会的相关指南推荐,2、3级或顽固性腹水患者,应考虑肝移植手术[13,14]。更严重的肝肾综合征和肝肺综合征等,均是在肝病基础上出现的功能性器官衰竭,可能其他器官本身并无明显器质性病变。Chen B等[15]研究发现,在肝肾综合征的患者中D-二聚体显著高于其他类型的AKI。并且研究也表明,肝移植手术也可以提高肝肾综合征患者的生存率[16]。同时指南推荐,一旦患者发生肝肾综合征,无论药物治疗效果如何,肝移植是最佳治疗方法。
综上所述,对于终末期肝衰竭的病人,肝移植手术的时机非常重要。我们应当动态评估患者神志、心脑肺肝等多个脏器的功能情况,关注其并发症的严重程度,选择合适的治疗方案,必要时积极行人工肝支持治疗,为重症患者赢得肝移植手术的机会,以免延误最佳的肝移植手术时机。
孙爽,刘金泉,冯帅,等.肝昏迷患者经人工肝治疗后成功行跨血型肝移植1例[DB/OL].中国临床案例成果数据库,2023(2023-03-06).http://journal.yiigle.com/LinkIn.do?linkin_type=cma&DOI=10.3760/cma.j.cmcr.2023.e00848.
所有作者均声明本研究不存在利益冲突



























