
患者老年男性,因"上腹部隐痛1个月,发现肝占位1周"入院。
患者入院前1个月出现上腹部疼痛,较为剧烈,可以通过口服止痛药控制。查体发现上腹部轻压痛,无反跳痛,肝脾肋下未及。
入院1周前当地医院CT提示胰周多发结节影,我院门诊CT提示肝尾状叶占位,恶性肿瘤考虑。入院后超声造影考虑肝脏1段胆管细胞癌,肝脏增强MRI考虑肝脏1段肝癌伴门静脉侵犯和周围淋巴结多发转移。肝脏肿块穿刺活检考虑恶性肿瘤,间叶起源或肉瘤样癌可能。经过科室多学科会诊,诊断为肝肉瘤样癌。
患者暂无手术指征,予以特瑞普利单抗联合索拉非尼治疗。治疗期间多次复查提示肝脏肿块和周围淋巴结明显缩小,同时腹痛情况明显好转。但是患者出现肝脏2段肿块增大,遂加用肝癌微波消融术,同时心隔角淋巴结无缩小,加用放疗。
治疗半年后患者出现前胸壁肿块,经穿刺活检明确为转移灶。患者病情急剧恶化,总生存期为8个月。
肝胆胰外科;肿瘤科;超声介入科;病理科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
肉瘤样癌是指组织形态学上兼具恶性上皮细胞成分和梭形细胞肉瘤样成分的一种少见的恶性肿瘤的总称,可发生在全身多个器官,以肺部最常见,其次为子宫、乳腺和消化道[1,2]。原发性肝肉瘤样癌(primary hepatic sarcomatous carcinoma,PHSC)是一种罕见的肝脏恶性肿瘤,占肝细胞癌的1.8%~3.9%[3]。PHSC的恶性程度较肝细胞癌和肝内胆管细胞癌更差,中位生存期仅为3个月,1年生存率几乎为0[4,5]。目前对PHSC的主要治疗方式是手术切除,但由于肿瘤生长快,术后复发率较高,患者预后较差。部分患者行化疗、放疗及介入栓塞治疗,其治疗效果均不理想[6]。我们报告1例接受综合治疗的PHSC患者,治疗方式涵盖免疫治疗、靶向治疗、定向放疗和局部消融等,旨在提高对本病的认识。
患者,男性,61岁,因"上腹部隐痛1个月,发现肝占位1周"于2019年11月6日于我院入院接受治疗。患者入院1个月前无明显诱因下出现上腹部疼痛,较为剧烈,影响睡眠,进食后加重,口服止痛药后好转,无畏寒发热,无恶心呕吐,无腹胀便秘等不适。至当地医院就诊,CT检查示:胰周多发结节影,右上肺纵隔旁片状密度增高影。遂至我院就诊,CT检查示:肝尾状叶外生性肿块,考虑恶性肿瘤,原发性肝癌可能性大,累及门静脉主干及门静脉左支,建议MRI增强检查。右侧心膈角区、肝门、胃底多发淋巴结转移。患者为求进一步治疗,门诊拟"肝占位性病变"收治。患者既往有"慢性乙肝"数十年,未治疗未监测。患者无手术史,无药物食物过敏史,无明确家族遗传性疾病。查体:皮肤巩膜无黄染,浅表淋巴结未触及,腹部平软,上腹部轻压痛,无明显反跳痛,肝脾肋下未及,移动性浊音阴性。
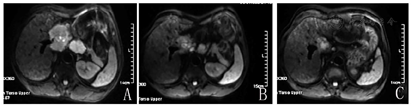
患者入科后完善相关检查。肿瘤标志物基本正常(甲胎蛋白23.2 μg/L,轻度升高)。乙肝小三阳,DNA拷贝数>105 U/ml。肝功能、血常规、凝血功能基本上在正常范围。我院肝脏超声造影提示:肝尾状叶低回声块,肝内胆管细胞癌考虑。2019年11月7日肝脏增强MRI提示:肝脏1段恶性肿瘤,考虑肝癌(肝细胞癌或混合型肝癌可能)伴门静脉主干、肝门区、肝胃间隙及右侧心膈角、腹膜后多发淋巴结转移,肝脏2段弥散加权成像见高信号小结节(图1A)。

因肝脏肿块已侵犯大血管并伴有肝外转移,考虑无手术指征,故于2019年11月8日予以行肝脏尾状叶肿块穿刺,提示:大片坏死组织见少许梭形细胞,结合免疫组化,首先考虑恶性,间叶起源或肉瘤样癌可能。免疫组化结果:CK(AE1/AE3)小部分阳性,CK19(-),EMA个别(+),Vimentin(+),SMA(可疑+),Ki-67指数30%。经过科室多学科会诊,认为患者目前诊断为肝恶性肿瘤明确,PHSC考虑。
患者此时无手术指征,多学科会诊认为PHSC的介入治疗和化疗效果欠佳,考虑到PSHC中含有癌样细胞,建议尝试采用免疫治疗联合分子靶向治疗的全身治疗方式。与患者及家属沟通后决定行PD-1抑制剂(特瑞普利单抗)联合索拉非尼治疗。2019年11月20日、2019年12月13日、2020年1月3日行3次特瑞普利单抗治疗(240 mg,静脉滴注),联合索拉非尼口服(0.4 g,2次/d)、恩替卡韦抗病毒治疗和胸腺法新1.6 mg免疫调节治疗。
患者因出现严重的手足皮肤反应,将索拉非尼剂量减半(0.2 g,2次/d)。治疗期间多次复查肿瘤标志物、血常规及肝功能基本正常,腹痛较之前明显好转,可停用止痛药。2020年1月6日复查肝脏MRI提示:尾状叶病灶及肝门部、腹膜后转移淋巴结稍较前缩小(10%~20%),右侧心隔角转移淋巴结增大,肝脏2段癌结节明显增大(图1B),总体疗效好。
因综合治疗效果良好,继续于2020年1月23日、2020年2月13日、2020年3月6日行3次特瑞普利单抗联合索拉非尼治疗。2020年3月9日我院再次复查肝脏MRI提示:较前片肝尾状叶癌灶及肝门部、腹膜后、右心膈角转移淋巴结缩小,肝脏2段癌结节较前增大,总体疗效好(图1C)。期间复查肿瘤标志物正常,无明显腹痛。虽然整体疗效良好,但肝脏2段肿瘤进行性增大,2020年3月12日多学科讨论建议肝脏2段肿瘤可行微波消融术,对仍偏大的右心膈角淋巴结行放疗(适形调强放疗)。2020年4月3日行肝脏2段肿瘤微波消融术,术后超声造影复查肝脏2段癌灶已消失。2020年4月30日起开始为期5周的适形调强放疗(每周5次,共计25次)。期间于2020年3月27日、2020年4月17日、2020年5月8日继续特瑞普利单抗联合索拉非尼治疗。
2020年5月初患者发现前胸壁近肋骨两处肿块,伴有全身多发疼痛,口服止痛药已无法控制。我院超声提示:转移瘤待排。2020年5月12日肝脏增强MRT示:肝尾叶癌灶及肝门部、腹膜后、右心膈角转移淋巴结与2020年3月9日片大致相仿;肝脏2段癌结节基本坏死。2020年5月13日肋骨增强CT提示:右侧第1~4胸肋关节周围软组织肿块,提示转移,侵犯前纵隔、两侧头臂静脉;右侧心膈角淋巴结转移,较前大致相仿。患者因食欲减弱伴疼痛而无法耐受放疗,于5月下旬中止放疗(仅完成3周)。2020年5月26日PET-CT示:原病灶区未见糖代谢增高灶,提示治疗后失活,右侧胸壁胸骨旁软组织肿块、前纵隔软组织结节、胸骨、右心缘旁及右心膈角肿块、多发淋巴结(左锁骨区、左腋窝、左侧胸壁、腹膜后腹主动脉旁)糖代谢异常增高,考虑转移;2020年6月8日超声造影示:右侧胸壁多发转移灶。次日行右胸壁肿块粗针活检,病理学提示:(右胸壁肿块)穿刺活检,梭形细胞肿瘤,伴坏死,首先考虑恶性,建议进一步免疫组化明确。
2020年6月中旬,因患者病情迅速恶化停止一切药物性治疗方案,在当地医院行全身支持治疗。患者于2020年7月上旬死亡,生存期8个月。
PHSC目前的诊断仍十分困难,实验室检查无明显特异性,本例患者仅有甲胎蛋白轻度升高,无法与肝细胞癌患者有效区分。同时,影像学检查在诊断PHSC方面并不具有特异性。CT增强扫描和MRI增强扫描多表现为动脉期肿瘤边缘的不规则强化,门静脉及延迟期边缘信号明显降低呈轻度强化,中心为无强化(缺血坏死),与肝细胞癌增强模式较为类似[7]。PET-CT摄取特点与肿瘤的恶性程度密切相关,在评估肿瘤术后复发或远处转移有较大的意义。
组织病理检查及细胞免疫组化是确诊PSHC的主要手段。镜下可见PSHC中既有癌样细胞又有梭形细胞肉瘤样成分,同时两者之间存在一定的移行,其中肉瘤样成分占绝大多数,而癌样细胞可以是肝细胞性来源,亦可以是胆管细胞性来源。免疫组化检查可见肿瘤细胞上皮性标志物EMA或CK阳性,同时肉瘤样成分标志物Vimentin或肉瘤样梭形细胞SMA阳性。PHSC并无真正的上皮和间叶组织,只是有上皮性和间叶性两种标志物表达阳性,且PSHC中的肉瘤样成分是由癌细胞化生而来[8]。
尽管PHSC的肿瘤特性使手术切除的预后并不理想,但早期PHSC患者手术治疗是目前最佳的治疗方式。R0切除能够获得更好的预后[9]。但是,PHSC为高度恶性,发现时往往已是中晚期,大部分患者已丧失手术根治机会。晚期PHSC患者目前没有统一的治疗方案,既往有使用介入、消融、化疗等治疗方式的报道,但是因为样本量少,暂无充分证据证实其有效性。目前免疫治疗(如PD-1抑制剂)联合靶向治疗(如仑伐替尼)已作为各指南普遍推荐的肝细胞癌一线治疗方案,但在PSHC中的治疗作用未经证实。基于PSHC中有相当部分的癌样细胞可能对免疫和靶向治疗敏感,有学者对1例接受手术治疗后复发的PHSC患者,在对索拉非尼和仑伐替尼治疗无效的情况下,采用纳武利尤单抗治疗,患者完全缓解达8个月[10]。本例患者诊断PHSC时已为晚期,在免疫治疗和靶向治疗的基础上加行局部的消融术和放疗,患者总生存期8个月,展示出一定的治疗效果。目前晚期PHSC患者的治疗方式还在探索中,局部治疗联合免疫和靶向治疗可能成为治疗晚期PHSC的方向之一。
黄鹏飞,王伟林.原发性肝肉瘤样癌全身综合治疗1例[DB/OL].中国临床案例成果数据库,2023(2023-03-08).http://journal.yiigle.com/LinkIn.do?linkin_type=cma&DOI=10.3760/cma.j.cmcr.2023.e00877.
所有作者均声明本研究不存在利益冲突



























