
患者,女性,56岁,因"右上腹隐痛1周"入院。
右上腹隐痛1周,伴右上腹腹胀。体格检查:皮肤双眼巩膜无明显黄染,无肝掌及蜘蛛痣,心肺无异常,全腹软,右上腹深压痛,无反跳痛及肌紧张,未触及明显包块,肝脾未触及,肝区叩痛(+),移动性浊音阴性。
入院腹部增强CT:肝左内叶及肝右叶占位,胆管细胞癌可能,并肝门淋巴结转移。入院腹部增强MRI:肝左内叶及肝右叶占位,胆管细胞癌可能,并肝内扩散、肝门淋巴结转移,胆囊底、胰头区、门静脉右支受侵可能。肿瘤标志物,CA19-9:277.82 KU/L↑;NSE:21.10 ng/ml↑;CEA:17.64 ng/ml↑;CA242:113.00 IU/ml↑;β-HCG:4.51 ng/ml↑;AFP:2.05 ng/ml、CA125:185.49 KU/L↑、CA15-3:112.05 KU/L↑、CYFRA211:20.51 ng/ml↑、CA724:50.29 IU/ml↑。
经化疗和靶免治疗3次后肿瘤降期,于全麻下行"右半肝切除术+胆囊切除+腹腔淋巴结清扫+胆肠吻合",术后规律行化疗及靶向治疗。
目前处于无疾病进展生存状态,影像学疗效评价稳定。
肿瘤科;肝胆外科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)是来源于肝内Ⅱ级胆管及其以上分支的胆管上皮细胞恶性肿瘤,其恶性程度高、发病隐匿,易发生淋巴结转移。目前根治性手术切除是ICC首选的能获得长期生存的治疗手段[1],但只有少数病人能够接收手术治疗。随着对ICC分子发病机制的深入研究以及化疗、靶向治疗、免疫治疗等全身系统治疗的不断尝试,使得部分初始不可切除的ICC患者得以降期甚至获得R0手术切除的机会,并且在术后的辅助治疗中也取得一定进展[2]。目前对于局部晚期ICC患者经转化治疗后完成根治性手术切除的病例报道较少,我院收治1例存在淋巴结转移、血管及周围脏器侵犯的ICC患者,经转化治疗后完成根治性手术切除并在术后进行综合治疗。
患者,女性,56岁,因"右上腹部疼痛1周"于2022年1月1日入院。患者入院1周前无明显诱因出现右上腹疼痛,呈阵发性钝痛,向腰背部放射,遂于外院行腹部B超及全腹CT提示肝右叶内见多个大小不一稍低密度占位灶,肝内外胆管扩张。为求进一步诊治来我院就诊,门诊已"肝占位性病变"收住院。
入院专科体格检查:腹部平坦,腹壁静脉无曲张,皮肤双眼巩膜无明显黄染,无肝掌及蜘蛛痣,未见胃肠型及蠕动波,腹式呼吸存在,腹软,右上腹深压痛,无反跳痛及肌紧张,未触及明显包块,肝脏剑下及肋缘下未触及,肝浊音界存在,肝区叩痛(+),移动性浊音阴性。
血常规:WBC 6.61×109/L,HB 136 g/L,PLT 299×109/L。肝肾功能:TBIL 20.7 μmol/L,DBIL 11.8 μmol/L,UBIL 8.9 μmol/L,ALT 63 U/L,AST 93 U/L,γ-GGT 788 U/L。肿瘤标志物10项(女性):CA19-9 277.82 KU/L,CEA 17.64 ng/ml,CA125 185.49 KU/L。
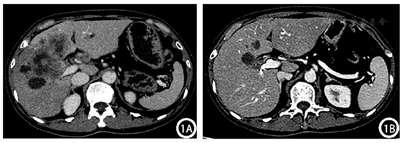
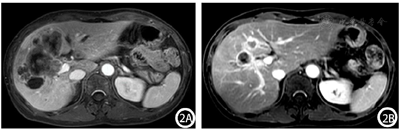
腹部增强CT:肝脏大小、形态正常,肝左内叶及肝右叶见大片状稍低密度影,增强扫描呈边缘强化,中心未见明显强化,邻近胆管扩张,门静脉右支受累,肝门区见多发肿大淋巴结,增强后强化不均匀;胆囊不大,囊内未见异常密度及异常强化灶。考虑胆管细胞癌可能,并肝门淋巴结转移(图1A)。腹部增强MRI:肝左内叶及肝右叶胆管扩张呈囊状异常信号灶,管壁增厚,其内及周围肝实质见多发片状T1WI低/稍低信号,T2WI高/稍高信号,DWI边缘呈明显高信号,中央稍高信号,增强扫描胆管及肝实质病灶呈环形强化,中央囊液不强化;胆囊底壁近肝实质处不规则增厚,DWI呈局部高信号,增强扫描轻度强化;门静脉右支受累,肝门区见多发肿大淋巴结,较大者大小约为2.0 cm×1.0 cm,形态不规则,增强后强化不均匀;胰头区见片状异常信号灶,DWI明显高信号,胰管未见明显扩张。考虑肝左内叶及肝右叶占位,胆管细胞癌可能,并肝内扩散、肝门淋巴结转移,胆囊底、胰头区、门静脉右支受侵可能(图2A)。


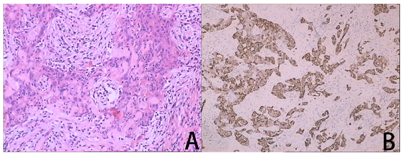
(肝组织)考虑胆管细胞癌,癌组织明显坏死、胶原化。所有淋巴结未见转移性病变。免疫组织化学结果:CK7、Villin、CK19、CK8/18、CD10部分、CD34血管、Ki-67、β-catenin阳性,CK20、Glypican-3、Hepper-1、Galectin-3、S100、CEA、D2-40、HbcAg、HbsAg、P40、P63、CK5/6阴性(图3)。

结合症状、体征、实验室检验及影像学检查考虑诊断:肝内胆管细胞癌[AJCC第8版TNM分期:T4N1M0(Ⅲb期)]。
(1)肝细胞肝癌:肝细胞肝癌患者多有右上腹疼痛,同时大多存在病毒性肝炎或肝硬化病史,血清甲胎蛋白水平升高,行腹部B超、CT、MRI、PET及肝动脉造影肝组织活检有助于明确诊断。
(2)肝继发恶性肿瘤:肝脏血液供应丰富,人体各器官恶性肿瘤可通过血液、淋巴液转移或直接浸润肝脏等途径形成继发性肝癌,可出现肝脏病变相关症状、体征,影像学检查可出现转移病灶的特征性表现,同时多有原发病灶的相应表现,在诊断继发性肝癌的同时主要查找肝外器官原发癌肿病灶,诊断困难时肿瘤组织活检有助于明确诊断。
(3)肝脏良性肿瘤:通常疾病进展缓慢,病程较长,患者一般情况较好,多数肝脏良性肿瘤如肝血管瘤、局灶性结节增生、肝腺瘤、肝错构瘤等在影像学检查中多数有特征性表现,性腹部CT、MRI等检查有助于明确诊断。
结合患者肿瘤分期,分别于2022年1月5日、2022年2月14日、2022年3月16日进行了3个周期的转化治疗,方案为吉西他滨+替吉奥+仑伐替尼+卡瑞利珠单抗:吉西他滨1.4 g静脉滴注、替吉奥50 mg每日2次(服用4周停2周)、仑伐替尼8 mg口服每日1次、卡瑞利珠单抗200 mg。患者规律经以上治疗后,于2022年4月11日返院,行腹部增强CT:对比前片:肝脏占位病变范围较前稍缩小、强化程度大致同前,肝门区肿大淋巴结本次扫描未见显示(图1B)。腹部增强MRI:对比前片,肝左内叶及肝右叶占位较前明显缩小,肝门部肿大淋巴结未见显示,胆囊底部结节状异常信号灶范围较前缩小,胰头区受累病变DWI未见高信号,门静脉右支及右侧肝内胆管受累同前(图2B)。结合影像学检查,患者ICC分期:T2N0M0(Ⅱ期),转化治疗成功,达到降期目标,遂完善术前准备后,于2022年4月20日在全身麻醉下行"右半肝切除+胆囊切除+腹腔淋巴结清扫(第8组3枚、第12组3枚、第14组4枚)+胆肠吻合+腹腔冲洗置管引流",手术顺利,术后恢复良好。术后自2022年6月9日开始,患者定期每3周返院接受全身化疗及免疫、靶向治疗,方案:吉西他滨1.4 g每3周1次+培他滨1.75 g每日2次(治疗2周停药1周)+仑伐替尼8 mg口服每日1次+卡瑞利珠单抗200 mg每3周1次;经3个周期治疗后,患者CA19-9无明显下降,遂改换方案:吉西他滨1.4 g每3周1次+卡培他滨1.75 g每日2次(治疗2周停药1周)+顺铂40 mg每日1次(连用3 d)每3周1次,以此方案治疗至今。
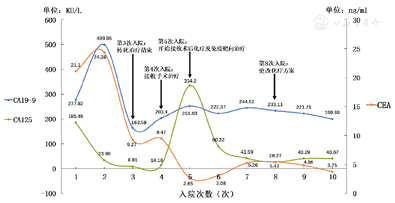
术后随访至今,每月定期返院予以上方案全身化疗,复查影像学未见肿瘤进展,整个治疗过程肿瘤标记物CA19-9、CEA、CA125变化情况见图4。

ICC在原发性肝癌中仅占10%~15%,其特点为发病隐匿、侵袭性高,易发生淋巴结转移、脉管侵犯及肝内转移,且预后极差[3]。目前,对于不可切除ICC患者的转化治疗在国内外诸多诊疗共识及指南中尚无统一推荐,而通过全身综合治疗降低不可切除ICC的肿瘤分期,转化为可切除ICC的相关病例及文献报道较少,并且对不可切除ICC患者的转化治疗尚缺乏前瞻性研究。在《2022版美国国立综合癌症网络(NCCN)肝胆肿瘤临床实践指南》[4]和《CSCO胆道系统肿瘤诊断治疗专家共识(2019年版)》[5]中指出,对于不可切除ICC患者的初始治疗原则是选择以吉西他滨为基础联合顺铂为主的全身治疗方案,同样在《肝内胆管癌外科治疗中国专家共识(2020版)》[6]中提到部分晚期ICC患者在接收吉西他滨+顺铂全身化疗后达到降期效果。此外,在一项随机对照研究中,对于晚期胆道癌患者的治疗认为替吉奥联合吉西他滨方案在1年生存率和中位生存时间方面较替吉奥单药治疗更具优势[7],而一项对比吉西他滨+替吉奥和吉西他滨+顺铂在治疗晚期/复发性胆道癌的研究中发现,吉西他滨+替吉奥方案在中位OS和中位PFS方面并不亚于吉西他滨+顺铂方案,并且认为吉西他滨+替吉奥方案不需要水化治疗,可作为晚期/复发胆道癌患者一种新的、方便的标准治疗选择[8],而国内也有报道使用吉西他滨+替吉奥作为初始治疗方案治疗晚期ICC患者并获得部分缓解的效果[9]。系统化疗是不可切除ICC最常用的治疗方式,但在转化治疗方面,目前更倾向于联合靶向、免疫和局部等治疗,因此,对于本例患者,笔者团队选择了吉西他滨+替吉奥的全身化疗,同时联合了仑伐替尼+卡瑞丽珠单抗的靶向、免疫治疗作为其术前的转化治疗方案。
随着对ICC发病机制研究的不断深入以及二代测序技术的发展,对于ICC的靶向和免疫治疗的研究已逐渐成为热点,其中,胆管癌FGFR基因突变的发现,使得FGFR抑制剂成为胆管癌靶向的治疗选择之一[10]。FGFR抑制剂在不可切除ICC患者中展现了较好的抗肿瘤效果[11]。仑伐替尼作为一种多激酶靶向抑制剂,FGFR是其靶点之一。有临床研究及报道指出,仑伐替尼联合免疫治疗或全身化疗对于ICC患者具有一定的抗肿瘤效果[12,13,14]。目前,针对ICC的免疫治疗仍处于临床试验阶段,一项PD-1抑制剂联合仑伐替尼治疗不可切除胆管癌的Ⅱ期临床研究表明,约34.2%的患者实现肿瘤降期和转化切除,展现了靶向治疗+免疫治疗的联合应用在局部进展期和晚期ICC的转化治疗方面具有较大潜力[15]。
因此,笔者团队为此患者提供了"吉西他滨+替吉奥+仑伐替尼+卡瑞丽珠单抗"的初始治疗方案,经过以上3个周期的全身化疗联合靶向及免疫治疗后,按照美国癌症联合委员会(AJCC)发布的第8版TNM分期系统,该患者自T4N1M0(ⅢB期)降期为T2N0M0(Ⅱ期),使得患者获得了根治性手术的机会,最终成功实施根治性手术切除,使得目标病灶达到完全缓解。ICC的转化治疗为许多不可切除的ICC患者创造了R0手术切除的机会,临床不乏成功案例,但总体来说,对于局部进展期及晚期ICC患者的转化治疗成功率较低,也缺乏相应的临床研究及治疗推荐,笔者认为,对于此类患者,术前的全身治疗,在实现降期治疗的同时,也筛选出了对此治疗方案敏感的患者,为术后的系统治疗提供了指导方向。现今,对于ICC的非外科手术治疗方式也更为丰富,如全身化疗、靶向和免疫治疗以外,还有局部治疗的TACE、SIRT、HAIC等多种治疗方式,为临床医师提供了很多"武器",因此,对于不可切除ICC患者的治疗从以往的仅放化疗、支持治疗的模式,转变为根据不同患者的自身情况,如肿瘤对药物的组织学反应、肿瘤大小、数量、残肝体积、血管侵犯、肝外及淋巴结转移、患者身体耐受情况等方面综合考虑,选择个体化的全身、局部联合治疗方案,从而达到增加晚期ICC患者根治性手术切除机会、延长患者总体生存时间、减少相关不良反应的目标,使患者真正地获益。
王祎,蒋龙.晚期肝内胆管细胞癌转化治疗成功后行根治性切除1例[DB/OL].中国临床案例成果数据库,2023(2023-03-11).http://journal.yiigle.com/LinkIn.do?linkin_type=cma&DOI=10.3760/cma.j.cmcr.2023.e00919.
所有作者均声明本研究不存在利益冲突



























