
左上颌残根,要求种植诊疗。
临床检查见左上颌26残根,CT显示牙槽骨剩余高度2-3mm。行上颌窦穿牙槽嵴顶内提升实现大范围骨增量。
残根。
种植。
成功骨结合。
种植科;牙周科;口腔颌面外科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
由于上颌后牙缺失导致的牙槽骨吸收以及上颌窦的气化,上颌后牙区牙槽嵴顶与上颌窦底之间的骨量往往少于5 mm。上颌窦是上颌骨上的一对气体圆锥腔,平均体积约12~15ml,平均体积4.5~35.2ml,平均高度36~45 mm,宽度25~35 mm,长度38~45 mm[1]。Kopecka等测量了583例后牙缺失后的剩余牙槽骨的高度(subsinus bone height,SBH),第一磨牙区的SBH高度为3.3 mm±2.2 mm,第二磨牙区为4.5 mm±2.4 mm。早在1998年,Jensen就提出了上颌窦底RBH的四型分类:以RBH≥10 mm为A类,推荐性常规牙种植术,以7 mm≤RBH≤9 mm为B类,推荐行上颌窦内提升术植入种植体,以4 mm≤RBH≤6 mm为C类,推荐行上颌窦外提升术植骨同期或延期植入种植体,以RBH<4 mm为D类,推荐行上颌窦外提升术植骨延期植入种植体[2]。另外,上颌后牙区的骨质大多属于Ⅳ类骨,因此,往往需要进行上颌后牙区的骨增量。目前,上颌窦底提升术是上颌后牙区最常用的骨增量方法。2004年,宿玉成等也根据RBH将上颌后牙区种植手术分为4类:RBH>12mm时无需行上颌窦提升术,常规植入种植体,8mm≤RBH<12mm且骨质较好时,行上颌窦内提升术,同期植入种植体,5 mm≤RBH<8 mm时,行上颌窦外提升术,并同期植入种植体,RBH<5mm时,应先行上颌窦外提升术,延期植入种植体[11]。近年来有报道认为,当RBH≥6 mm时可行上颌窦内提升术[3]。该技术由Tatum在1997年最早提出,随后的学者提出多种改进方法,已经成为常规的、具有较高成功率的骨增量技术。Gonzalez等对2 mm<RBH<4 mm的患者行上颌窦内提升术同期植入种植体,虽然6~100个月种植成功率为100%[4]。根据开窗路径的不同,上颌窦底提升术被分为经上颌窦侧壁开窗的窦提升术,简称外提升术,以及经牙槽嵴顶的上颌窦底提升术,简称内提升术。
患者,女性,28岁,主诉:左上颌牙齿缺失,前来咨询种植。症状体征:左上颌见26残根多年。牙龈红肿。未进行治疗。家族史、既往病史未见异常。
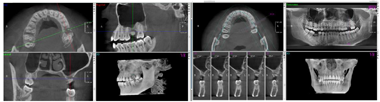
临床检查见26残根占位,牙槽嵴丰满度一般,龈合距离与近远中间隙基本正常,表面黏膜光滑,无扪痛(图1)。CT显示:残根存,26可利用牙槽嵴高度约2 mm。
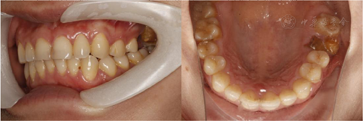

26残根
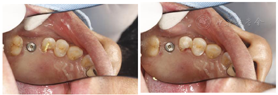
种植(图2)。

术前CT检查(图3)。

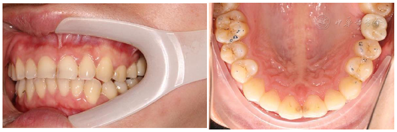
术中操作详见图4。术后6个月复查结果详见图5、图6。患者戴牙CT、种植前后CT对比图及戴牙1年后复查CT结果详见图7,图8,图9。











绝大部分作者在决定同期还是分期植入种植体的时候,都是根据上领窦底剩余骨高度来做决定的,而这正是种植体获得稳定性的基本条件。普遍的共识是上颌窦底剩余骨高度在4~5mm时可选择同期植入种植体。然而,最近的一项研究表明即使上颌窦底剩余骨高度仅有1 mm,仍然可以成功地同期植入种植体。部分研究指出,极限情况下可获得约6mm的提升高度[5,6]。2003年,Winter等通过经牙槽嵴顶上颌窦开窗术在RBH<3 mm的情况下,从腭侧切开并向颊侧翻开黏膜瓣,在牙槽嵴顶做一比预期种植体直径小2 mm的矩形窗口,轻敲游离骨块后剥离窦底黏膜,将骨块和黏膜一起提升至所需高度,同期植入种植体,提升幅度最高可达9 mm,负载一年后随访存留率仍有90%[7]。冲顶式上领窦底提升术并发症更少、手术时间更短,但需要更高的上领窦底剩余骨高度。上领窦底骨增量疗效可靠已有大量的报告,而关于骨增量的成功与否的评估通常是以种植体存活率作为标准的。2003~2013年期间发表了大量基于循证医学的关于上领窦底骨增量后种植结果的系统回顾。1994年,Summers首次报道了经牙槽嵴顶的上颌窦内提升术,主要是采用特殊的尖端为内凹设计。在逐步植入种植体的基础上,对上颌窦底的骨壁进行撞击,选择性地填充骨材料,在液压原理下抬高上颌窦底黏膜,同时植入种植体,并进行植入。也被简称为Summers技术[8]。如今,上领窦底骨增量是处理上领后牙区骨量不足的首选方法,也是一项有据可依的技术。作为临床工作者应该始终牢记:上领窦底提升的目的是恢复吸收后的上领骨后部骨量,以便植入合适的种植体,且植入后的种植体能够按照骨整合的基本原则正常愈合。因此上颌窦内植骨材料的稳固是骨整合的基础重要的是要知道上颌窦内的植骨材料的愈合是一个动态的过程,即使是在上领窦底骨增量几年后这个过程也一直在进行。大量的临床研究报告表明,上颌窦底提升同期植入的种植体或6个月后植入的种植体存活率相似(分别为91.8%~100.0%和91.9%~100.0%)。Tatum在20世纪70年代首次提出了经牙槽峰顶入路上领窦底提升技术。他使用冲顶技术行上颌窦底提升同期植入种植体的结果于1986年发表[9]。在他最初发表的文章中,使用了一种被称为"骨窝成型器"的器械(用于特定大小种植体)制备种植窝洞,使上领窦底发生"青枝骨折",抬起窦底,使其向更顶端的方向移动。然后植入根形种植体,种植体埋入后自行愈合。在当时,作者没有使用任何植骨材料来增加和维持提升区域的体积。后来,描述了该技术的一种改良方式,即另一种经牙槽崎顶入路提升的方法,称之为"冲顶式上领窦底提升术"(OSFE)。Boyen的动物实验研究证实,当种植体穿入上颌窦内2~3 mm时,这部分种植体的表面将完全被再生的新骨覆盖;穿入上颌窦内3~5 mm时,穿出部分只能部分被再生的新骨覆盖[10]。该方法使用一系列直径不同的骨挤压器,方法更简单、创伤也更小。建议对Summers原来的冲顶式上领窦底提升植骨术加以改进,以加快手术过程,最大限度地减少锤击力,并使窦底折断更简单。改进建议是:手术器械、植骨材料、种植体表面和设计的改进以及手术方式的设计。本报告将对手术方式的设计进行了改进。在1998年,Fugazzotto和Vlassis描述了一种在牙槽顶矩形开窗的提升方法。切开"窗口"周围骨板后,将"窗口"和窦膜一起向上分离抬升这种方法适用于上颌窦底到牙槽嘴顶的剩余骨高度明显小于2 mm的情形。在采用环钻行种植窝预备后,钻至上颌窦底1 mm处,敲击骨块,使骨块进入上颌窦,从而抬高上颌窦膜的一种内提升术式,该术式能最大程度的保留自体骨,在一定程度上减少患者的经济负担,同时保留骨板上的成骨细胞,也为提高种植体的骨结合创造了条件[11]该技术结合了上领窦底提升和即刻种植,撑起窦膜使之起到帐篷样作用。该技术最常见的并发症是无法获得种植体的稳定性。因此,几年后,作为对SACT技术的改进,Nader等及Soardi和Wang详细地描述了牙槽顶开窗、延期种植的上颌窦底提升方法。截骨的深度是由嵴顶骨的厚度决定的。骨开窗应位于牙槽顶宽度范围之内,不可延伸至颊侧或腰侧。一旦切开顶部的开窗骨板,就用超声骨刀盘状刀头将窦膜与骨壁分离。有学者利用超声骨刀穿通上颌窦底骨板,对RBH介于2~8 mm的患者行经牙槽
嵴顶的上颌窦内提升术,5~27个月随访期内,仅出现一例上颌窦膜破裂,且该术式能在一定程度是减少传统骨凿敲击法给患者带来的眩晕或头疼等不适症状[12]。Kim等同样利用超声骨刀行上颌窦内提升术,其研究结果显示,平均负载69.3周后上颌窦底骨增量为(5.49±2.51)mm,种植成功率为97.2%,窦膜穿孔率约为28%[13]。这项技术可以最大限度减少窦膜穿孔的可能性,这是因为从窦底往上分离黏膜是没有张力的,很容易分离(由于吸气会吸窦膜往上的作用)。而且在存在分隔的情况下,用这种方法也许有助于减少窦膜穿孔。用宽的挤压器轻轻向上敲牙槽骨崎顶的骨开窗(窦内方向),直到矩形骨块可以移动,顶的骨缺损用植骨材料充填,这是骨再生的理想部位。用作屏障的胶原膜放置在嘴顶,盖在移植骨上面,四周要延伸到开窗之外。这种峭顶骨窗嵌入法(CBIT)技术还存在其他变化,如:使用弯头骨凿,或者是超声骨刀更好,以尽量减少窦膜穿孔的风险,并保持在顶部窗口周围保留1.5 mm的最小骨宽度。
这种方法适用于以下情况:大面积无牙区;宽大的牙槽崎;上领窦底剩余骨高度≤2 mm;上领窦内存在复杂上领窦解剖结构(骨分隔,粗大的上牙槽后动脉)。
手术分步:
a.骨凿制备骨开窗;b.骨挤压器向上冲顶骨开窗;c.窦腔内充满骨替代材料(注意嵌入窦底骨板的新位置);d.同期植入植体;e.用可吸收膜封闭缺损。
目前,关于牙槽峭顶入路上颌窦底提升添加植骨材料的必要性仍存在争议。内提升术的骨增量效果有限,种植体在窦内的部分只能被新骨部分包绕,新骨形成的机制为:种植体顶端撑起窦黏膜并形成帐篷状相对密闭的空间,骨细胞来源于骨折窦底的骨髓间质、骨膜和微血管壁;有体外研究发现窦黏膜内含有成骨的干细胞,提示窦黏膜可能有直接的骨诱导作用[14]。根据Summers冲顶式上领窦底提升植骨术,在行经牙槽峰顶入路上领窦底提升时,大多数临床医生倾向于应用植骨材料(自体骨、同种异体骨的或异种骨)来维持窦膜和上领窦底之间的空间,以确保新骨形成。
时至今日,对于经牙槽崎顶上领窦底提升的适应证(与侧方入路相比)以及采用延期或同期植入种植体仍存在争议。事实上,延期植入要么是在某些情况下,当种植体难以达到初期稳定性时,将其作为首选;要么是种植体植入当时未能达到初期稳定性时,将其作为第二选择。
此外,经牙槽嘴顶上领窦底提升不再受最小上领窦底剩余骨高度(> 5 mm)的限制,而是扩展到更极端的情形,同期植入种植体没有什么先决条件,这和侧壁入路上颁窦底提升是一样的。
最后,关于是优先选择牙槽峭顶入路上领窦底提升还是侧壁入路上领窦底提升很难提供明确的界定。然而,根据不同的临床情况和外科医生的经验,应优先考虑简单、侵入性小、并发症风险低、患者发病率低的方法。
治疗结果:种植体形成良好的骨结合。上颌窦内骨增量成骨效果良好。预后一年半复查,种植体周牙槽骨稳定,硬骨板明显。嘱患者无咬硬物、保持良好的口腔卫生。
上颌窦穿牙槽嵴顶内提升术能较之前术式更优化实现稳定的、更大范围的骨增量。能得到更加微创,治疗程序更加简洁的诊疗效果。上颌窦骨增量效果目前仍是各项骨增量术式更好,符合PASS原则成骨效果显著。稳定的成骨空间,充足的血供,良好的愈合,植体的稳定性高。上颌窦穿牙槽嵴顶的内提升,能较其余内提升术式实现范围更广的骨增量。合理地运用上颌窦改良内提升术能将部分适应证扩宽。使得以往需要运用上颌窦外提升术,抑或需要先前期植骨后续延期种植的患者。若是样本量的增多以及追踪时效更长,以循证医学的角度去验证上颌窦改良内提升的效果,则更能评价上颌窦穿牙槽嵴的内提升术的优缺点。
黄仁章.上颌窦穿牙槽嵴顶内提升实现大范围骨增量临床报告1例[DB/OL].中国临床案例成果数据库,2023(2023-03-23).http://journal.yiigle.com/LinkIn.do?linkin_type=cma&DOI=10.3760/cma.j.cmcr.2023.e01052.
所有作者均声明本研究不存在利益冲突



























