
患者,女,31岁,未婚无性生活,因"阴道不规律流血3个月"就诊,经PET-CT及手术病理确诊为宫颈透明细胞癌ⅣB期。
阴道流血,咳嗽,气喘,体力活动后气喘加重,伴气短及呼吸困难。
PET-CT、病理学、胸部CT及临床症状体征。
经放疗及同步化疗治疗后仍有残留病灶,行免疫检查点抑制剂治疗后出现免疫检查点抑制剂相关性肺炎。予患者糖皮质激素治疗缓慢减量6周,但糖皮质激素停药后8 d症状再发,经多学科会诊,第2次延长糖皮质激素治疗时间,缓慢减少糖皮质激素用量。
免疫检查点抑制剂相关性肺炎治愈,免疫检查点抑制剂治疗停药后共存活23个月,无进展生存期为10个月,总生存期为37个月。
妇产科;肿瘤科;呼吸科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
宫颈透明细胞癌(clear cell adenocarcinoma cancer,CCAC)是一种罕见的宫颈恶性肿瘤,其治疗根据患者临床分期及是否有生育愿望可采取多样的个体化综合治疗。免疫检查点抑制剂相关性肺炎(immune checkpoint inhibitor–related pneumonitis,ICI-pneumonitis)定义为在患者接受ICI治疗后,胸部影像学出现新的浸润影,临床除外新的肺部感染或肿瘤进展等情况下,出现呼吸困难和(或)其他呼吸体征/症状(包括咳嗽和活动后气短等)[1]。本例患者为未婚无性生活史,初始诊断为IVB期宫颈透明细胞癌,经放疗及同步化疗治疗后仍有残留病灶,行免疫检查点抑制剂治疗后出现免疫检查点抑制剂相关性肺炎,经糖皮质激素治疗停药后症状再发,再次糖皮质激素治疗后治愈,对临床具有重要提示意义。
患者,女,31岁,2019年11月以"阴道不规律流血3个月"为主诉就诊我院。患者平素月经规律,呈7/30日型,经量正常,伴偶有轻度痛经,近3个月出现无明显诱因出现阴道大量流血,约既往月经2倍,患者口服自行止血药后流血减少,患者后再次出现持续性阴道流血,遂就诊。患者未婚,无性生活史无生育史。平素体健,无糖尿病及高血压史,无风湿免疫及甲状腺等疾病史,无肿瘤家族史,就诊时身高168 cm,体重55 kg。外院妇科超声提示宫颈区6.5 cm×5.9 cm×5.0 cm不规则低回声,边界欠清,周边及内部可见彩色血流信号。提示宫颈癌?妇科内诊:外阴发育正常,处女膜完整,单指诊阴道前壁上段2/3充满肿物,质硬,触之出血,肛诊:宫颈病灶6 cm×6 cm,左侧宫旁增厚,未达盆壁,右侧宫旁无异常。
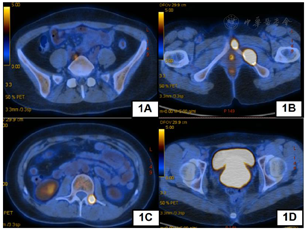
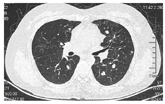
我院完善PET-CT提示宫颈FDG高代谢占位,较大截面约7.0 cm×6.0 cm,符合宫颈癌改变,伴阴道受累,请结合专科检查。右侧髂动脉后方FDG高代谢淋巴结,大小约1.2 cm×0.8 cm,转移可能大。腰2椎体左侧附件、左侧耻骨联合处及左侧耻骨下支转移瘤。子宫体形态欠规整,请结合相关检查(图1)。肿瘤标志物:CA125 46.57 U/ml,CA19-9 58.78 U/ml,SCC 0.5 ng/ml。结合患者妇科内诊及影像学检查综合考虑为宫颈癌,遂行超声阴道下经阴式宫颈肿物穿刺活检,病理提示(宫颈)考虑腺癌,组织少,建议术后免疫组化辅助诊断。

患者诊断为宫颈腺癌ⅣB期,后续拟行放疗等抗肿瘤综合治疗,但患者无性生活史,阴道外口缩窄明显,无法行腔内照射治疗,且病理建议进一步完善免疫组化除外特殊病理类型宫颈癌。综上建议患者行阴式探查术,切开处女膜,同时探查宫颈癌灶,患者及家属均同意手术方案。2019年11月25日于全麻下行处女膜切开+宫颈活检术,术后病理免疫组化:ER(80%+);PR(−);WT-1(−);NapsinA(+);HNF1B(+);P53(5%+);PAX8(+);Ki-67(50%+);Vimentin(−);P16(局灶+);提示宫颈透明细胞癌。
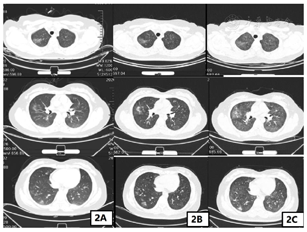
2019年12月5日—2020年2月13日行盆腔外照射(CTV 45 Gy/25 f,CTV 60 Gy/25 f)+阴道近距离放疗6 Gy×5 f,外照射放疗区域包括全子宫,全阴道,骨转移区,腹膜后、盆腔、腹股沟淋巴引流区,放疗期间行同步顺铂50 mg化疗6次。患者放疗及同步化疗结束后阴道穹窿及阴道前壁上1/3仍有残留病灶,建议患者补充全身静脉化疗,患者因自身对生活治疗要求高,坚决拒绝化疗。患者病理检测提示PD-L1阳性(CPS≥1),根据2020年NCCN指南及国内外临床试验PD-1抑制剂治疗推荐用于PD-L1表达阳性或MSI-H/d MMR表达的晚期宫颈癌的治疗,2020年3月13日—2020年9月1日行卡瑞丽珠单抗注射液200 mg,每2周1次,静脉滴注治疗,同时联合唑来磷酸抑制骨破坏。患者2020年7月30日使用卡瑞丽珠单抗10个疗程治疗后出现咳嗽,患者呼吸科就诊,口服止咳药及头孢抗炎治疗后咳嗽症状好转,无呼吸困难及气喘及气短症状,2020年8月14日完善胸部CT提示双肺多叶段新增多发斑片磨玻璃密度影,感染性病变?(图2A),结合患者病史及CT检查考虑为肺部感染可能性大,不除外免疫检查点抑制剂相关性肺炎,需密切监测患者症状及影像学检查。2020年8月16日行第11个疗程治疗后仍有咳嗽,但较前无明显加重,继续抗炎止咳治疗。2020年8月31日复查胸部CT提示双肺多叶段多发斑片磨玻璃密度影范围大致同前,部分密度较前增高,感染性病变?余胸部所见基本同前(图2B)。2020年9月1日行第12个疗程治疗,治疗后2 d患者出现气喘,进行性加重,治疗后7 d患者出现无明显自主咳嗽症状,刺激性气味可诱发咳嗽症状,不伴咳痰,静息状态下气喘尚可,体力活动后气喘加重,伴气短及呼吸困难,休息后可缓解,考虑患者为免疫检查点抑制剂相关性肺炎,遂急诊返院。2020年9月10日胸部CT提示双肺多叶、段模糊磨玻璃密度斑片影范围较前增多,请结合临床注意血管炎,药物性肺损伤?余胸部所见基本同前(图2C)。肺弥散功能提示肺总弥散量重度下降,单位弥散量轻度下降。肺通气功能提示重度混合性通气功能障碍,限制为主。免疫检查点抑制剂相关性肺炎美国国家综合癌症网(National Comprehensive Cancer Network,NCCN)指南[2]以临床结合影像学进行分级。具体标准:1级,无症状,病变局限于一叶肺或病变范围<25%的肺实质;2级,出现新的呼吸道症状或原有症状加重,包括气短、咳嗽、胸痛、发热,以及所需吸氧条件升高;3级,症状严重,病变累及所有肺叶或>50%肺实质,日常活动受限;4级,危及生命的呼吸损害。患者胸部CT提示双肺多叶、段模糊磨玻璃密度斑片影范围较前增多,病变累及部位>50%肺实质,结合患者症状诊断为免疫检查点抑制剂相关肺炎3级。

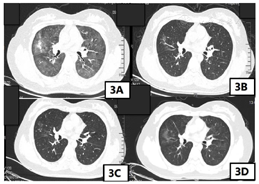
患者诊断为免疫检查点抑制剂相关性肺炎3级,根据《CSCO免疫检查点抑制剂相关肺炎的临床诊治建议》,对于2~3级的CIP,推荐使用1~2 mg/(kg·d)泼尼松的等效剂量激素治疗,可选择口服或静脉激素(泼尼松或甲泼尼龙),对于更严重者或急性病程者,首选静脉激素。对于激素的减量方法,推荐在观察到起始剂量[1~2 mg/(kg·d)]激素起效后(48~72 h),继续维持原剂量使用至7~14 d,随后开始逐步减量,控制整体疗程在6~8周,一般不超过12周。足量激素治疗时间建议最长不超过3周[3]。激素使用过程中需要注意监测相应的毒副作用。患者体重为65 kg,推荐使用65~130 mg泼尼松的等效剂量激素治疗,患者2020年9月11日—2020年9月13日甲泼尼龙注射液80 mg静脉输液治疗,患者症状明显缓解,无呼吸困难,活动后无明显气短,可自行上下楼梯,因患者较年轻,现放疗后人工绝经,患者及家属非常担忧骨质疏松,股骨头坏死等副作用,要求激素减量,2020年9月14日—2020年9月16日予甲泼尼龙注射液60 mg静脉输液治疗,2020年9月17日—2020年9月19日予甲泼尼龙注射液40mg静脉输液治疗,患者已无免疫检查点抑制剂相关性肺炎症状,改为口服激素治疗,2020年9月20日—2020年9月23日予美卓乐(甲泼尼龙片)8片口服(32 mg=泼尼松的等效剂量40 mg)治疗,2020年9月24日—2020年9月30日予美卓乐6片口服(24 mg=泼尼松的等效剂量30 mg),2020年10月1日—2020年10月7日予美卓乐4片口服(16 mg=泼尼松的等效剂量20 mg),2020年10月8日—2020年10月14日予美卓乐2片口服(8 mg=泼尼松的等效剂量10 mg),2020年10月15日—2020年10月21日予美卓乐2片口服(4 mg=泼尼松的等效剂量5 mg),共使用糖皮质激素治疗6周。其间复查胸部CT模糊斑片影较前明显缓解(图3)。糖皮质激素治疗期间予患者补充钙剂、维生素D3,骨化醇预防骨质疏松,质子泵抑制剂,膜固思达,洁维乐保护胃肠道黏膜,预防应激性溃疡。同时监测感染相关指标,监测血压、血糖、电解质等,患者大便真菌涂片及咽真菌涂片找到真菌孢子,予使用大扶康抗真菌感染治疗。

患者糖皮质激素停药后8 d,2020年10月29日患者再次出现胸部不适,通气不畅,吸入冷空气可诱发咳嗽,1 d后再次出现行走后呼吸费力及胸痛,患者急诊返院。完善胸部CT提示双肺多叶、段磨玻璃密度斑片影范围较前增大、密度较前增高(图4)。患者已完成糖皮质激素治疗,停药后再次出现目前免疫检查点抑制剂相关肺炎症状,因患者病情复杂,完善多学科疑难病例会诊,影像科会诊意见患者目前CT提示肺部以对称性、渗出性病变为主,纤维化不重,暂无间质性改变。此种肺部影像学变化常为过敏反应,药物反应及肺水肿,此患者考虑与药物性肺炎有关。目前患者病情反弹,考虑激素依赖,建议密切复查肺部HRCT。呼吸科会诊意见考虑免疫治疗相关肺不良反应可能性大,不除外过敏性肺泡炎。建议停用免疫治疗,复查总IGE及过敏原检查,变态反应原除外过敏反应。患者目前症状反复与糖皮质激素剂量有关,可适当延长糖皮质激素使用时间,建议复查结核相关检查。感染科会诊意见患者目前CRP、降钙素原不高,COVID19核酸多次监测阴性,不考虑细菌性肺炎,可行巨细胞病毒IGm、IGg,病毒载量及EBV病毒IGm、IGg,病毒载量检查及呼吸道病毒检测(痰液)除外病毒性感染,风湿科会诊意见密切复查肺CT,找到合适激素剂量维持,不除外药物反应,如药物延迟超敏反应。如患者症状持续进展,建议可上级医院会诊治疗,建议完善铁蛋白,总IgE,ANA,红细胞沉降率,大小系列,白介素,淋巴计数等检查。患者上述检查均无明显异常,综合会诊意见,考虑患者症状再发原因是激素依赖型,既往激素治疗过程中激素减量较快,继续予患者糖皮质激素治疗,此次需延长糖皮质激素治疗时间,缓慢减少糖皮质激素用量。2020年10月30日—2020年11月5日予美卓乐8片口服(32 mg=泼尼松的等效剂量40 mg),2020年11月6日—2020年11月12日予美卓乐6片口服(24 mg=泼尼松的等效剂量30 mg),2020年11月13日—2020年11月19日予美卓乐5片口服(20 mg=泼尼松的等效剂量25 mg),2020年11月20日—2020年11月26日予美卓乐4片口服(16 mg=泼尼松的等效剂量20 mg),2020年11月27日—2020年12月3日予美卓乐3片口服(12 mg=泼尼松的等效剂量15 mg),2020年12月4日—2020年12月10日予美卓乐3片与2片交替口服,2020年12月11日—2020年12月17日予美卓乐2片口服(8 mg=泼尼松的等效剂量10 mg),2020年12月18日—2020年12月24日予美卓乐2片与1片交替口服,2020年12月25日—2021年1月7日予美卓乐1片口服(4 mg=泼尼松的等效剂量5 mg),本次共使用糖皮质激素治疗10周。患者第2次糖皮质激素治疗后出现较严重副作用,包括水潴留,周身水肿,激素患者减量至美卓乐1片时患者仍需利尿剂治疗,皮质功能亢进综合征,体重增加(由激素治疗前65 kg增至68 kg),腹泻(诺如病毒感染)及便真菌感染,均予对症治疗。
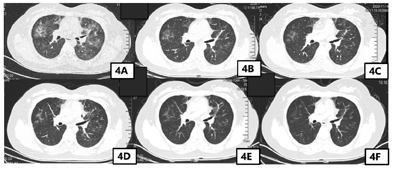

患者的第2次激素治疗后症状完全缓解,复查胸部CT肺部斑片影基本消失(图4)。第2次激素停药后长期随访无再发免疫检查点抑制剂相关性肺炎症状,免疫检查点抑制剂相关性肺炎治愈。
患者2021年6月出现下肢无力,逐渐下肢不能行走,腰背部脊柱两侧不适,无法弯腰,两侧髋部至大腿神经跳痛,腹部CT提示腰2左附件骨质破坏范围增大,左侧耻骨联合处转移瘤及左侧耻骨下支转移瘤同前。腰椎CT提示胸10至腰3椎体、附件及周围软组织多发肿块,注意转移瘤,腰2椎体压缩骨折伴邻近椎管受侵、狭窄。胸部CT提示双肺新增大小不等实性结节,转移需除外。患者虽然出现肺转移瘤,但无咳嗽,呼吸困难等症状,胸部CT既往免疫检查点抑制剂相关性肺炎斑片影未见显示(图5)。患者仍拒绝化疗,仅要求止痛及抗骨转移治疗。2021年10月15日复查胸部CT提示肺多发转移较前增大,口服安罗替尼治疗4个月,因血压升高头痛,患者拒绝继续用药,仅姑息止痛治疗。2022年8月11日患者死亡,患者免疫检查点抑制剂治疗停药后共存活23个月,无进展生存期为10个月,总生存期为37个月。

宫颈癌常见的病理类型为鳞状细胞癌及腺癌,高危型HPV持续感染是宫颈癌的主要危险因素,多个性伴侣、初次性生活<16岁、初产年龄小、多孕多产等与宫颈癌发生密切相关。宫颈透明细胞癌(clear cell adenocarcinoma cancer,CCAC)是一种罕见的宫颈恶性肿瘤,宫颈透明细胞癌的发病率约占宫颈腺癌的4%,发病原因可能与其宫内暴露于乙烯雌酚有关[4,5]。其发病年龄的高峰在15~29岁及40~54岁,呈双峰性,有很大一部分患者在诊断时为幼女或尚未生育[6,7]。需要注意的是其与宫颈鳞状细胞癌发病原因不同,长期以来对宫颈透明细胞癌的研究主要集中在个案。本例患者发病时31岁,无性生活史,此类患者阴道流血时临床往往考虑更多的是月经失调或子宫肌瘤等良性疾病,宫颈癌诊断较困难,且早期诊断及三级预防更加困难。此例患者初始诊断分期既为IVB期,病灶为7.0 cm×6.0 cm,且出现多发骨转移瘤,与患者为宫颈透明细胞癌的上述特点可能密切相关,而妇科恶性肿瘤分期与预后往往密切相关。本例也提示我们在临床工作中,对于年轻无性生活史女性阴道反复流血需警惕妇科恶性肿瘤的可能性,尤其是一些特殊或少见病理类型。宫颈癌诊断的金标准为病理确诊,临床常在阴道镜下活检,本例患者无性生活史,即使已经有PETCT提示宫颈癌,仍需患者及家属进行充分沟通行阴道镜检查完善病理明确诊断,本例患者阴道镜检病理不满意,考虑患者阴道外口缩窄明显,无法行腔内照射治疗,进一步行处女膜切开及宫颈活检术,最终明确宫颈透明细胞癌的诊断,同时完善了PD-L1的检测,为患者后续治疗方案的确定提供依据。由于CCAC发病率低,因此缺乏规范化的治疗方案,治疗方案与宫颈鳞状细胞癌基本相同,采用手术、放疗和化疗相结合的个体化综合治疗,具体治疗方案的选择主要取决于临床分期、肿瘤范围、生育要求等[8]。本例患者初始治疗虽为ⅣB期,但远处转移主要为骨的转移,骨转移区在放疗野区域内,故初始治疗选择放疗联合同步化疗治疗。
免疫治疗已经广泛用于临床治疗,目前使用最广泛的方法是使用针对阻断程序性死亡蛋白1(PD-1)来调节T细胞活化的重组单克隆抗体[9]。国内外大量临床试验均证明PD-1/PD-L1抑制剂治疗对持续、复发、转移的PD-L1阳性宫颈癌患者的获益,2022年NCCN指南更新将免疫检查点抑制剂与化疗的联合治疗更改为一线首选联合方案。免疫检查点抑制剂在改变肿瘤治疗方式的同时,随着应用的增加,免疫治疗相关不良反应的发生也随之增多。大部分免疫治疗相关的不良反应是可逆的,其中位发生时间为治疗开始后的2~16周内,具体时间与涉及的组织和器官有关[10]。与其他免疫相关性不良反应不同,免疫检查点抑制剂相关性肺炎发生的时间跨度非常大,它可以发生在患者接受治疗的任何时间段,且免疫检查点抑制剂相关性肺炎发生的时间相对较晚,中位发生时间在2.8个月左右,高发时间为15~31周,最晚发生时间可达85周[3,11]。本例患者2020年3月13日开始使用免疫检查点抑制剂治疗,2020年8月14日开始出现咳嗽,发生时间为用药后的第22周,为免疫检查点抑制剂相关性肺炎高发时间段,这也提醒我们免疫检查点抑制剂相关性肺炎不同于其他免疫治疗相关的不良反应,发生时间可能较晚,临床需在使用免疫检查点抑制剂时全程注意患者的症状。
免疫检查点抑制剂相关性肺炎是一种罕见但有致命威胁的严重不良事件,目前关于免疫性肺炎的发生机制尚未明确,但大多数认为可能与免疫系统的过度激活相关,我们在接受免疫治疗时,利用PD-1/PD-L1重新启动和激活T细胞,发挥识别和杀伤肿瘤细胞的活性,这个过程中由于T细胞过度活化和增殖导致大量炎症因子释放,攻击正常肺组织细胞,从而导致免疫性肺炎的发生[12]。临床试验报道的CIP的发生率大多在3%~5%,三级以上的肺炎发生率为0.67%[13,14,15,16,17]。而PD-1/PD-L1抑制剂治疗相关的总体死亡率为0.45%,其中以CIP引起的死亡最为常见,为28.0%[13]。因此免疫检查点抑制剂相关性肺炎是免疫检查点抑制剂治疗最严重的副作用之一。免疫检查点抑制剂相关性肺炎最常见的症状为呼吸困难、活动耐量下降及咳嗽,也可出现发热、胸痛等表现。如出现发热,或后期出现发热,更需要除外感染性肺炎的可能。病程上,可以表现为爆发性、急性、亚急性、慢性以及隐匿性病程等[18]。但由于其缺乏典型的临床特征,有1/3的患者发病时可能无症状。免疫性肺炎的影像呈多样性,主要为双肺磨玻璃影、斑片状实变影、小叶间增厚、网格影、牵拉性支气管扩张及纤维条索影等,其中磨玻璃影最为常见,发生率为73%~87%[19]。胸部CT特别是薄层CT有助于在免疫性肺炎相对可控可逆的早期及时发现并采取措施干预,但有些患者甚至肺部CT检查正常,却出现了严重的症状,影像不一定会及时反应新发病变,可能出现延迟特征。由于免疫性肺炎没有典型的影像学特征,所以在诊疗上需要大量经验和临床依据,再一点,因为晚期恶性肿瘤的复杂病情,患者全身免疫力低下、免疫抑制等诸多因素影响,非常容易罹患肺部感染。因此,如果没有确切的判断,草率使用大量激素是非常危险甚至是致命的,临床中不乏一些真菌、细菌感染的患者因为将感染性肺炎误判成免疫检查点抑制剂相关性肺炎后,使用大量激素造成感染病情迅速恶化致死的病例,因此免疫检查点抑制剂相关性肺炎诊疗的关键是用药前需排除肺部感染、肺部原发或继发恶性肿瘤进展、其他原因引起的肺间质疾病、肺栓塞、肺水肿等其他病变[20]。正因为免疫检查点抑制剂相关性肺炎临床表现具有非特异性,体征也缺乏特异性,实验室检查无明显特异性,临床鉴别除外感染难度大。本例患者初始出现在第10个疗程免疫检查点抑制剂治疗后出现咳嗽时我们首先继续了抗感染治疗,患者经过抗感染治疗后症状好转,且在第11个疗程和第12个疗程免疫检查点抑制剂治疗前我们均予患者复查胸部CT,仍未避免免疫检查点抑制剂相关性肺炎的发生,这些提醒我们在临床工作中对于使用免疫检查点抑制剂治疗的患者出现免疫检查点抑制剂相关性肺炎的症状,肿瘤科医生除密切关注患者症状及复查胸部CT外,需加强与影像科及呼吸科等专科医生的沟通,同时告知患者可能发生的症状及密切随访。
免疫检查点抑制剂相关性肺炎的治疗主要是根据肺炎的临床分级,这种分级很大程度建立在治疗药物相关性过敏性肺炎的专家意见的基础上。建议的治疗包括停用ICI,系统性使用皮质类固醇,以及附加免疫抑制治疗的各种不同的推荐。糖皮质激素是最常用治疗免疫检查点抑制剂相关性肺炎(尤其是3~4级)的药物,然而并没有临床实验数据,仅基于回顾性研究和医生的专业判断使用[21]。糖皮质激素治疗进一步抑制了免疫应答,增加了机会感染的风险[22]。但我们应该预见由于使用糖皮质激素可能导致的不良事件,尤其对于妇科恶性肿瘤患者,如本例患者为年轻女性,已经因放疗人工绝经,更年期症状较重,易患结核,水钠潴留,骨质疏松,自发性骨折,无菌性股骨头坏死,血糖升高,消化道溃疡,肥胖,机会性感染、睡眠障碍、高血压等,应该接受维生素D和钙补充剂,有时还需要预防性使用抗生素[23]。但目前激素的最佳的剂量、用药时间、类固醇难治型ICI-肺炎免疫抑制治疗的种类,还没有定义。除了罕见的类固醇难治型病例,肺炎恶化的反弹、重燃效应在一些没有持续使用皮质类固醇,缺少进一步治疗指导[21]。本例患者在第一次使用全程的激素治疗,激素停药后8 d就出现了再发,我们分析可能原因,虽然本例患者前期激素减量略快,但后期激素减量较缓慢,且使用了6周的激素治疗,基本符合免疫检查点抑制剂相关性肺炎诊疗意见,我们分析可能原因还有就是本例患者为激素依赖型患者,患者初始使用激素治疗后症状很快缓解,但患者整体激素治疗过程中副反应较大,患者在后期即使意见减量至美卓乐1片时,仍需利尿剂治疗患者水肿症状,在临床工作中对于激素较敏感患者我们要警惕患者亦可能出现激素依赖的可能。同时本例患者也提示我们免疫检查点抑制剂相关性肺炎激素治疗中及治疗后可能出现反弹、再发重燃,我们不仅要免疫检查点抑制剂相关性肺炎的治疗进行治疗前,治疗中,治疗后的全程监测。
目前免疫治疗相关的不良反应与疗效是否存在关联尚不确定,免疫治疗相关的不良反应的严重程度与疗效的关联也尚存在争议。免疫治疗相关的不良反应的发生提示患者的免疫处于激活状态,在不同类型的肿瘤中,免疫治疗相关的不良反应发生的毒性类似,这说明免疫治疗相关的不良反应的发生和免疫系统本身有关,而与肿瘤类型的关系不大。回顾性的研究认为出现免疫治疗相关的不良反应的患者,其对免疫检查点抑制剂的反应越明显,但免疫治疗相关的不良反应的出现并非发生有效反应的必需条件[24]。本例患者免疫治疗停药后共存活23个月,无进展生存期为10个月,对于复发性持续性宫颈癌患者,我们认为本例患者在仅完成12个疗程的免疫检查点抑制剂的治疗,此例患者疗效较好,但更多的数据有待于大规模临床数据及系统回归分析加以证实。严重免疫治疗相关的不良反应缓解后再使用免疫检查点抑制剂是否安全目前尚缺乏这方面的研究,但严重免疫治疗相关的不良反应缓解后,患者再次接受免疫检查点抑制剂治疗,免疫治疗相关的不良反应可能再度出现。NCCN、CSCO等指南建议在免疫治疗时,如果发生3~4级免疫检查点抑制剂相关性肺炎,则永久停药,本例患者因为患者本人坚决拒绝化疗治疗,后续患者疾病进展时我们考虑是否可换另一种免疫检查点抑制剂。影响患者再次使用免疫检查点抑制剂的关键因素很可能取决于末次免疫治疗相关的不良反应出现的程度、患者的一般状况以及是否存在其他治疗模式。对于一般的免疫治疗相关的不良反应可以对症处理,但是需要警惕或者重视的毒性是心脏、肺毒性,因为这些免疫治疗相关的不良反应往往是致命的[25]。考虑既往患者出现较严重的免疫检查点抑制剂相关性肺炎,且出现糖皮质激素停药后再发,患者复发时已出现腰椎骨转移,行走不便及骨痛,所以后续未再使用免疫检查点抑制剂,而是选择相对副作用小的口服抗血管生成药物安罗替尼抗肿瘤治疗。未来我们需要建立全国范围的登记机构或者组织,以记录患者接受治疗后不同免疫治疗相关的不良反应发生的真实世界数据,加强多学科在免疫治疗相关的不良反应处理方面的交流与合作,共同应对免疫治疗相关的不良反应。
陶陶,宫婷婷,高嵩,等.持续性宫颈透明细胞癌个体化治疗1例[DB/OL].中国临床案例成果数据库,2023(2023-03-23).http://journal.yiigle.com/LinkIn.do?linkin_type=cma&DOI=10.3760/cma.j.cmcr.2023.e01062.
所有作者均声明本研究不存在利益冲突



























