
例1男性,34岁,10个月前无明显诱因下出现头晕,半年前无诱因下出现左耳听力下降,呈进行性加重,1个月前出现左侧耳鸣。例2男性,31岁,10个月前无明显诱因下出现左耳突发性听力下降伴耳鸣。
例1及例2患者均双侧外耳道通畅,双侧鼓膜完整,双侧鼓室干燥,乳突无红肿。
两例患者听力下降明显伴耳鸣症状;CT检查示左侧内听道软组织病变伴内听道后壁下钙化灶。磁共振检查提示左侧内听道内软组织病灶,增强后病灶边缘斑点状明显强化,内部无强化;病理示病灶内见增厚扩大的静脉血管壁内衬覆扁平的血管内皮。
例1行全麻下"左侧迷路径路听神经肿物切除术+脑脊液修补术+腹部脂肪取出术";例2行全麻下行"左侧乙状窦后径路内听道占位切除术"。2例患者的前庭神经、面神经及蜗神经均保护完好。
2例手术后术后症状改善,无耳鸣及眩晕,无面瘫。门诊分别随访6年和4年,病灶均无复发。
影像科;耳鼻喉科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
血管瘤是头部常见的良性软组织病变之一。根据所含新生血管管腔大小及有无血管平滑肌成分,可将其分为:海绵状血管瘤、毛细血管瘤和静脉型血管瘤(venous hemangioma,VH)[1]。其中,海绵状血管瘤发病率最高,主要发生于皮下软组织深部;毛细血管瘤多位于皮肤表浅;VH的发病率最低,尤其是原发于内听道(Internal Auditory Canal,IAC)的VH(IAC-VH)更为罕见[2]。目前国内外关于IAC血管瘤的文献多为零星的个案病例,且病灶类型主要为海绵状血管瘤[3,4,5,6,7],极少有关IAC-VH的报道[1]。该病因不典型的发病部位极易误诊为听神经鞘瘤。我们回顾性分析2例本院经病理证实的IAC-VH病例的临床、影像表现及治疗,以提高对本病的认识。
例1,男性,34岁,主因"头晕10个月,左耳听力下降半年,伴耳鸣1个月"来诊。10个月前患者无明显诱因下出现头晕,无视物旋转,无走路不稳,无头痛呕吐,无听力功能下降及耳鸣;半年前无诱因下出现左耳听力下降,呈进行性加重,不伴恶心呕吐及头痛;1个月前出现左耳鸣,无耳闷,无耳部流脓及出血。否认家族遗传病史、手术外伤史。
例2,男性,31岁,主因"左耳突发性听力下降伴耳鸣10个月"来诊。10个月前患者无明显诱因下出现左耳突发性听力下降伴耳鸣,无头晕,无视物旋转,无头痛呕吐,无耳部流脓及出血。否认家族遗传病史、手术外伤史。
例1:专科查体:双侧外耳道通畅,双侧鼓膜完整,双侧鼓室干燥,乳突无红肿。电测听检查:左耳气传导(Air conduction,AC):98dBHL,骨传导(Bone conduction,BC):无反应。右耳AC和BC均正常(小于20dBHL)。声阻抗检查:双耳A型曲线。前庭功能和平衡态试验:动静态平衡及维持平衡能力本体觉、视觉、前庭觉正常;平衡功能良好。前庭诱发肌源性电位:左球囊前停下神经通路功能较右侧轻度减退,左椭圆囊前庭上神经通路功能较右侧轻度减退。眼震电图扫视、追踪、视动、凝视正常。温度试验双半规管功能对称,无优势偏向。面神经功能检查:正常。实验室检查均未见异常。
影像学检查:CT平扫示左侧IAC开口轻度膨胀伴软组织病灶,IAC后壁偏下见小片钙化灶。MRI成像示病灶位于左侧内听道深部,最大径约8 mm,未累及桥小脑角区。快速自旋回波(turbo spin-echo,TSE)序列的T1WI扫描上病灶呈略高信号,脂肪抑制TSE序列的T2WI上呈稍高信号。弥散加权图像上病灶未见扩散受限表现。注射钆喷葡胺造影剂行横断面T1WI增强扫描,病灶边缘见斑点状明显强化影,强化度接近血管的强化度,而病灶内部无明显强化。延迟3分钟后行冠状面T1WI增强扫描,病灶的强化范围及强化程度未见改变,亦未见向心性填充样强化改变(图1)。
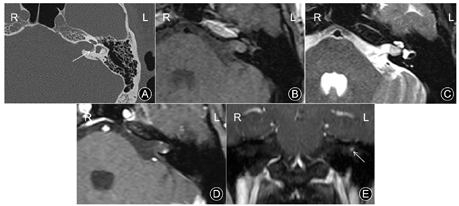

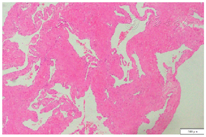
病理:(左侧内听道)送检病变组织中富于静脉血管,管腔扩张,部分管壁平滑肌较厚(图2),考虑血管瘤,静脉型。

例2:专科体检:双侧外耳道通畅,双侧鼓膜完整,双侧鼓室干燥,乳突无红肿。电测听检查:左耳AC:76 dBHL,BC未引出。右耳AC:15 dBHL,BC:10 dBHL。听觉脑干诱发电位(ARB):左耳阈值85 dBnHL,右耳阈值25 dBnHL。听性稳态反应检查(ASSR):左耳250 Hz 25 dBnHL,500 Hz 65 dBnHL,1 KHz 80 dBnHL,2 KHz 60 dBnHL,4 KHz 55 dBnHL;右耳250 Hz 10 dBnHL,500 Hz 15 dBnHL,1 KHz 5 dBnHL,2 KHz 10 dBnHL,4 KHz 20 dBnHL。声阻抗检查:双耳均A型曲线。前庭功能和平衡态试验:温度试验示双侧半规管功能不对称,左侧减弱。动静态平衡测试显示前庭觉不足,总体平衡功能稍差。面神经功能检查:正常。实验室检查:乙肝病毒表面抗体阳性。血常规:中性粒细胞百分比:46.9%。
影像学检查:CT平扫示左侧IAC后壁下钙化灶隆起,致IAC狭窄。MRI成像示病灶最大径约6 mm,未累及桥小脑角区。TSE序列的T1WI扫描上病灶呈略高信号,脂肪抑制TSE序列的T2WI上呈稍高信号。弥散加权图像上病灶未见扩散受限表现。注射钆喷葡胺造影剂行横断面T1WI增强扫描,病灶边缘见斑点状明显强化影(图3),延迟后冠状面T1WI增强扫描强化范围未见明显变化。
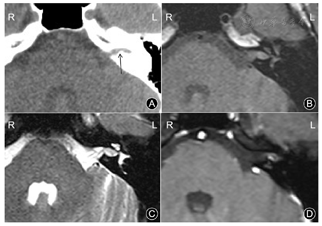

病理:(左侧内听道)送检组织切面灰红色,镜下见增厚扩大的静脉血管壁,内衬覆扁平的血管内皮,部分血管腔内见散在红细胞,考虑静脉型血管瘤,周围伴骨组织。
诊断:结合患者的临床特征、影像表现及术后病理结果,2例均诊断为内听道血管瘤(静脉型)。
鉴别诊断:
1.听神经鞘瘤:IAC最常见的良性肿瘤,女性稍多见,病程缓慢,病灶直径常大于1 cm,易累及桥小脑角区。CT上见IAC扩大及骨质吸收,钙化少见;MRI上T1WI呈等或稍低信号,易伴囊变坏死;增强后病灶实质明显强化,无边缘强化征。
2.颈静脉球体瘤:多见于中年女性,临床表现为患侧同脉搏跳动一致性的耳鸣及听力下降,体检见鼓室内樱桃红色新生物。CT上见颈静脉孔区扩大伴不规则骨质吸收。MRI上见典型的"胡椒盐征",增强后病灶富血供明显强化。
3.颞骨巨细胞瘤:早期无症状,随着肿块增大可出现肿胀疼痛,耳鸣,听力减退,耳朵流脓及面瘫等。CT上表现为皂泡状、蜂窝状膨胀的透光区伴线状分隔。
4.脑膜瘤:病灶通常较大,易同时累及IAC和桥小脑角区,CT上见IAC及周围弥漫骨质增厚硬化,MRI上病灶呈等T1等T2信号,增强后中等度强化伴"脑膜尾"征有助于鉴别。
例1:全麻下行"左侧迷路径路听神经肿物切除术+脑脊液修补术+腹部脂肪取出术"。左侧耳后切口,乳突切开,乙状窦、脑板、颈静脉球、面神经垂直段、半规管均轮廓化,切除三个半规管、开放前庭,内听道轮廓化。双极电凝窦脑膜角脑膜,切开内听道脑膜,面神经监护仪定位内听道面神经,肿瘤位于内听道底部,开放内听道,磨除内听道上下后270°骨质,暴露内听道硬脑膜,定位面神经后切除肿瘤,肿瘤质地偏韧。再次探查面神经解剖完整,电刺激反应正常。之后腹部取脂肪,封闭内听道周围气房。术腔内罗氏芬冲洗,取腹部脂肪填术腔,鼓窦入口肌肉填塞。
例2:全麻下行"左侧乙状窦后径路内听道占位切除术"。左侧乳突后弧形切口,颅骨钻孔铣下枕骨鳞部,暴露横窦、乙状窦及结合部。切开硬脑膜放枕大池脑脊液,脑压下降后将小脑半球稍向内牵开,暴露内耳门,见内听道内口无明显肿瘤,磨除内听道后壁,见内听道后、下壁骨质局部增生内含较多血管组织,内听道外侧部扩大,内听道后下壁增生的骨质突入内听道内,压迫神经。切开内听道硬膜,见硬膜下有紫红色肿瘤与前庭神经粘连,肿瘤与硬膜外增生的异常骨质相连。分离肿瘤与前庭神经的黏连,将肿瘤连同相连的骨质、硬膜整块全切。前庭神经、面神经及蜗神经均保护完好。取肌肉以生物胶封闭内听道。取人工脑膜缝补硬膜。
例1:术后10 d,全身一般情况可,伤口无明显红肿渗出,无发热,无耳鸣及眩晕,无面瘫及复视。门诊随访6年,无复发。
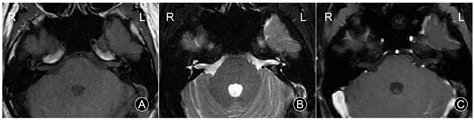
例2:术后1周,恢复可,伤口无明显红肿渗出,无发热,无耳鸣、眩晕,无面瘫,抬头看高时稍有复视。术后6个月复查耳部MRI平扫+增强示,内听道未见异常强化软组织灶占位(图4)。门诊随访4年,无复发。

IAC血管瘤发病率极低,目前国内外文献中报道的病例总共约60例,其中绝大多数病例均为海绵状血管瘤,而有关IAC-VH的病例迄今为止仅报道了2例[1,2,3,4,5,6,7,8]。IAC血管瘤起源于IAC的前庭神经节(即:Scarpa's神经节)周围神经外膜的毛细血管床,随着肿瘤的生长,神经干的血液供应减少,故易产生明显的神经缺血症状。不少学者[1,3]认为,IAC血管瘤具有典型的神经内浸润生长方式,即:病灶即便体积很小,也可早期累及内听道的神经,引起临床上较严重的、进行性的感音神经性耳聋、耳鸣、眩晕或面瘫等症状。本文2例IAC-VH患者产生第Ⅷ神经受累症状的持续时间均在一年内,较其他IAC良性病变(如听神经鞘瘤)的进程更短。病变的最大径均小于1 cm,且未累及桥小脑角区,与Omojola MF等[6]既往描述的IAC血管瘤呈小体积、范围局限的特点相同。
文献报道[3]IAC血管瘤高发于中年人,中位年纪38岁。本组2个病例的发病年龄为31及34岁,与文献结果相近。镜下,VH病变内可见明显扩大畸形的静脉血管壁,血管壁由疏松聚集的梭形细胞和增厚的血管平滑肌细胞组成,周围见胶原-黏液样细胞外基质,符合VH的典型组织病理学表现。
关于IAC血管瘤的影像特征方面,Zhu等[3]曾对6例IAC海绵状血管瘤的CT进行研究,发现病灶在CT上主要表现为IAC的增宽伴病灶区的钙化灶。本组2例IAC-VH在CT上均发现了位于IAC后壁下的不规则钙化灶,甚至当钙化灶较大时可致IAC局部狭窄,这种特征性表现亦在手术中得到了证实。而这种钙化灶却在IAC听神经鞘瘤中很少见到。MRI检查示,2例IAC-VH在T1WI上均呈稍高信号,脂肪抑制T2WI上呈稍高信号,且病灶内未见明显的囊变坏死,与Pappas DG等[9]既往观察IAC海绵状血管瘤的MRI平扫特征类似。DWI上,病灶内未见扩散受限表现。注射造影剂后行增强扫描显示,2例病灶的边缘均见斑点状的显著强化影,而病灶内部未见明显强化。该征象作为IAC-VH特征性的强化表现,在IAC神经鞘瘤中很少见,故2例病灶术前MRI诊断中均被考虑为IAC血管瘤的可能性更大。延迟3分钟后行冠状面增强示,病灶的强化范围与横断面相仿,未见类似于海绵状血管瘤样的典型"向心性填充样强化"改变,以此可同IAC海绵状血管瘤相鉴别。
鉴于IAC血管瘤以神经内浸润的方式生长,即使肿瘤很小,也易较早产生明显的听神经和/或面神经功能障碍,故已有学者[3]提倡,对该病不应长期随访观察,应采用比听神经鞘瘤更积极的治疗方案,即一经初诊发现或怀疑就尽早手术,从而最大程度保留并提高面神经和听觉神经功能。本组2例IAC-VH患者术前已有重度感音性耳聋,但尚未发生面瘫,术中发现病灶未累及面神经,但1例前庭功能轻度受损者术中见肿瘤与前庭神经粘连生长,完整切除肿瘤后患者的耳鸣消失,面神经功能保持完整,分别随访6年及4年后病灶无复发,亦无面瘫等并发症发生。
综上所述,IAC-VH通常较小(最大径小于1cm且局限于IAC内),但患者听力下降、耳鸣的神经受累症状明显,部分可伴前庭功能不足及面瘫;CT上IAC壁下钙化;MRI上T1WI及T2WI稍高信号,增强后边缘斑点状显著强化表现均对该病诊断有较大提示价值,最终确诊有赖于组织病理学检测;及早手术完整切除病灶并保护内听道的神经是其重要的治疗方式。
林奈尔,贾贤浩,张旖吟,等.内听道静脉型血管瘤的影像学及临床表现2例[DB/OL].中国临床案例成果数据库,2023(2023-05-15).http://journal.yiigle.com/LinkIn.do?linkin_type=cma&DOI=10.3760/cma.j.cmcr.2023.e01422.
所有作者均声明本研究不存在利益冲突



























