
患者,女,60岁,主因"间歇性上腹痛2个月"入院,既往因胃癌行根治性胃切除术。入院后完善相关检查,腹部增强CT和腹部超声可见胰腺颈部一枚肿瘤。开腹探查后,未发现胃癌转移迹象,选择术中超声引导下射频消融作为胰腺肿瘤的治疗方法。术中穿刺活检,病理回报确诊为胰腺导管腺癌。8个月后随访增强CT中发现肿瘤复发,并进行再次消融。患者术后随访至今8年余,未见明显肿瘤进展迹象。
体温36℃,脉搏76次/min,血压135/80 mmHg(1 mmHg=0.133 kPa),呼吸18次/min,未见皮肤或巩膜黄疸。右上腹偏中线深压痛。
腹部超声提示胰颈前上方可见一3.6 cm×2.9 cm低回声肿块,边界不清,形态不规则。腹部强化CT提示胰腺颈部与胰头交界处可见不均匀强化团块,与肝总动脉关系密切。实验室检查发现CA19-9水平显著升高至74.57 U/ml,CA-50水平显著升高至111.92 U/ml。
开腹探查术,术中超声引导下射频消融,术后禁食水、抑酸、抑制胰液分泌,经皮经肝穿刺引流,重复消融,介入栓塞止血。
首次射频消融后8个月腹部增强CT发现肿瘤复发,重复消融后,随访至今8年,患者恢复良好,强化CT未见肿瘤进展。
超声科;普通外科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
全球范围内每年约有340 000患者被诊断出胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC),且患者五年总生存率低于10%[1,2]。根治性切除是治愈PDAC的唯一机会,但只有不到20%的患者有切除机会,近70%患者局部进展或已发生转移[3]。目前,对于局部进展期胰腺癌患者理想的治疗方法尚未达成共识。射频消融(radiofrequency ablation,RFA)作为PDAC的辅助治疗方法已引起关注,其是一种局部热消融技术,已广泛用于治疗实体肿瘤。本文报道1例局部进展期胰腺癌患者成功接受2次开腹RFA治疗并存活超过8年的病例。
患者,女性,60岁,近2个月间歇性上腹部不适,包括食后上腹部饱胀不适、上腹部隐痛以及腰背部放射痛等。自发病以来,患者体重减轻5 kg,食欲不振,睡眠不佳。患者既往高血压病史4年,最高达150/90 mmHg(1 mmHg=0.133 kPa),糖尿病史2年,冠心病史4年,胃癌根治术(毕Ⅱ式)后4年,术后化疗3次,未见肿瘤复发或转移迹象。
体格检查:体温36℃、脉搏76次/min、血压135/80 mmHg、呼吸18次/min钟,未见皮肤或巩膜黄疸。右上腹偏中线深压痛。
实验室检查:总胆红素和结合胆红素正常,CA19-9水平显著升高至74.57 U/ml(参考范围,0~30 U/ml),CA-50水平显著升高至111.92 U/ml(参考范围,0.6~16.3 U/ml)。
腹部超声提示胰颈前上方可见一3.6 cm×2.9 cm低回声肿块,边界不清,形态不规则;此外,提示胆总管轻度扩张以及胆囊多发结石。腹部强化CT提示胰腺颈部与胰头交界处可见不均匀强化团块,与肝总动脉关系密切(图1)。
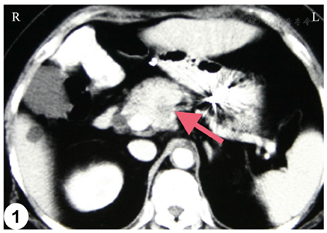

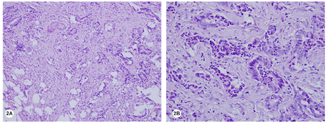
结合胸部CT和胃镜,可初步排除胃癌复发和转移。综合影像学报告和辅助检查,初步诊断为胰腺癌、胆囊结石和胆囊炎。术中超声显示肿瘤大小为4.0 cm×3.5 cm,包绕并侵犯肝总动脉根部;肿瘤经穿刺活检证实为低分化PDAC(图2)。

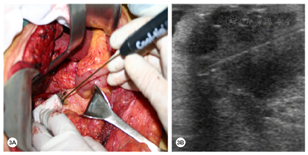
患者来本院寻求手术治疗,遂决定行开腹手术。开腹探查发现胰颈部可见一质硬实性肿块,向胰腺上缘突出。结合术中情况,患者无胃癌复发迹象,肿瘤与肝总动脉、肝固有动脉及胃十二指肠动脉关系密切,考虑难以行手术切除,因此决定行术中超声引导下RFA治疗。Kocher钳游离胰头和十二指肠。患者曾接受过根治性胃切除术,因此游离胰腺上缘的膜性粘连。分离肝十二指肠韧带右缘,冷湿纱布覆盖周围组织器官,充分暴露胰头和胰颈。采用Cool-tip™ RFA系统以及冷循环电极(17-gauge)(图3A)。然后在术中超声引导下将射频电极精确地插入肿瘤内(图3B)。启动后设置手动功率输出,从40 W开始,随后将功率以10 W/min速率增加,以90 W的最大功率进行肿瘤消融,共消融3点次(每次6~10 min)。于胰体及winslow孔置管引流(图4)。术后予以抗感染,抑酸,抑制胰腺分泌对症支持治疗。

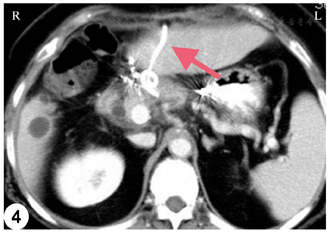

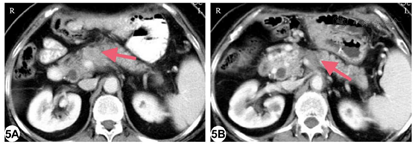
术后第11天患者并发胰瘘,引流管中持续引出胰液,颜色尚清,最大量接近500 ml/d。后出现引流不通畅情况,给予患者经皮经肝穿刺置管引流、禁食禁水、胃肠外营养等治疗。患者恢复顺利,于术后第44天带管出院。1个月随访增强CT肿瘤完全灭活。手术后约8个月随访增强CT显示胰体局部肿瘤复发以及脾静脉受累(图5A)。患者一般情况良好,无肿瘤远处转移。患者于11月17日再次接受开腹RFA,在IOUS引导下将射频电极精确置入肿瘤,手动射频条件与先前相同,进行两点次消融(分别为8、6min)。术后患者再次出现胰瘘,引流通畅,随后并发腹腔出血,通过介入栓塞治疗后停止。腹腔引流逐渐减少,拔除引流管后无不适,患者出院。患者在术后8年状况良好,无肿瘤复发迹象(图5B)。

近年来,针对无远处转移的局部进展期胰腺癌患者,各种消融治疗方法已被应用于临床,包括RFA、微波消融、冷冻治疗、不可逆电穿孔、高强度聚焦超声和立体定向放射治疗[4,5,6,7,8]。各种技术可分为两大类:(1)热消融方法;(2)非热消融对肿瘤细胞造成直接损伤的方法。这些姑息治疗方法的治疗效果与引起病灶内坏死、细胞溶解和细胞死亡最终导致肿瘤细胞减少有关。RFA、微波消融、不可逆电穿孔、冷冻消融、放射治疗和高强度聚焦超声的临床数据表明,这些方法对于无法手术切除的胰腺癌患者可以相对安全地控制局部肿瘤进展。由于更细的电极直径和非热作用机制,不可逆电穿孔在保护邻近的大血管和神经方面可能具有优势[9]。然而,不可逆电穿孔治疗效果会因肿瘤大小的增加而受到限制,并且随着电极数量的增加,手术将变得更具挑战性[10]。
本例由于开腹手术进行良好的暴露,避免了对空肠、结肠、大网膜等周围器官的损伤。Spiliotiset等[11]报道5例不能手术的胰腺癌患者经开腹RFA的预后良好。Varshney等[12]报道3例局部进展期胰腺癌患者接受开腹RFA,结果显示是安全可行的。另外,大量文献报道了术中超声引导在消融过程的重要性,一是术中超声可以确保病灶的精准定位;二是可以实时监测达到最大消融边界时手术的安全性。值得注意的是,由于血流的"热沉降效应",大血管附近的肿瘤难以完全清除。由于本例患者胰腺肿瘤紧邻粗大动脉血管,更高的消融功率用来对抗血管的热沉效应,尽量避免不完全消融。此外,本例的研究主要针对开腹RFA,近期也有文献报道了微创消融的可行性,的确可以降低开腹手术相关并发症的发病率,但射频电极放置的准确性却降低[5,13]。因此,内镜超声引导或经皮RFA的安全性以及是否能够达到开腹RFA相同的有效性仍需进一步研究。
本例患者在RFA后2次出现胰瘘,第2次手术后出血,表明消融后并发症概率仍然很高。本例术后胰瘘是由于RFA术后胰液从微小胰管漏出所致,开腹RFA后置管引流并保持通畅至关重要。据报道可以通过烧灼针道、在创面喷洒蛋白凝胶和使用生长抑素来预防胰瘘的发生[14]。值得注意的是,RFA引起的胰瘘在主胰管畅通的情况下,经保守治疗可在1个月内得到控制。根据文献报道,有2个高危因素可能导致RFA术后出血,一是RFA治疗过程中可能会损伤血管;另一个原因是RFA导致胰管破裂,造成胰液渗出腐蚀周围血管形成出血[15,16]。一项较早的研究报道16例局部进展期胰腺癌患者接受RFA,存在相对较多并发症,包括:胰瘘、急性胰腺炎、十二指肠溃疡以及门静脉血栓形成等,且死亡率约为25%[16]。因此,仍需要更大样本量的前瞻性研究用于探索消融后并发症相关的影响因素。
综上所述,针对局部进展期、不可切除且无转移的胰腺癌,RFA是一种可行的治疗方法,可灭活肿瘤并提高患者生活质量。术中超声引导至关重要,其可以确保RFA手术的安全性和可行性,且不会对相邻的血管和消化管道造成损伤。在某些病例中,对局部复发肿瘤采取再次RFA可能会延长患者生存期,但需要进一步研究来验证治疗局部进展期胰腺癌患者策略,使患者获得最佳的预后。
丁建民,张嘉懿,经翔.局部进展期胰腺癌患者经重复开腹射频消融治疗的长期生存1例[DB/OL].中国临床案例成果数据库,2023(2023-05-26).http://journal.yiigle.com/LinkIn.do?linkin_type=cma&DOI=10.3760/cma.j.cmcr.2023.e01515.
所有作者均声明本研究不存在利益冲突



























