
患者,女性,66岁。腹胀伴纳差2个月。检查发现肿瘤标志物异常升高,拟"卵巢恶性肿瘤可能"入院后行初次卵巢肿瘤减灭术,术后病理提示原发性卵巢黏液腺癌,术后予以TC方案化疗。
腹胀伴纳差2个月。查体:腹部膨隆,呈蛙状腹,移动性浊音阳性。
行手术+病理+影像学检查确诊。
行手术+化疗。
患者术后至今已行2次化疗,一般情况好,无不适主诉
妇产科;肿瘤科

版权归中华医学会所有。本文为遵循CC-BY-NC-ND协议的开放获取文章。
卵巢癌是病死率最高的妇科恶性肿瘤,高级别浆液性癌(high-grade serous carcinoma,HGSC)是最常见的组织学亚型,而黏液性卵巢癌(mucinous ovarian carcinoma,MOC)是偶发性的,最新数据显示MOC的患病率约为3%,属于罕见病[1,2]。本例患者的症状、体征、辅助检查、术中探查所见都比较符合常见的HGSC,但病理结果却提示MOC。在临床工作中,诊断MOC具有挑战性,对MOC的治疗尚无共识。通过对该患者的诊治过程的分析研究,有助于为确定原发性MOC患者的治疗策略提供参考。
患者,女性,66岁。因"腹胀伴纳差2个月"入院。患者2个月前自觉腹胀,饭后加重伴食欲减退,近1周尿量明显减少,无恶心、呕吐,无发热,无排便习惯改变等。2022年7月22日我院查腹部B超提示:腹腔大量积液。下腹部增强CT提示:腹腔、腹膜多发种植转移灶并可疑累及右侧邻近腹壁,最大病灶位于右上腹,约11.6 cm×4.8 cm,腹腔积液。考虑卵巢恶性肿瘤可能收治入院。
患者既往有高血压病史5年,平素服用氨氯地平每日1片,血压控制120~140/80~100 mmHg(1 mmHg=0.133 kPa)。1981年因"卵巢子宫内膜异位囊肿"在我院行开腹一侧附件切除,保留的卵巢亦为子宫内膜异位囊肿,未予处理;1984年12月剖宫产。1995年因"多发子宫肌瘤"行次全子宫切除术+一侧卵巢部分切除术;2019年因胆囊炎(泥沙样结石)于华山医院行多孔腹腔镜下胆囊切除术。
生育史:患者1-0-1-1,1984年剖宫产一女,体健;否认家族肿瘤遗传病史。
肿瘤指标异常升高CA199 67.2 U/ml,CA125 471 U/ml,CA724 27.5 U/ml,CA153>300 U/ml,CA50 61.96 IU/ml,HE4 804 pmol/L,D-二聚体13.87 mg/L。
⑴胃镜(华山医院):胃窦炎(糜烂型,中度)。胃窦后壁活检病理:轻度慢性非萎缩性胃炎;肠镜:结直肠多发息肉,病理:乙状结肠增生性息肉,直肠管状腺瘤,降结肠管状腺瘤;⑵腹部增强CT(2022年7月27日):腹腔、腹膜多发种植转移灶并可疑累及右侧邻近腹壁,腹腔积液,盆腔多发种植转移灶,腹盆腔积液;⑶计算机体层血管成像(CT angiography,CTA)(2022年7月28日):右肺上动脉内少许栓塞;⑷正电子发射计算机断层显像/计算机断层显像(positron emission tomography/computed tomography,PET-CT)(华山医院2022年7月29日检查):大网膜、腹盆腔肠系膜、腹膜、肝脾包膜多发病灶(部分伴软组织影形成),伴FDG代谢不均匀异常增高,结合病史,考虑恶性肿瘤可能性大,建议右下腹腔大网膜病灶活检。双侧内乳及心膈角淋巴结FDG代谢轻度增高,考虑肿瘤浸润不能除外;腹盆腔大量积液。
2022年7月28日血气分析:基本正常。
卵巢恶性肿瘤肺栓塞乙状结肠增生性息肉直肠管状腺瘤降结肠管状腺瘤糜烂性胃窦炎高血压病。
⑴患者66岁,腹胀伴纳差2个月余;⑵体检发现腹盆腔大量腹水,移动性浊音阳性,右下腹巨大包块;⑶2022年7月26日肿瘤指标异常升高:CA199 67.2 U/ml,CA125 471 U/ml,CA724 27.5 U/ml,CA153 >300 U/ml,神经元特异性烯醇化酶19.2 ng/ml,偏高,CA50 61.96 IU/ml,HE4 804 pmol/L;⑷影像学检查:2022年7月29日华山医院PET-CT检查:大网膜、腹盆腔肠系膜、腹膜、肝脾包膜多发病灶(部分伴软组织影形成),伴FDG代谢不均匀异常增高(图1),结合病史,考虑恶性肿瘤可能性大,建议右下腹腔大网膜病灶活检。双侧内乳及心膈角淋巴结FDG代谢轻度增高,考虑肿瘤浸润不能除外。腹盆腔大量积液。
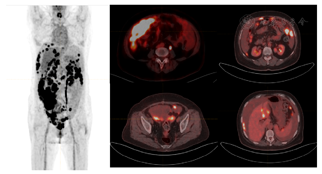

卵巢转移性肿瘤:患者盆腔巨大包块伴腹水,需考虑消化道来源转移性肿瘤。2022年1月26日华山医院胃镜:胃窦炎(糜烂型,中度)。胃窦后壁活检病理:轻度慢性非萎缩性胃炎。肠镜:结直肠多发息肉,咬除病理:乙状结肠增生性息肉,直肠管状腺瘤,降结肠管状腺瘤。胃肠镜检查结合PET-CT消化道来源转移性肿瘤可能性较小。
手术+化疗。
患者于2022年8月4日8:35-14:30全麻下行手术治疗。术中所见:血性腹水约2000 ml。
⑴上腹部:肝膈面、脾膈面及小网膜见散在粟粒样肿瘤0.5~1.0 cm,肝包膜未及明显肿瘤,肝门淋巴结未及明显淋巴结肿大。胆囊已切除,未见明显病灶。脾胃韧带散在粟粒样肿瘤0.5~2.0 cm,脾包膜未及明显病灶。
⑵中腹部:大网膜密布结节状肿瘤病灶,与右半结肠粘连呈饼状,约15 cm×15 cm。肿瘤包裹升结肠呈饼状;横结肠、降结肠、回盲部浆膜面、系膜面散在粟粒样肿瘤0.5~1.0 cm,小肠浆膜面、系膜面偶见粟粒样肿瘤0.5 cm。
⑶盆腔:子宫缺如;左附件缺如;右卵巢周围包裹性积液,周围密布肿瘤结节1-2cm融合成片约5 cm×5 cm;直肠前壁腹膜密布肿瘤结节约1~2 cm融合成片,乙状结肠系膜面偶见粟粒样肿瘤约0.5 cm,盆腔最大病灶2~5 cm。
⑷腹膜:腹壁腹膜散在粟粒样肿瘤0.5~1.0 cm,左侧结肠旁沟腹膜偶见粟粒样肿瘤0.5 cm,右侧结肠旁沟腹膜密布结节肿瘤病灶,与右半结肠粘连呈饼状,子宫直肠窝密布肿瘤结节1~2 cm融合成片,膀胱腹膜反折密布肿瘤结节1~2 cm融合成片,最大病灶2~5 cm。
后腹膜淋巴结未及明显肿大;腹主动脉旁淋巴结未及明显肿大;盆腔淋巴结未及明显肿大(图2,图3,图4,图5)。
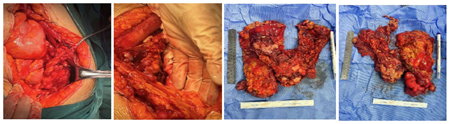

手术方式:初次卵巢肿瘤细胞减灭术(右卵巢切除术+大网膜切除术+右半结肠切除吻合术+脾胃韧带病灶切除术+小网膜肿瘤病灶切除术+右侧结肠旁沟肿瘤切除术+盆底腹膜肿瘤切除术+肝圆韧带肿瘤切除+肝镰状韧带肿瘤切除术)。
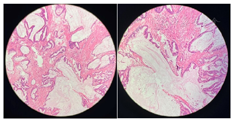
病理报告:腹腔肿瘤组织病理:转移性或浸润性黏液腺癌,免疫组化(瘤细胞):CKpan(+),CEA(+),CDX-2(少量+),Ki67(90%阳性),P53(约10%+),CA125(弱+),Inhibin-α(+),CK7(+),CK20(-),WT-1(-),ER(-),PR(-),P16(-);SMA(平滑肌+);部分肠管+肿瘤组织+大网膜:浸润性或转移性黏液腺癌,癌组织主要累及结肠浆膜层,极少量累及结肠肌层,结肠切缘、回肠切缘均未见癌累及。阑尾浆膜层和肌层见黏液腺癌累及。肠周检出8枚腺癌结节。免疫组化(瘤细胞):CDX-2(-),CEA(+),CK7(+),CK20(-),P53(10%+),P16(个别+),ER(-),PR(-),CA125(-),WT-1(-),Desmin(肌层+)。右卵巢+盆底肿瘤组织、部分肝圆韧带、肝镰状韧带、腹腔肿瘤组织、浸润性或转移性黏液腺癌(图6,图7)。

基因检测:gBRCA阴性,sBRCA阴性、HRD阴性。
术后考虑卵巢原发黏液性腺癌,予以TC方案(紫杉醇静脉+卡铂腹腔)化疗2程。
⑴2022年8月18日予以紫杉醇288 mg静滴+卡铂350 mg腹腔;⑵2022年9月16日予以白蛋白紫杉醇421 mg+卡铂526 mg静滴化疗(因第一次化疗紫杉醇过敏,故改为白蛋白紫杉醇)于2022年9月17日予以贝伐珠单抗412 mg静滴治疗。
患者术后至今已行2次化疗,一般情况好,无不适主诉,睡眠可、胃纳可、二便正常。2022年8月18日第一次化疗注射紫杉醇期间出现胸闷、气促、心动过速过敏反应,化疗后一周出现Ⅳ度骨髓抑制伴发热,故第二次化疗改为白蛋白紫杉醇+卡铂。
2022年9月15日肿瘤指标:CA153 186 U/ml,CA199 40.6 U/ml,CA125 140 U/ml,CA724 10.9 U/ml,HE4 193 pmol/L。
2022年10月6日肿瘤指标:CA153 127 U/ml,CA199 21 U/ml,CA125 27.5 U/ml,CA724 18.3 U/ml,HE4 148 pmol/L。
上皮性卵巢癌(epithelial ovarian carcinoma,EOC)是最常见的卵巢癌组织学类型。根据分子和临床病理差异,EOC被分为1型肿瘤,包括低度浆液性癌、子宫内膜样癌、透明细胞癌和黏液性卵巢癌(MOC)以及2型肿瘤,其中包括高级别浆液性癌(HGSC)[3,4]。原发性MOC被归类为1型肿瘤,它被认为是一种非侵袭性的组织学亚型。以往一些研究认为,原发性黏液性癌占上皮性卵巢癌的10%~15%。然而,这一数据随着近年来病理认识的更新,既往认为是原发性黏液性癌中有50%~70%实际上是从其他部位转移的。而原发MOC的真实比例接近1%~3%,MOC是一种罕见的肿瘤[1,2]。临床和病理医师诊断MOC都具有挑战性。
MOC多见于20~50岁女性,80%的患者诊断时为早期,临床表现为腹盆腔巨大的囊实性占位,可出现压迫症状,晚期症状可有腹水等。本例患者66岁,曾在28岁时因子宫内膜异位症切除一侧卵巢,39岁时因"子宫肌瘤"切除次全子宫和另一侧部分卵巢切除术,此后每年规律体检,未发现异常,直至2022年4月出现腹胀症状。该患者的起病过程与MOC不符。
MOC通常与CA125,CEA和CA19-9的水平升高有关。癌胚抗原(CEA)是术前鉴定MOC的最有价值的肿瘤标志物。尽管三分之一的卵巢癌中有CEA升高,但MOC中的CEA升高(88%)比非黏液性卵巢癌(19%)可能更高。但该患者术前CA199 67.2 U/ml(升高) ,CA125 471 U/ml(升高),但CEA 3.09 ng/ml(正常),该患者的肿瘤标志物特点与MOC不符。
MOC经常与消化道来源的转移性卵巢黏液腺癌相混淆。正常的黏液上皮细胞包括三种类型的分泌黏液的细胞,它们排列在胃,子宫颈内膜和肠上。正常的卵巢组织不包括任何黏液分泌细胞。大约80%的卵巢黏液癌是转移性的,大约80%的原发性肿瘤是Ⅰ期。转移到卵巢的最常见原发部位是:胃肠道45%,胰腺20%,18%来自子宫颈和子宫内膜,8%来自乳腺[5,6]。该患者的肿瘤细胞中可见明显的黏液,所以病理医生考虑转移性黏液腺癌。但患者的胃肠镜检查未发现胃肠道原发肿瘤,阑尾标本中黏膜层未见黏液腺癌,结合影像学未发现胰腺、乳腺、胆道系统及宫颈的异常占位。临床表现不支持转移性黏液腺癌。可能提示转移性黏液腺癌的特点包括:卵巢表面受累;细胞外黏蛋白定位;破坏性基质侵犯;结节状生长方式;肝门侵犯;血管侵犯;印戒细胞;广泛的坏死[7,8,9]。该患者有卵巢表面的受累、细胞内外黏蛋白、破坏性基质侵犯、结节状生长方式;但无肝门侵犯、没有印戒细胞、没有广泛的坏死。MOC的标准免疫组化检测指标是CK7 +,CK20 +/-,CDX2 +/-,PAX8-,WT1-,ER-,PR-和SATB2-[10]。该患者的CK7 +,CK20-,CDX2-,PAX8-,WT1-,ER-,PR-和SATB2未作。该病例病理特点和免疫组化指标部分支持卵巢原发性黏液腺癌。
结合患者的临床数据及病理特点,谨慎考虑该患者为MOC,但由于MOC是罕见病,所以就此结果笔者与病理医师做了深入的探讨。最终该患者的病理切片经上海市临床病理读片会专家会诊后,仍支持MOC的诊断。
目前管理包括MOC的所有EOC的标准是:早期疾病的手术分期和晚期疾病的细胞减灭术,然后进行铂类化疗[11,12]。该患者术后诊断为右卵巢原发黏液性腺癌Ⅲc期(T3cN0M0),进行了力所能及的初次肿瘤细胞减灭术。MOC最常用的化疗方案是卡铂和紫杉醇的两药联合,这是所有EOC的标准方案。与其他卵巢上皮性癌亚型相比,MOC患者已被证明对以铂类为基础的化疗存在一定的耐药性,反应较差。MOC对铂类的反应率在12%~35%之间,而HGSC的反应率为70%[13]。采用其他化疗方案的临床试验包括了一小部分MOC患者(2.5%~7.0%)。由于MOC的发病率较低,因此主要与MOC相关的临床试验缺乏。
由于MOC和黏液性结肠癌的生物学和分子学相似性,因此建议采用胃肠道肿瘤化疗方案作为标准妇科治疗方案的替代方案,如吉西他滨/奥沙利铂。妇科肿瘤学小组(GOG)的241试验旨在探讨结直肠治疗方案在新诊断的MOC中的益处。这是一项Ⅲ期试验,将患者随机分配至卡铂/紫杉醇或卡培他滨/奥沙利铂。不幸的是,由于进展缓慢,该试验仅招募了50例患者并提前终止。在50例中有40例进行了病理复核,只有45%的病例被确诊为原发性MOC,其余为转移性黏液癌[14]。
在临床工作中,诊断MOC具有挑战性,对MOC的治疗多有争议。与其他卵巢上皮性癌亚型相比,MOC患者已被证明对以铂类为基础的化疗存在一定的耐药性,反应较差。与浆液性卵巢癌不同,MOC与BRCA基因突变或同源重组缺陷无关,使它们不太可能从PARP抑制剂中获益。到目前为止,还没有成功的专门针对MOC患者的前瞻性Ⅱ期或Ⅲ期随机临床试验,说明罕见肿瘤患者要获得高水平数据是非常困难的。通过对该例患者的诊治过程的分析研究,有助于为确定原发性MOC患者的治疗策略提供参考。
吴晶晶,陈琪珍,赵婷婷,等.原发性卵巢黏液腺癌1例[DB/OL].中国临床案例成果数据库,2023(2023-05-31).http://journal.yiigle.com/LinkIn.do?linkin_type=cma&DOI=10.3760/cma.j.cmcr.2023.e01555.
所有作者均声明本研究不存在利益冲突



























